Биотестирование является одним из важных методов выявления чистоты среды обитания организмов. Для биотестирования почвенных образцов чаще всего применяют олигохет и различных насекомых. Тесты с использованием живых организмов проводят для определения интегральной токсичности почвы с целью проверки соответствия качества почвы нормативным требованиям [1]. На реакции люмбрицид к токсикантам основаны следующие тесты, закрепленные в стандартах ISO: тест на острую токсичность (acutetoxicity), репродуктивный тест (reproduction), тест на биомассу (biomass) [2, 3, 4]. Любая пробоподготовка является очень важным этапом в биотестировании, особенно при качественном и количественном анализе на накопленные в тканях организмов вещества, чаще всего ионы тяжелых металлов. Именно от пробоподготовки зависит точность и воспроизводимость результатов в серии опытов. При использовании дождевых червей в качестве биотестов для определения накопленных в их тканях веществ многие исследователи сталкиваются с проблемой очищения желудочно-кишечного тракта дождевых червей, т.к. его содержимое (капролиты) вносит дополнительные, а часто и значимые изменения концентрации измеряемых веществ. К тому же не существует единой стандартизированной методики очищения желудочно-кишечного тракта люмбрицид, которая бы подходила под выполнение наибольшего числа критериев для выполнения задач, стоящих перед исследователем.
Исходя из этого, целью данного исследования является сравнительный анализ наиболее употребительных методов очищения пищеварительного тракта дождевых червей с использованием Eisenia fetida (Savigny, 1826).
Материал и методы исследования
Материалом для настоящего исследования послужили дождевые черви Eisenia fetida (Savigny, 1826), на которых проверялась эффективность нижеприведенных методов. Наиболее употребительными являются методы очистки кишечника, приведенные в методическом руководстве по исследованию структуры, функционированию и разнообразию детритных пищевых сетей под редакцией А.Д. Покаржевского, К.Б. Гонгальского и А.С. Зайцева [5]. В ходе эксперимента были использованы следующие методы.
1. Метод сатурированной фильтровальной бумаги.
В чашки Петри закладывается фильтровальная бумага, которая пропитывается водой до полного насыщения. Избыток воды удаляется. Животное помещается в чашки Петри. Дождевых червей перед посадкой споласкивают в воде. Выдерживаются животные в течение 2–3 дней при температуре 16–20 °C. Далби (Dalbi et al., 1996) отмечает, что выдерживание животных на субстрате в течении трех суток достаточно для полного освобождения кишечника дождевых червей [7].
2. Метод эвакуации содержимого желудка дождевых червей с помощью агар-агара (по Pokarzhevskii et al., 2000) [9].
Отвешивается 2 г агар-агара и заливается 200 мл воды. Емкость со смесью ставится в микроволновую печь на среднюю мощность на 2 мин. Расплавленный агар заливается в чашки Петри или пластиковые стаканы, после отвердения на поверхности агара проделываются отверстия ножом или препаровальной иглой. Помещаются черви и выдерживаются при температуре 20 °C в течении 4 суток. Покржевский [9] отмечает, что оптимальной средой является 1 % агар. Меньшая концентрация ведет иногда к гибели животных. На 4 сутки копролиты червей практически полностью состоят из агара. На 1 % агаре можно выдерживать и других животных для эвакуации содержимого кишечника. При этом агар не протыкают иглой или ножом. Для данной серии опытов использовалась смесь полисахаридов агарозы и агаропектина – микробиологический агар-агар с разной концентрацией, в расчете 2, 3, 4, 5 г сухого вещества на 1 л дистиллированной воды. Использование меньших концентрации агара считаем нецелесообразным, т.к. не происходит процесса затвердевания приготовленной массы (зависит от качества используемого сухого вещества).
3. Метод эвакуации содержимого желудка дождевых червей с помощью измельченной целлюлозы.
Метод разработан нами. Измельченная фильтровальная бумага помещается в чашки Петри, увлажняется до образования густой кашеобразной массы без образования свободной воды на дне чашки, далее в чашки помещаются исследуемые животные. После чего емкость покрывается х/б тканью, которая фиксируется резинками во избежание выползания люмбрицид. Выдерживается при температуре 20 °C в течении 4 суток.
Поскольку люмбрициды обладают отрицательным фототаксисом [6], чашки Петри с животными выдерживались в темном месте. В основе последних двух методов лежит замещение содержимого пищеварительного тракта на химически чистый субстрат. Принципиально отличается от них метод сатурированной фильтровальной бумаги, который заключается в «сухой» эвакуации содержимого пищеварительной системы люмбрицид, основанной на том, что в организм люмбрицид не поступают новые порции субстрата при продолжении естественного процесса опорожнения кишечника особей. Метод со вскрытием и ручной очисткой пищеварительного тракта червей не рассматривался, т.к. это довольно трудоемкий процесс, к тому же при дифференциальном исследовании тканей их можно повредить. Для экспериментов был выбран вид дождевых червей Eisenia fetida (Savigny, 1826), который является наиболее подходящим и часто используемым видом в лабораторных условиях [8]. Перед закладкой эксперимента люмбрициды выдерживались 3 суток на типичном для них субстрате, тем самым создавались стандартные условия по содержанию включений в желудочно-кишечном тракте организмов для всех повторностей. Каждая серия опытов состояла из 5 повторностей, в каждую емкость помещалось по 5 половозрелых особей. Контролем послужили экспериментальные данные по содержанию остаточных включений в пищеварительной системе 50 особей Eisenia fetida (Savigny, 1826), которые не использовались в методиках очистки, а непосредственно вскрывались после выдерживания на типичном субстрате. Всего в ходе эксперимента использовалось 150 особей. Ежедневно емкости осматривались с целью удаления погибших особей. По истечению 4-х суток каждая особь вынималась из контейнера, проводилась фиксация с последующим вскрытием пищеварительного тракта люмбрицид и количественно учитывалось наличие остаточных включений в кишечнике. В данном исследовании остаточными включениями считались комки субстрата размером 1–3 мм. Статистическая обработка данных осуществлялась с использованием программного обеспечения Statistica 6.
Результаты исследования и их обсуждение
На контроле содержание частиц составляет 26 ± 8,3 ед. (P < 0,05). Содержание частиц на субстрате с использованием агара с концентрацией сухого вещества от 3 до 4 г на литр однородно и составляет от 1,2 ± 0,5 до 1,3 ± 0,5 ед. При увеличении концентрации агара до 5 г/л наблюдается увеличение количества остаточных частиц в полости люмбрицид до 3,9 ± 1,2 (P < 0,05) единиц, что может быть связано с повышением густоты полученной смеси и затруднением перемещения червей во всем объеме субстрата. На измельченной и увлажненной фильтровальной бумаге показатель составил 2,3 ± 1,1 ед. (P < 0,05). Содержание остаточных включений является стабильным, но недостаточно удовлетворительным по количеству включений, к тому же необходимо уделить большее внимание чистоте субстрата. На сатурированной фильтровальной бумаге содержание остаточных частиц равно 1,2 ± 0,2 ед. (P < 0,05). Содержание остаточных частиц практически не различалось в эксперименте на сатурированной фильтровальной бумаге и на среде с концентрациями агара 3 и 4 г\л.
Результаты по содержанию включений в пищеварительной системе Eisenia fetida (Savigny, 1826) представлены на рис. 1.
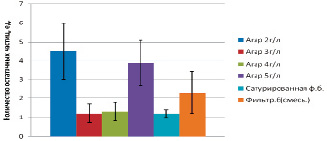
Рис. 1. Содержание включений в пищеварительной системе Eisenia fetida (Savigny, 1826)(ед.)
Также важным показателем при оценке методик подобного рода является выживаемость люмбрицид на субстрате (рис. 2).
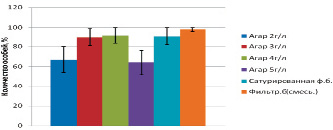
Рис. 2. Выживаемость Eisenia fetida (Savigny, 1826)(%)
На агаре с концентрацией 2 г/л выживаемость люмбрицид составляла 67 ± 13 % (P < 0,05). Из-за жидкого состояния агара субстрат проходил через желудочно-кишечный тракт неравномерно, местами задерживая большое количество остаточных частиц. При концентрации агара 3–4 г/л наблюдалась хорошая выживаемость люмбрицид и составляла 90 ± 9 % и 92 ± 8 % (P < 0,05) соответственно. При увеличении концентрации агара до 5 г/л проникновение в субстрат становится более затруднительным, что приводит к гибели люмбрицид, особенно ослабленных токсическим действием исследуемых веществ. Процент выживаемости составляет 64 ± 12 % (P < 0,05). Очень важным в данном случае является конечная вязкость полученного субстрата. Необходимо обращать внимание на назначение используемого сухого вещества (типа агара-агара). Для достижения наилучших результатов по минимизации содержания частиц в пищеварительной системе дождевых червей с последующим анализом на тяжелые металлы лучше всего использовать микробиологический агар. Если пробоподготовка не требует химической чистоты, то можно использовать пищевой агар и т.п. Также важны условия хранения и фирма-производитель вещества. Таким образом, при приготовлении субстрата концентрацию сухого вещества можно менять, добиваясь такого состояния субстрата, чтобы люмбрициды могли с легкостью передвигаться в его толще. На сатурированной фильтровальной бумаге выживаемость люмбрицид является отличной и составляет 91 ± 9 % (P < 0,05), но к концу эксперимента дождевые черви выглядят очень ослабленными с низкой двигательной активностью. В данном методе главным является оптимальное увлажнение, во избежание обезвоживания животных. Метод с использованием увлажненной целлюлозы оказался самым наилучшим по выживаемости люмбрицид 98 ± 2 % (P < 0,01). К концу эксперимента визуально дождевые черви проявляли высокую двигательную активность, были обнаружены 2 кокона, что свидетельствует о наиболее соответствующем физиологическим требованиям червей субстрате. В ситуациях, когда требуется долгая выдержка люмбрицид на чистом субстрате, этот метод наиболее приемлем.
Заключение
1. Лучшие результаты при исследованиях на содержание остаточных частиц в пищеварительном тракте Eisenia fetida получены в опытах с использованием агара с концентрацией от 3–4 г/л и методом сатурированной фильтровальной бумаги в качестве субстрата.
2. При увеличении концентрации агара с 5 г/л увеличивается вязкость субстрата, из-за чего перемещение люмбрицид, а соответственно поглощение и замещение субстрата на остаточные частицы снижается, при этом при уменьшении концентрации агара наблюдается гибель люмбрицид на субстрате, что приводит к невозможности завершения эксперимента.
3. Использование сатурированной фильтровальной бумаги показало отличный результат по остаточному содержанию частиц в пищеварительном тракте люмбрицид, но неудовлетворительный по общему состоянию животных и может быть рекомендовано в тех случаях, когда требуется предварительное обезвоживание образцов.
4. В серии опытов на увлажненной смеси фильтровальной бумаги результат по количеству остаточных включений оказался удовлетворительным, однако наилучшим по выживаемости и общей активности люмбрицид. Этот метод может быть применим для специфических исследований, где требуется долгое выдерживание животных на субстрате.
Рецензенты:
Сидоров Г.Н., д.б.н., профессор кафедры биологии, ФБГОУ ВПО «Омский государственный педагогический университет», г. Омск;
Андреева С.И., д.б.н., профессор, заведующая кафедрой биологии, ГБОУ ВПО «Омская государственная медицинская академия», г. Омск.
Работа поступила в редакцию 16.05.2013.
Библиографическая ссылка
Резниченко И.С. СРАВНИТЕЛЬНЫЙ АНАЛИЗ МЕТОДИК ОЧИЩЕНИЯ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ ДОЖДЕВЫХ ЧЕРВЕЙ ДЛЯ ЭКОТОКСИКОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ НА EISENIA FETIDA (SAVIGNY, 1826) // Фундаментальные исследования. 2013. № 6-5. С. 1156-1159;URL: https://fundamental-research.ru/ru/article/view?id=31706 (дата обращения: 24.12.2025).



