В настоящее время лазерные медицинские технологии широко используются в экспериментальной и клинической медицине. При этом в зависимости от конечной цели применяют лазерное излучение различной интенсивности. Биологические эффекты воздействия лазерного излучения на организм определяются механизмами взаимодействия излучения с тканями и зависят от длины волны излучения, длительности импульса (воздействия), частоты следования импульсов, площади облучаемого участка, а также от биологических и физико-химических особенностей облучаемых тканей и органов [2]. Биологические эффекты, возникающие при воздействии лазерного излучения на организм, условно подразделяют на 2 группы:
а) первичные эффекты – органические изменения, возникающие непосредственно в облучаемых живых тканях (прямое облучение);
б) вторичные эффекты – неспецифические изменения, возникающие в организме в ответ на облучение (длительное облучение диффузно отражённым излучением).
Клинические наблюдения, равно как и экспериментальные данные, полученные на изолированных клетках и лабораторных животных, сами по себе не позволяют ответить на вопрос о первичных молекулярных механизмах действия лазерного облучения на биологические структуры, но дают возможность сформулировать рабочую гипотезу о возможных первичных механизмах. Общепризнанным условием эффективного применения лазеров в терапии различных болезней является знание ключевой фотомолекулярной реакции, запускающей терапевтический процесс. Одной из рабочих гипотез считается гипотеза прямого возбуждения эндогенного кислорода в тканях лазерным излучением инфракрасного спектра, а именно на длине волны 1270 нм [3, 4]. Доказано, что инфракрасное лазерное излучение может переводить растворенный в тканях молекулярный кислород в синглетное состояние, такой эффект назвали светокислородным [3]. Синглетный кислород обладает очень высокой химической активностью [3]: он может участвовать в цепных свободно-радикальных реакциях, окислять аминокислоты в белках, гуанин в ДНК, инициировать перекисное окисление липидов [8]. После выяснения первичного механизма – фотовозбуждения молекул кислорода в биожидкостях организма (крови) в состояние синглетного молекулярного кислорода – возникает ряд принципиальных вопросов по физике происходящих явлений [4]. Одновременно неизвестны механизмы последующей реализации процессов регенерации, апоптоза или некроза и их зависимость от биологического портрета облучаемых тканей и дозы облучения. Полагают, что усиление светокислородного эффекта возможно при увеличении интенсивности лазерного излучения (ЛИ). Последнее может быть за счет увеличения импульсной мощности при сохранении средней мощности [7]. Основными преимуществами фемтосекундных лазеров является малая длительность импульса, высокая пиковая (кВт) и малая средняя (мВт) мощности, что позволяет предполагать отсутствие выраженных термических эффектов. Однако на сегодня не изучен локальный и системный механизм действия фемтосекундного лазерного излучения на организм млекопитающих in vivo.
Целью нашего исследования было изучение влияния фемтосекундного лазерного излучения (ФСЛИ) с длиной волны 1550 нм на кровь и кожу здоровых мышей.
Материалы и методы исследования
Объектом исследования служили белые нелинейные половозрелые мыши, которых облучали фемтосекундным (ФС) лазером в разных дозах.
В качестве источника излучения использовался ФС эрбиевый лазер, излучающий в ближнем инфракрасном диапазоне (λ = 1550 нм) и работающий в импульсным режиме (τимп = 100·10–15 с) с пиковой мощностью – 6 кВт, средней мощностью – 1,25 мВт, являющийся совместной разработкой Научного центра волоконной оптики РАН и Центра нанотехнологий Ульяновского государственного университета.
Животные экспериментальной группы подвергались десятикратному ежедневному лазерному облучению. При облучении фемтосекундным лазером средняя плотность потока энергии на ткань (энергетическая доза) за одну процедуру составляла 0,06 Дж/см2 в течение 2,5 минут и 0,12 Дж/см2 в течение 5 минут. При этом облучение проходило в импульсном режиме при огромной пиковой интенсивности 1910,8 Вт/см. В первом случае облучения суммарная плотность потока энергии ЛИ на ткань за курс составила 0,6 Дж/см2, а во втором – 1,2 Дж/см2.
Для оценки системы «перекисное окисление липидов – антиоксиданты» (ПОЛ-АО) в эритроцитах и плазме крови определяли уровень малонового диальдегида (МДА) в тесте с тиобарбитуровой кислотой [1], а также активность ферментов системы антиоксидантной защиты (АОЗ): каталазы и глутатион-S-трансферазы (ГТ) [5].
После облучения проводили гистологическое исследование кожи мышей с облучаемого участка. Для этого кожные лоскуты фиксировали в 10 % нейтральном формалине, обезвоживали в спиртах, заключали в парафин. Из парафиновых блоков изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилин-эозиноном.
Статистическая значимость полученных результатов оценивалась с помощью непараметрического критерия Манна‒Уитни. Различия между группами считали достоверными при р < 0,05.
Результаты исследования и их обсуждение
При облучении интактных мышей ФС лазером в дозах 0,6 и 1,2 Дж/см2 в эритроцитах статистически значимо возрастает уровень МДА. При этом резкое увеличение его при плотности потока энергии 0,6 Дж/см2 сменяется снижением при увеличении плотности потока энергии вдвое (рис. 1).
Динамика показателей активности антиоксидантных ферментов – каталазы и ГТ – в принципе была аналогичной – повышение при плотности потока энергии 0,6 Дж/см2 и снижение при 1,2 Дж/см2 (табл. 1).
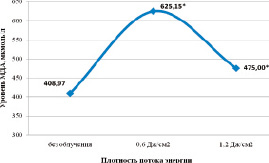
Рис. 1. Уровень малонового диальдегида (мкмоль/л) в эритроцитах интактных мышей после воздействия ФСЛИ. Примечание: * – данные, статистически значимо отличающиеся от данных без облучения, р ≤ 0,05
Таблица 1
Активность антиоксидантных ферментов в эритроцитах мышей после воздействия разных доз ФСЛИ
|
Плотность потока энергии ФСЛИ Показатель |
Без облучения |
0,6 Дж/см2 |
1,2 Дж/см2 |
|
ГТ, ммоль/мин/л |
0,326 ± 0,065 |
0,602 ± 0,06* |
0,504 ± 0,04* |
|
Каталаза, ммоль/мин/л |
1,72 ± 1,3 |
7,26 ± 2,7* |
6,27 ± 1,24* |
Примечание: * – данные, статистически значимо отличающиеся от данных без облучения, р ≤ 0,05.
В плазме крови значимое изменения – снижение уровня МДА и возрастание активности каталазы – имело место только при плотности потока облучения 0,6 Дж/см2 (табл. 2).
Таблица 2
Влияние различных доз ФСЛИ на показатели системы ПОЛ-АОплазмы крови интактных мышей
|
Плотность потока энергии ФСЛИ Показатель |
Без облучения |
0,6 Дж/см2 |
1,2 Дж/см2 |
|
МДА, мкмоль/л |
9,4 ± 2,22 |
5,64 ± 0,71* |
7,95 ± 1,34 |
|
ГТ, ммоль/мин/л |
0,022 ± 0,001 |
0,026 ± 0,005 |
0,021 ± 0,001 |
|
Каталаза, ммоль/мин/л |
0,9 ± 0,12 |
1,88 ± 0,62* |
1,12 ± 0,14 |
Примечание: * – данные, статистически значимо отличающиеся от данных без облучения, р ≤ 0,05.
Результаты биохимического исследования позволяют сделать вывод о том, что система ПОЛ-АО в эритроцитах мышей после облучения ФС лазером в используемых дозах переходит на более высокий уровень функционирования. Разнонаправленные изменения параметров системы ПОЛ-АО в плазме крови при ФСЛИ с плотностью потока энергии 0,6 Дж/см2 позволяют предполагать возможность возникновения оксидативного стресса.
Данные, полученные в результате гистологических исследований, позволяют предположить, что ФСЛИ может оказывать дозозависимое влияние на гистологические структуры кожи облучаемых животных.
В контрольных образцах эпидермис и дерма обычного гистологического строения. В подкожно-жировой клетчатке – слабая лимфоидно-лейкоцитарная инфильтрация с преобладанием нейтрофильных лейкоцитов (рис. 2). Облучение при плотности потока энергии 0,6 Дж/см2 приводит к утолщению эпидермиса и появлению гиперкератоза по поверхности. Дерма и подкожно-жировая клетчатка при этом обычного гистологического строения, без воспалительной инфильтрации (рис. 3). Облучение при плотности потока энергии 1,2 Дж/см2 приводит к утолщению эпидермиса и появлению гиперкератоза на поверхности. Дерма при этом умеренно утолщена за счёт разрастания плотной фиброзной ткани (очаги фиброзирования дермы) с сильной лимфоцитарной инфильтрацией (рис. 4).
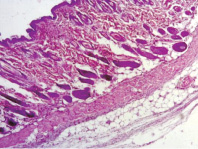
Рис. 2 Контроль, общий план. Окраска гематоксилин-эозином, увеличение ×20
Таким образом, на основании результатов, полученных в данном исследовании, и результатов, полученных нами ранее [9], можно сделать вывод о том, что фемтосекундное лазерное излучение может оказывать триггерное (пусковое) воздействие на биохимические показатели крови, при этом вызывая дозозависимые измененения в гистологических структурах кожи облучаемых животных.
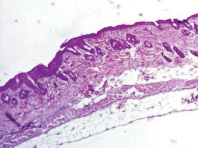
Рис. 3. После облучения при плотности потока энергии 0,6 Дж/см2. Окраска гематоксилин-эозином, увеличение ×20
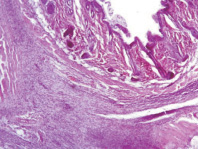
Рис. 4. После облучения при плотности потока энергии 1,2 Дж/см2. Окраска гематоксилин-эозином, увеличение ×20
Работа поддержана Государственным заданием Минобрнауки РФ.
Рецензенты:
Каталымов Л.Л., д.б.н., профессор кафедры «Анатомия, физиология и гигиена человека», ФГБОУ ВПО «Ульяновский государственный педагогический университет имени И.Н. Ульянова», г. Ульяновск;
Любин Н.А., д.б.н., профессор, заведующий кафедрой морфологии, физиологии и фармакологии, ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия», г. Ульяновск.
Работа поступила в редакцию 08.05.2013.
Библиографическая ссылка
Генинг Т.П., Воронова О.С., Абакумова Т.В., Долгова Д.Р., Золотовский И.О. ВЛИЯНИЕ ФЕМТОСЕКУНДНОГО ЛАЗЕРНОГО ИЗЛУЧЕНИЯ С ДЛИНОЙ ВОЛНЫ 1550 НМ НА КРОВЬ И КОЖУ МЫШЕЙ // Фундаментальные исследования. 2013. № 6-5. С. 1146-1149;URL: https://fundamental-research.ru/ru/article/view?id=31704 (дата обращения: 08.01.2026).



