Стандартным методом выявления полиморфизма структурных генов на уровне ДНК является ПЦР-анализ с последующим рестрикционным гидролизом образующихся фрагментов (ПЦР-ПДРФ). Суть метода заключается в амплификации определенного фрагмента ДНК, содержащего анализируемую точковую мутацию, с последующим расщеплением наработанного ампликона соответствующей рестриктазой для идентификации аллелей анализируемого гена. Данный метод получил широкое распространение благодаря своей простоте и надежности. Он рутинно используется для диагностики аллельного полиморфизма ряда генов-кандидатов, связанных с локусами хозяйственно-полезных признаков сельскохозяйственных животных [2, 5].
Благодаря таким свойствам, как простота и надежность, данный метод получил широкое распространение и до сих пор популярен, хотя и имеет некоторые ограничения – во-первых, он позволяет детектировать только полиморфизмы единичных нуклеотидов, расположенные в сайтах рестрикции, а во-вторых, годится лишь для детекции уже известных полиморфизмов единичных нуклеотидов [6].
Цель настоящей работы – оптимизация протоколов проведения ПЦР-ПЦРФ-анализа для генотипирования свиней по генам пролактинового рецептора (PRLR), эстрогенового рецептора (ESR), белка, связывающего жирные кислоты (H-FABP) и меланокортиного рецептора 4 (MC4R), ответственных за продуктивные качества.
Материалы и методы исследования
Для проведения ДНК-диагностики у свиней были отобраны пробы крови. Кровь, полученную у свиней, вносили в пробирки с 100 мМ ЭДТА до конечной концентрации 10 мМ. ДНК из крови выделяли комбинированным щелочным способом.
Анализ локуса гена PRLR при проведении ПЦР-ПДРФ. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,125 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров PRLR1 и PRLR2 [4] для амплификации фрагмента гена PRLR длиной 161 пар нуклеотидов (рис. 1), 1 мкл пробы ДНК в следующем режиме:
×1: 94 °С – 4 мин; ×40: 94 °С – 5 с, 65 °С – 5 с, 72 °С – 5 с;
×1: 72 °С – 5 мин; хранение: 4 °С.
Для определения аллельного полиморфизма гена PRLR по вариантам А и В 20 мкл ПЦР пробы обрабатывали 2 ед. эндонуклеазы рестрикции AluI в 1×буфере «Y» фирмы «СибЭнзим» (Россия) при 37 °C в течение ночи.
Анализ локуса гена ESR при проведении ПЦР-ПДРФ. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,125 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров ESR-F и ESR-R [2] для амплификации фрагмента гена ESR длиной 185 пар нуклеотидов (рис. 2), 1 мкл пробы ДНК в следующем режиме:
×1: 94 °С – 4 мин; ×40: 94 °С – 5 с, 65 °С – 5 с, 72 °С – 5 с;
×1:72 °С – 5 мин; хранение: 4 °С.
Для определения аллельного полиморфизма гена ESR по вариантам M и W 20 мкл ПЦР пробы обрабатывали 10 ед. эндонуклеазы рестрикции Ama87I в 1×буфере «W» фирмы СибЭнзим (Россия) при 37 °C в течение ночи.
Анализ локуса гена H-FABP при проведении ПЦР-ПДРФ. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров H-FABP-F и H-FABP-R [3] для амплификации фрагмента гена H-FABP длиной 800 пар нуклеотидов (рис. 3), 1 мкл пробы ДНК в следующем режиме:
×1: 94 °С – 4 мин; ×40: 94 °С – 30 с, 60 °С – 30 с, 72 °С – 30 с;
×1:72 °С – 10 мин; хранение: 4 °С.
Для определения аллельного полиморфизма гена H-FABP по вариантам А и В 20 мкл ПЦР пробы обрабатывали 10 ед. эндонуклеазы рестрикции HaeIII в 1×буфере «G» фирмы «СибЭнзим» (Россия) при 37 °C в течение ночи.
Анализ локуса гена MC4R при проведении ПЦР-ПДРФ. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров MC4R-F и MC4R-R [3] для амплификации фрагмента гена MC4R длиной 226 пар нуклеотидов (рис. 4), 1 мкл пробы ДНК в следующем режиме:
×1: 94 °С – 4 мин; ×40: 94 °С – 15 с, 55 °С – 15 с, 72 °С – 15 с;
×1: 72 °С – 7 мин; хранение: 4 °С.
Для определения аллельного полиморфизма гена MC4R по вариантам А и В 20 мкл ПЦР пробы обрабатывали 20 ед. эндонуклеазы рестрикции TaqI в 1×буфере «W» фирмы «СибЭнзим» (Россия) при 65 °C в течение ночи.
Детекция генов PRLR, ESR, H-FABP, MC4R. Для визуализации фрагментов ДНК пробы вносили в лунки 2–3 % агарозного геля с содержанием этидия бромида (0,5 мкг/мл) и проводили горизонтальный электрофорез при 15 В/см в течение 40 мин в 1×ТВЕ буфере. После электрофореза гель просматривали в УФ-трансиллюминаторе при длине волны 310 нм. Идентификацию генотипов осуществляли по количественным и качественным признакамПЦР-ПДРФ.
Результаты исследования и их обсуждение
Для оценки качества работы известного протокола по генотипированию свиней по гену PRLR нами была протестирована серия олигонуклеотидных праймеров: PRLR1: 5/-CGGCCGCAGAATCCTGCTGC-3/ и PRLR2: 5/-ACCCCACCTTGTAACCCATCATCC-3/ [4] по усовершенствованной нами технике ПЦР-ПДРФ (см. «Материалы и методы исследования»).
Праймеры PRLR1 + PRLR2 инициируют амплификацию фрагмента гена PRLR свиней длиной 161 bp, а ПДРФ-AluI профиль (AA = 126/35 bp, BB = 91/35 bp и AB = 126/91/35 bp) идентифицирует его генотипы (рис. 1).
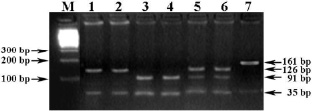
Рис. 1. Электрофореграмма результата ПЦР-ПДРФ гена PRLR с праймерами PRLR1 + PRLR2 и эндонуклеазным расщеплением ферментом AluI.Обозначения: М – ДНК-маркеры 100 bp (СибЭнзим); 1–2 – генотип АА (126/35 bp); 3–4 – генотип ВВ (91/35 bp); 5–6 – генотип АВ (126/91/35), 7 – цельный ПЦР-продукт гена PRLR (161 bp)
Для оценки качества работы известного протокола по генотипированию свиней по гену ESR нами была протестирована серия олигонуклеотидных праймеров: ESR-F: 5/-CCCTCTAT-GACCTGCTGCTG-3/ и ESR-R: 5/-TCAGATTGTGGTGGGGAAGTTC-3/ [2] по усовершенствованной нами технике ПЦР-ПДРФ (см. «Материалы и методы исследования»).
Праймеры ESR-F + ESR-R инициируют амплификацию фрагмента гена ESR свиней длиной 185 bp, а ПДРФ-Ama87I профиль (MM = 76/62/47 bp, WW = 109/76 bp и MW = 109/76/62/47 bp) идентифицирует его генотипы (рис. 2).
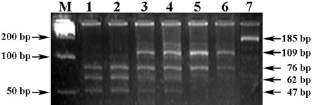
Рис. 2. Электрофореграмма результата ПЦР-ПДРФ гена ESR с праймерами ESR-F + ESR-R и эндонуклеазным расщеплением ферментом Ama87I.Обозначения: М – ДНК-маркеры 100 bp (СибЭнзим); 1–2 – генотип MM (76/62/47 bp); 3–4 – генотип MW (109/76/62/47); 5–6 – генотип WW (109/76 bp); 7 – цельный ПЦР-продукт гена ESR (185 bp)
Для оценки качества работы известного протокола по генотипированию свиней по гену H-FABP нами была протестирована серия олигонуклеотидных праймеров H-FABP-F: 5/-ATT-GCTTCGGTGTGTTTGAG-3/ и H-FABP-R: 5/-TCAGGAATGGGAGTTATTGG-3/ [3] по усовершенствованной нами технике ПЦР-ПДРФ (см. «Материалы и методы исследования»).
Праймеры H-FABP-F + H-FABP-R инициируют амплификацию фрагмента гена H-FABP свиней длиной 800 bp, а ПДРФ-HaeIII профиль (АА = 683/117 bp, ВВ = 405/278/117 bp и АВ = 683/405/278/117 bp) идентифицирует его генотипы (рис. 3).
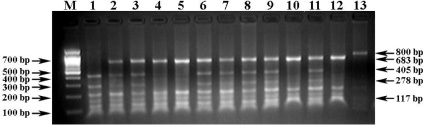
Рис. 3. Электрофореграмма результата ПЦР-ПДРФ гена H-FABP с праймерами H-FABP-F + H-FABP-R и эндонуклеазным расщеплением ферментом HaeIII. Обозначения: М – ДНК-маркеры 100 bp (СибЭнзим); 1 – генотип ВВ (405/278/117 bp); 2–3, 6–9, 11 – генотип АВ (683/405/278/117 bp); 4–5, 10, 12 – генотип АА (683/117); 13 – цельный ПЦР-продукт гена H-FABP (800 bp)
Для оценки качества работы известного протокола по генотипированию свиней по гену MC4R нами была протестирована серия олигонуклеотидных праймеров: MC4R-F: 5/-TACCC-TGACCATCTTGATTG-3/ и MC4R-R: 5/-ATAGCAACAGATGATCTCTTTG-3/ [3] по усовершенствованной нами технике ПЦР-ПДРФ (см. «Материалы и методы исследования»).
Праймеры MC4R-F + MC4R-R инициируют амплификацию фрагмента гена MC4R свиней длиной 226 bp, а ПДРФ-TaqI профиль (АА = 226 bp, ВВ = 156/70 bp и АВ = 226/156/70 bp) идентифицирует его генотипы (рис. 4).
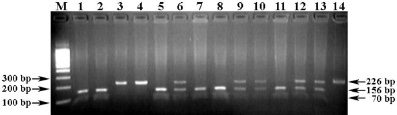
Рис. 4. Электрофореграмма результата ПЦР-ПДРФ гена MC4R с праймерами MC4R-F + MC4R-R и эндонуклеазным расщеплением ферментом TaqI. Обозначения: М – ДНК-маркеры 100 bp (СибЭнзим); 1–2, 5, 7–8, 11 – генотип ВВ (156/70 bp); 3–4 – генотип АА (226 bp); 6, 9–10, 12–13 – генотип АВ (226/156/70); 14 – цельный ПЦР-продукт гена MC4R (226 bp)
Вывод
Полученные результаты ПЦР-ПДРФ-анализа с праймерами PRLR1 + PRLR2, ESR-F + ESR-R, H-FABP-F + H-FABP-R и MC4R-F + MC4R-R являются удовлетворительными в плане воспроизводимости и идентификации генотипов генов PRLR, ESR, H-FABP и MC4R свиней.
Рецензенты:
Хазипов Н.З., д.вет.н., профессор кафедры биологической и неорганической химии Казанской государственной академии ветеринарной медицины, заслуженный деятель РТ и РФ, г. Казань;
Пронин Б.Г., д.б.н., профессор кафедры акушерства и патологии животных Казанской государственной академии ветеринарной медицины, заслуженный деятель РТ, г. Казань.
Работа поступила в редакцию 07.05.2013.
Библиографическая ссылка
Нургалиев Ф.М., Ахметов Т.М., Гиниятуллин И.И., Тюлькин С.В., Вафин Р.Р. ОПТИМИЗАЦИЯ ТЕХНИКИ ПЦР-ПДРФ ДЛЯ ГЕНОТИПИРОВАНИЯ СВИНЕЙ ПО ГЕНАМ PRLR, ESR, H-FABP, MC4R // Фундаментальные исследования. 2013. № 6-4. С. 918-921;URL: https://fundamental-research.ru/ru/article/view?id=31663 (дата обращения: 13.02.2026).



