Клещевой энцефалит (КЭ) – инфекционное, вирусное, природно-очаговое заболевание, сопровождающееся воспалительными изменениями в нервной системе. Заболеваемость человека КЭ регистрируется более чем в 30 странах мира [7]. Очаги клещевого энцефалита распространены на всей территории Российской Федерации. КЭ отличается полиморфизмом клинических проявлений, обусловленных дистрофическими и некробиотическими процессами в нейронах головного и спинного мозга, диффузным периваскулярным отеком и изменениями миелиновой оболочки нервных волокон [7]. Хотя существуют достаточно надёжные вакцины против КЭ, заболевание имеет тенденцию к расширению, при этом возрастает число тяжёлых форм, на фоне которых регистрируются энцефалиты с летальным исходом. Имеются коммерческие антитела (АТ) к КЭ (класса IgG), однако их применение в качестве лечебных средств при КЭ остаётся под вопросом. Несмотря на интенсивный поиск лечебно-профилактических препаратов (в основном иммуномодуляторов), в настоящее время в медицинской практике большинство из них оказывается недостаточно эффективными. Вышеперечисленные проблемы в значительной степени связаны с недостаточной изученностью иммунопатогенеза КЭ. В настоящем исследовании нами в условиях эксперимента было изучено влияние препарата, содержащего полипренилфосфат натрия (ППФ), на течение инфекции, вызванной ВКЭ, у мышей и индукцию цитокинов (ЦТ) в головном мозге при интрацеребральном (и.ц.) введении вируса и препарата. Было показано, что визуальные признаки КЭ у мышей ассоциированы с выраженным увеличением экспрессии генов провоспалительных ЦТ в ткани головного мозга («цитокиновый шторм»). ППФ, введённый в мозг мышам одновременно с вирусом, предотвращал вирусиндуцированный «цитокиновый шторм» и развитие энцефалита. Выявлено, что человеческий IgG, введённый на ранних сроках относительно заражения вирусом, обладал способностью защищать животных, при этом введение АТ в более поздние сроки (за 1–3 суток до проявления клинических признаков КЭ) не препятствовало развитию клинически выраженного КЭ. Нами было экспериментально показано, что иммуномодулирующий препарат на основе ППФ обладал способностью потенцировать защитное действие АТ, введённых на поздних сроках относительно заражения.
Целью настоящего исследования было изучение молекулярных механизмов иммунопатогенного действия ВКЭ в головном мозге мышей с визуальными признаками инфекции и разработка экспериментального подхода к иммунотерапии КЭ.
Материал и методы исследования
Животные
В экспериментах использовали беспородных мышей обоего пола массой 10–14 г, а также самцов мышей линии Balb/c, полученных из питомника «Столбовая» РАМН. Опыты на животных проводились согласно правилам Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях.
Вирус
Использовали вирус клещевого энцефалита (ВКЭ) /штамм Софьин/, высокопатогенный для мышей. ВКЭ получали из отделения энцефалитной вакцины Предприятия им. М.П. Чумакова. Вирус использовали в виде мозговой суспензии заболевших мышей-сосунков, заражённых и.ц. Предварительно вирус титровали на беспородных белых мышах массой 10–12 г, заражённых интраперитонеально (и.п.) или и.ц.
Препараты
1. В опытах использовали препарат, содержащий в виде действующего начала ППФ, полученный из ЗАО «Микро-плюс». В случае перорального введения препарата животных выпаивали по 0,1 мл ППФ в концентрации 1 мг/мл (100 мкг/мышь), разведенного в дистиллированной воде. ППФ в разовых дозах вводили животным трёхкратно через день, после чего через 24 часа заражали и.п. ВКЭ в дозе 1LD50. В случае и.ц. заражения мышей препарат вводили однократно одновременно с вирусом в объеме 0,03 мл в концентрации 2 мг/мл ППФ (60 мкг/мышь) и ВКЭ в дозах 0,1LD50, 1LD50, 10LD50. В случае внутримышечного (в.м.) применения препарат вводили в объеме 0,2 мл в концентрации 0,4 мг/мл ППФ (80 мкг/мышь).
2. Преднизолон (ОАО «Биосинтез», г. Пенза, Россия) в форме таблеток, содержащих по 0,005 г активного вещества. 1 таблеку растворяли в 5 мл дистиллированной воды, мышам вводили по 100 мкл per os (разовая доза 0,1 мг/мышь), препарат вводили трёхкратно на 6, 7 и 8 сутки после заражениия ВКЭ.
3. Иммуноглобулин человеческий против вируса клещевого энцефалита (ЗАО «Микроген», Россия), содержащий титр гемагглютинирующих антител 1:80, разводили физиологическим раствором в 10 раз и вводили в.м. в объеме 0,2 мл/мышь (разовая доза составила 1 мл/кг). В случае лечебно-профилактического применения иммуноглобулин вводили на 1-е, 0, 1-е, 3-и сутки относительно заражения ВКЭ. В случае лечебного применения на 3-и и 4-е сутки относительно заражения ВКЭ.
Наблюдение за животными проводили ежедневно в течение 21 суток. По окончании эксперимента проводили расчёт показателей:
1) выживаемости: отношение количества выживших мышей к общему количеству животных в группе (в %);
2) летальности: отношение количества погибших мышей к общему количеству животных в группе (в %);
3) средней продолжительности жизни (СПЖ) по формуле:
![]()
где t – СПЖ; ti – срок жизни каждого животного; N – число животных в группе. Оставшимся в живых животным приписывается условное время выживания, равное ∞. Для полученных значений рассчитывали величину среднего квадратического отклонения. Достоверность различий летальности и выживаемости животных определяли с помощью t-критерия Стьюдента.
ОТ-ПЦР в реальном времени
Синтез кДНК проводили при помощи набора с MMLV обратной транскриптазой (ОТ) фирмы «Силекс», Россия. При постановке ПЦР в реальном времени использовались наборы с Hot Start Taq ДНК-полимеразой и интеркалирующим красителем SYBR GREEN производства фирмы «Синтол», Россия. Подбор праймеров осуществлялся в программе OLIGO 6. Для предотвращения синтеза с геномной ДНК, присутствующей в образцах РНК, праймеры подбирались таким образом, чтобы 3’-концевой участок хотя бы одного из пары, состоящий не более чем из 5 нуклеотидов, перекрывал границы двух соседних экзонов исследуемого гена. Величина относительной экспрессии исследуемого гена вычислялась по формуле:
![]()
где CT(контроля) – среднее значение порогового цикла C(t) для контрольного образца; CT (образца) – среднее C(t) для экспериментального образца. Значения относительной экспрессии исследуемых генов нормировались по уровням относительной экспрессии гена HPRT1. Фрагменты кДНК исследуемых генов амплифицировали с использованием праймеров следующих последовательностей: HPRT1: прямой 5’GGATACAGGCCAGACTTTGTT 3’ и обратный 5’ GGCTTTTCCAGTTTCACTAATG 3’, IFNγ: прямой 5’ GAGGAACTGGCAAAAGGATG 3’ и обратный 5’ GCTGATGGCCTGATTGTCTT 3’, TNFα: прямой 5’ CAGACCCTCACACTCAGATCA 3’ и обратный 5’ CACTTGGTGGTTTGCTACGA 3’, IL1a: прямой 5’ CCCGTGTTGCTGAAGGAGT 3’ и обратный 5’ CCAGAAGAAAATGAGGTCGGT 3’, IL1b: прямой 5’ CAGGCTCCGAGATGAACAAC 3’ и обратный 5’ TCATGGAGAATATCACTTGTTGG 3’, IL2: прямой 5’ AGAAGATGAACTTGGACCTCTG 3’ и обратный 5’ TGTGTTGTCAGAGCCCTTTAG 3’ IL4: прямой 5’ TCCTCACAGCAACGAAGAAC 3’ и обратный 5’ TGCAGCTCCATGAGAACACTA 3’, IL6: прямой 5’ CGTGGAAATGAGAAAAGAGTTGT 3’ и обратный 5’ GCATCCATCATTTCTTTGTATCT 3’, IL10: прямой 5’ TGAGGCGCTGTCATCGATT 3’ и обратный 5’ GACACCTTGGTCTTGGAGCTT 3’, IL12a: прямой 5’ ATGAGCTGATGCAGTCTCTGAA 3’ и обратный 5’ ACTCTGTAAGGGTCTGCTTCTC 3’, IL12b: прямой 5’ TTCATCAGGGACATCATCAAAC 3’ и обратный 5’ TGACCTCCACCTGTGAGTTCTT 3’, IL15: прямой 5’ AACTGCTTTCTCCTGGAATTG 3’ и обратный 5’ CCAGATTCTGCTACATTCTTGTT 3’, IL18: прямой 5’ TGAAGAAAATGGAGACCTGGA 3’ и обратный 5’ TCTGGGGTTCACTGGCACT 3’, IL23: прямой 5’ ACTCAAGGACAACAGCCAGTTC 3’ и обратный 5’ AGTAGGGAGGTGTGAAGTTGCT 3’, CD4: прямой 5’ CCAAGATGAGACTGACCCTGAA 3’ и обратный 5’ TTCACCCCTCTGGATAAAACCT 3’, CD25: прямой 5’ CTGCAAGATGAAGTGTGGGAA 3’ и обратный 5’ TGTGGGTTGTGGGAAGTCTG 3’, TBEV: прямой 5’ GTACAACATGATGGGCAAGAGA 3’ и обратный 5’ GCCAGCCCAGGTAGTTCAAG 3’, ОТ-праймер 5’ TTGACAACTTCTTGAGGTGCCA 3’. ПЦР в реальном времени проводилась на амплификаторе CFX96, Bio-Rad, США. Анализ результатов ПЦР и статистическая обработка производились при помощи программного обеспечения Bio-Rad CFX Manager Software Ver. 1.6.
Результаты исследования и их обсуждение
Защитное действие ППФ при и.ц. способе заражения и введения препарата
В результате проведенных исследований нами было установлено, что после и.ц. заражения мышей у животных с визуальными признаками заболевания регистрируется картина «цитокинового шторма» (рис. 1).
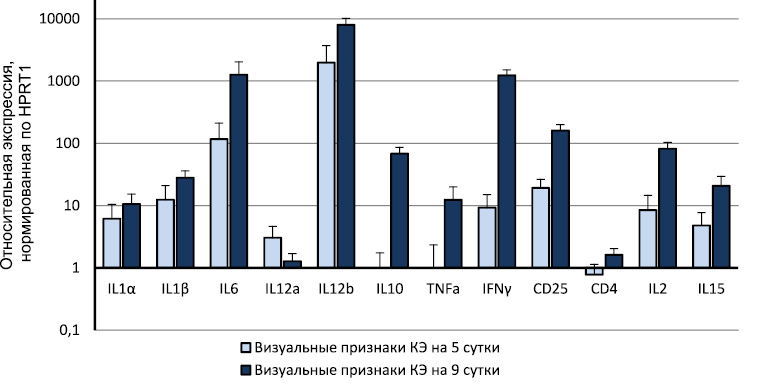
Рис. 1. Увеличение экспрессии генов некоторых иммуннорегуляторных молекул в головном мозге мышей с визуальными признаками КЭ по сравнению с интактными животными
Этот факт свидетельствует о том, что одной из причин летального исхода КЭ является развитие вирус-индуцированного воспалительного процесса в головном мозге. Для предотвращения развития данного патологического процесса необходим тщательный выбор соответствующих препаратов. В нашем исследовании был использован ППФ, входящий в состав таких известных и хорошо зарекомендовавших себя препаратов, как «Фортепрен», «Фоспренил», «Гамапрен». Препараты «Фоспренил» и «Гамапрен» широко используются в ветеринарии для профилактики и лечения вирусных инфекций [1, 2, 4]. Фортепрен в настоящее время проходит клинические испытания для внедрения в медицинскую практику в качестве иммуномодулятора с противовирусной активностью.
Показано, что максимальное снижение летальности и увеличение СПЖ ППФ обеспечивает при и.ц. введении ВКЭ в дозе, вызывающей гибель 67 % животных (табл. 1).
Таблица 1
Протективная активность ППФ при и.ц. заражении вирусом в 3-х разных 10-кратных разведениях и введении препарата мышам линии Balb/c (n = 15 мышей в группе).
|
Группы |
Летальность |
СПЖ (сут.) |
ΔСПЖ |
|
1. ВКЭ (10–7) |
67 ± 12 % |
9,1 ± 1,3 |
62,9 |
|
2. ВКЭ (10–7) + ППФ |
9 ± 7 % |
72 ± 3,3 |
|
|
3. ВКЭ (10–8) |
33 ± 12 % |
27,2 ± 2,7 |
52,8 |
|
4. ВКЭ (10–8) + ППФ |
10 ± 8 % |
80 ± 5,6 |
|
|
5. ВКЭ (10–9) |
27 ± 11 % |
67,8 ± 4,5 |
н.о. |
|
6. ВКЭ (10–9) + ППФ |
0 % |
н.о. |
Весьма интересно, на наш взгляд, что введение в головной мозг мышей вируса и ППФ приводит к максимальной защите животных (по сравнению с другими способами его введения), что, по-видимому, свидетельствует о способности ППФ предотвращать развитие «цитокинового шторма» в непосредственной мишени для ВКЭ – головном мозге. При определении РНК ВКЭ у инфицированных животных выявлено, что у мышей с выраженной неврологической симптоматикой (параличи и парезы задних конечностей) в мозге обнаруживалась РНК ВКЭ в количествах, эквивалентных 1010–1011 БОЕ/мл. У незаболевших на 15-е сутки животных РНК ВКЭ обнаруживалась в следующих соотношениях. В случае одновременного введения ВКЭ и ФП – в 64 % случаев, а при введении ВКЭ без ФП – в 33 %. При этом количество вирусной РНК было эквивалентно 103–104 БОЕ/мл.
Нами было изучено влияние ВКЭ и ППФ на экспрессию генов цитокинов в головном мозге на ранние сроки после и.ц. заражения или введения ППФ (рис. 2). При и.ц. введении среды 199 или вирусной суспензии было выявлено увеличение по сравнению с интактными животными экспрессии гена IL6, что является реакцией на черепно-мозговую травму при данном способе введения. В то же время уровень экспрессии гена IL6 в группе мышей, которым и.ц. вводили ППФ, превышал таковой уровень в группе мышей, которым и.ц. вводили среду 199, в 5,4 раза (p < 0,05). По-видимому, это свидетельствует о способности ППФ активировать механизмы врожденного иммунитета, что способствует раннему подавлению репродукции вируса.
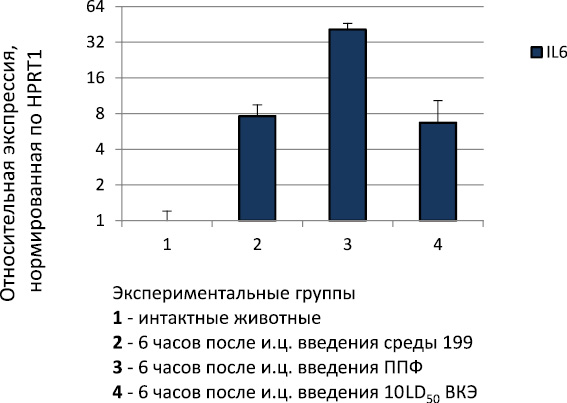
Рис. 2. Экспрессия гена IL6 в головном мозге мышей через 6 часов после и.ц. заражения или введения ППФ
Пероральное применение ППФ и преднизолона при периферическом заражении мышей
Данные, представленные в табл. 2, показывают, что ППФ при пероральном способе введения увеличивал СПЖ (p < 0.05) животных, зараженных ВКЭ и.п. в дозе 1LD50 (табл. 2, группы 2 и 1) по сравнению с контрольными животными, которых выпаивали водой.
Таблица 2
Оценка профилактического противовирусного действия ППФ и преднизолона, введенных per os, при экспериментальном клещевом энцефалите у беспородных мышей обоего пола массой 18–20 г (n = 15–16)
|
Группы |
Летальность |
СПЖ (сут.) |
|
1. Вода |
56 ± 13 % |
19 ± 3 |
|
2. ППФ |
50 ± 13 % |
22,2 ± 0,8 |
|
3. Преднизолон |
33 ± 12 % |
35,7 ± 3,4 |
Примечание. Различия СПЖ в группах 1 и 2, 1 и 3, 2 и 3 статистически достоверны.
Пероральное введение мышам преднизолона приводило к защите 67 % животных, тогда как в контроле выживало лишь 44 % (табл. 2, группы 3 и 1). Полученные результаты свидетельствуют о том, что на поздних сроках после заражения и при клинически выраженном КЭ применение противовоспалительных гормонов эффективнее, чем профилактика при помощи ППФ. Данный результат полностью согласуется с вышеописанной картиной «цитокинового шторма» в головном мозге мышей с визуальными признаками заболевания.
Профилактическое действие ППФ в сочетании с антителами к вирусу клещевого энцефалита
В следующей серии экспериментов животных заражали вирусом (в до 10LD50) и вводили внутримышечно: АТ, ППФ, АТ+ППФ (табл. 3) на –1-е, 0, 1-е, 3-и сутки относительно заражения ВКЭ. Наблюдение за животными проводили ежедневно в течение 21 суток. Результаты, представленные в табл. 3, показывают, что введение АТ к ВКЭ на ранних сроках (–1-е, 0, 1-е, 3-и сутки) относительно заражения вирусом приводит к защите животных в 100 % случаев, тогда как в контроле животные выживали лишь в 20 % (табл. 3., группы 3 и 1). Гораздо менее эффективно в.м. введение ППФ (табл. 3, группы 2 и 1). В то же время необходимо отметить, что сочетанное введение АТ и ППФ не приводило к утяжелению инфекционного процесса.
Таблица 3
Профилактическое действие ППФ в сочетании с антителами к вирусу (на –1-е, 0, 1-е, 3-и сутки относительно заражения ВКЭ)
|
Группы |
Кол-во мышей в группе |
Летальность |
СПЖ (сут.) |
|
1. ВКЭ |
20 |
80 ± 9 % |
9,8 ± 1,1 |
|
2. ВКЭ + ППФ |
15 |
87 ± 9 % |
10 ± 1 |
|
3. ВКЭ + АТ |
14 |
0 % |
н.о. |
|
4. ВКЭ + АТ + ППФ |
14 |
0 % |
н.о. |
Таблица 4
Профилактическое и лечебное действие ППФ в сочетании с антителами к вирусу. АТ и ППФ вводили в.м. по схемам: a – на 3 и 4 сутки после заражения; b – на 4, 5 и 6 сутки после заражения
|
Группы |
Летальность |
СПЖ (сут.) |
|
1. ВКЭa |
87±8,7 % |
8,6 ± 2,5 |
|
2. ВКЭ + АТa |
93±6,6 % |
8,1 ± 1,5 |
|
3. ВКЭ + ППФa |
80±10,3 % |
8,5 ± 1,3 |
|
4. ВКЭ +АТ +ППФa |
60±12,6 % |
12,7 ± 1,8 |
|
5. ВКЭb |
80±10,3 % |
10,8 ± 2,4 |
|
6. ВКЭ+АТb |
73±11,5 % |
14,1 ± 1,2 |
|
7. ВКЭ+АТ+ППФb |
47±12,9 % |
19,2 ± 1,5 |
Примечание. Количество мышей в группе n = 15. Различия СПЖ в группах 1 и 4, 2 и 4, 3 и 4, 5 и 6, 5 и 7, 6 и 7 статистически достоверны (p < 0,05).
Иная картина регистрировалась при введении АТ или АТ+ППФ на более поздних сроках: на 3-е, 4-е или на 4-е, 5-е, 6-е сутки относительно заражения ВКЭ (табл. 4). В данном случае антитела не оказывали защитного действия. Введение ППФ, напротив, защищало заражённых мышей в 20 % случаев, что в 1,5 раза выше контрольного показателя (табл. 4, группы 3 и 1). Одновременное введение АТ+ППФ существенно усиливало протективный эффект (табл. 4, группы 4 и 1; 3 и 4). Таким образом, применение иммуномодулятора в сочетании с АТ на более поздних сроках способствует защите от вирусной инфекции.
Обнаруженная нами ассоциация гиперэкспрессии провоспалительных цитокинов в головном мозге зараженных ВКЭ животных и неврологической симптоматики заболевания свидетельствует о том, что иммунное воспаление является одним из основных патогенетических факторов, приводящих к развитию подобного рода осложнений инфекционного процесса. Исходя из того, что наибольший эффект ППФ по снижению летальности при экспериментальной инфекции ВКЭ наблюдался при и.ц. способе введения вируса и препарата, можно сделать вывод, что ППФ обладает выраженным свойством снижать нейровирулентность ВКЭ. Механизм такого действия остается неясным, что, вероятно, связано с полифункциональностью препарата. Среди гипотез можно выделить следующие: активация врожденного иммунитета и раннее подавление репликации вируса, предотвращение летальной воспалительной реакции и «цитокинового шторма» в головном мозге [3, 5, 6], влияние на метаболизм липидов и, как следствие, изменение реологических и зарядовых свойств клеточных мембран, препятствующее процессу слияния вируса с клеткой. Не исключено, что ППФ может непосредственно связываться с ВКЭ или с отдельными вирусными белками. Периферическое заражение и введение препарата показало, что при данном способе введения ППФ проявлял незначительное защитное действие. При этом нами было отмечено снижение частоты появления мышей с визуальными признаками КЭ и увеличение СПЖ (при пероральном применении ППФ). Также нами было показано, что ППФ обладает способностью потенцировать защитное действие АТ против ВКЭ. По-видимому, это объясняется способностью препарата замедлять развитие неврологической симптоматики и препятствовать развитию «цитокинового шторма» в головном мозге.
Использование в наших экспериментах преднизолона выявило его способность защищать животных от ВКЭ. Этот факт является показателем необходимости применения противовоспалительных препаратов при КЭ. Эксперименты с АТ к ВКЭ явно свидетельствуют о том, что защитные свойства АТ проявляются лишь при условии их применения на ранних сроках относительно инфицирования. В случае их использования на поздних сроках, защита от ВКЭ не регистрировалась. Таким образом, по крайней мере в условиях эксперимента использование АТ против КЭ в качестве лечебных препаратов недостаточно эффективно. Использование инъекций ППФ за 24-48 часов до проявления визуальных признаков КЭ также малоэффективно. По-видимому, это связано с тем обстоятельством, что иммунный ответ при КЭ в данный период времени уже сформировался и применение иммуномодулятора неэффективно. В то же время введение ППФ с АТ даже в этот период достаточно оправданно, так как ППФ полифункционален и обладает свойством коррекции иммунопатологических реакций, вызываемых АТ.
Заключение
Неврологическая симптоматика экспериментальной ВКЭ-инфекции ассоциирована с целым каскадом увеличения экспрессии генов иммунорегуляторных молекул, что является проявлением активации клеток микроглии – резидентных макрофагов головного мозга – и привлечения в очаг воспаления дендритных клеток, нейтрофилов и T-лимфоцитов. Данное осложнение инфекционного процесса также характеризуется выраженным увеличением количества вирусной РНК в головном мозге зараженных животных по сравнению с особями, у которых не отмечалось видимых признаков заболевания в течение всего периода наблюдения. Несомненно, чрезмерная активация иммунных клеток, продуцирующих провоспалительные цитокины, в головном мозге является непосредственной причиной неврологических осложнений инфекционного процесса. Эффективная элиминация вируса из организма при помощи иммуноглобулина против ВКЭ достигается только при введении препарата антител до или на максимально ранних сроках после инфицирования. Учитывая, что препараты антител обладают определенным иммуностимулирующим свойством, введение их на поздних сроках после инфицирования в некоторых случаях может привести к утяжелению инфекционного процесса (в условиях эксперимента на лабораторных животных). Для предотвращения неврологических осложнений инфекционного процесса терапевтические мероприятия должны быть направленны на максимально раннюю элиминацию вируса из организма и на предотвращение развития чрезмерной воспалительной реакции и цитокинового шторма в головном мозге. При этом представляется оправданным применение противовирусных антител совместно с проведением иммуномодулирующей терапии.
Рецензенты:
Варгин В.В., д.м.н., ведущий научный сотрудник, ФГБУ «Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова», Московская область, Ленинский район, поселок сельского типа Институт полиомиелита;
Ляпустин В.Н., д.б.н., заведующий отделением криогенного хранения клеточных культур и коллекционных штаммов вирусов, ФГБУ «Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова», Московская область, Ленинский район, поселок сельского типа Институт полиомиелита.
Работа поступила в редакцию 08.04.2013.
Библиографическая ссылка
Саличев А.В., Гришина К.Г., Ворович М.Ф., Кожевникова Т.Н., Санин А.В., Пронин А.В., Наровлянский А.Н., Ожерелков С.В. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ИММУНОПАТОГЕННОГО ДЕЙСТВИЯ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА В ГОЛОВНОМ МОЗГЕ МЫШЕЙ С ВИЗУАЛЬНЫМИ ПРИЗНАКАМИ ЗАБОЛЕВАНИЯ // Фундаментальные исследования. 2013. № 6-2. С. 380-386;URL: https://fundamental-research.ru/ru/article/view?id=31518 (дата обращения: 29.01.2026).



