В серии поведенческих экспериментов на животных ранее было установлено, что антитела к белку S-100 в сверхмалой концентрации (АS-100 C6), приготовленные по гомеопатической технологии, обладают анксиолитической и антидепрессивной активностью [1, 4], причем в реализации анксиолитических эффектов принимает участие ГАМК-эргическая система [2].
В исследованиях, проведенных группой шведских исследователей, было показано, что как белок S-100, так и антитела к нему способны увеличивать проницаемость нейрональной мембраны для ГАМК и ионов хлора, вероятно, за счет взаимодействия с ГАМКА рецептором [6]. Антитела к белку S-100 блокировали развитие длительной посттетанической потенциации (ДПТП) в срезах гиппокампа [8]. Нами было установлено, что те же антитела в сверхмалых концентрациях, не оказывая непосредственного влияния на индукцию и поддержание ДПТП, препятствуют блокирующему действию больших доз [7]. Одним из возможных механизмов этого эффекта является регулирующее влияние сверхмалых концентраций антител на ГАМК-эргическую систему, играющую важную роль в поддержании нормальной электрической активности нейронов гиппокампа. В представленной работе мы изучали влияние АS-100 на формирование ДПТП в срезах гиппокампа крыс с использованием антагонистов ГАМКА рецептора и сопряженного с ним хлорного канала – бикукулина и пикротоксина.
Материалы и методы исследования
В работе использовали крыс-самцов Вистар, весом 180–260 г (n = 35), полученных из вивария лаборатории экспериментальных животных Института цитологии и генетики СО РАН (г. Новосибирск). Крыс содержали по 2 в клетке при световом режиме 12 часов день/ночь на стандартном комбинированном рационе питания и свободном доступе к воде.
Срезы гиппокампа толщиной 400 мкм помещали в термостатированную камеру (35–37 °С) с проточной средой Ямомото (в мМ: NaCl, 124; KCL, 4,9; KH2PO4, 1,2; MgSO4, 1,3; CaCl2, 2,5; NaHCO3, 25,6; D-глюкоза, 10; pH 7,5), аэрируемой карбогеном (95 % О2 – 5 % CО2). Спустя 40 минут начинали регистрацию вызванных потенциалов, размещая электроды следующим образом: стимулирующий биполярный вольфрамовый электрод помещали в область мшистых волокон, регистрирующий стеклянный электрод (сопротивление – 3–5 МW, заполнен 2,5 М NaCl) – в область СА3 в зоне начальных сегментов апикальных дендритов. Тестирование проводили при помощи одиночных прямоугольных стимулов длительностью 200 mсек, наносимых не реже, чем через 5 мин. Амплитуда тестирующих стимулов находилась обычно в диапазоне 10–30 В. Вызванные потенциалы регистрировали при помощи 12-разрядного АЦП (Digidata, Axon Instruments, Inc.) и обрабатывали на ЭВМ, используя пакет программ pClamp-6 (Axon Instruments, Inc.) и Microcal Origin. Для выработки ДПТП амплитуду тестирующего стимула подбирали таким образом, чтобы величина ответа составляла не более 50 % от максимальной. Тетанизацию проводили тремя последовательными пачками стимулов частотой 200 Гц, длительность каждой пачки импульсов 1 с, интервал между пачками 2 с. Через 10 мин процедуру тетанизации повторяли. Регистрацию вызванных потенциалов вели не менее 60 мин после первой тетанизации, что позволяло сделать заключение о формировании или отсутствии ДПТП.
При исследовании эффектов сверхмалых концентраций антител и антагонистов ГАМКА рецептора на 1–2 контрольных срезах гиппокампа от каждого животного проводили тетанизацию и дальнейшие эксперименты со срезами из этого набора продолжали только в том случае, если наблюдали формирование ДПТП.
В работе использовали антагонист ГАМК-А рецептора бикукулин и антагонист сопряженного с данным рецептором хлорного канала пикротоксин (Sigma, США) в конечной концентрации 10 mМ. После установки электродов и регистрации ответов на тестирующие стимулы в камеру вносили исследуемые препараты и срезы инкубировали с ними в течение 20 мин. Затем, после регистрации ответа на тест, проводили тетанизацию, как описано выше. Раствор потенцированных антител к белку S-100 (АS-100 C6) был приготовлен персоналом начно-производственной фирмы «Материа Медика Холдинг» в соответствии со стандартной процедурой.
При изучении эффектов антител в сверхмалых концентрациях (С6 – физиологическая концентрация х10-12) использовали два протокола экспериментов, внося антитела за 20 минут до или после преинкубации с антагонистом. В последнем случае совместная инкубация срезов в присутствии АS-100 С6 и антагониста до тетанизации также составляла 20 мин.
В ходе экспериментов измерялась латентность и амплитуда суммарного ВПСП мшистых волокон. Относительное изменение амплитуды суммарного ВПСП после тетанизации вычисляли по формуле ((Аn – A0)/A0)∙100 %, где A0 − амплитуда ответа на тестовый стимул до, An − после тетанизации.
При статистической обработке результатов получали среднее значение измеряемой величины и стандартную ошибку среднего (M ± SEM). Оценку достоверности различий средних значений параметров проводили с использованием t-критерия Стьюдента, используя пакет программ OriginPro 8.1 (OriginLab). Различия между группа считали достоверными при р ≤ 0,05.
Результаты исследования и их обсуждение
Пикротоксин в конечной концентрации 10 mм не вызывал изменения амплитуды и латентности суммарных ВПСП мшистых волокон в ответ на тестирующие стимулы в течение 20 мин преинкубации срезов. Процедура тетанизации мшистых волокон приводила к формированию полноценной ДПТП, амплитуда которой через 30 и 60 мин после тетанизации превышала регистрируемую в срезах, находившихся в стандартной среде (рис. 1).
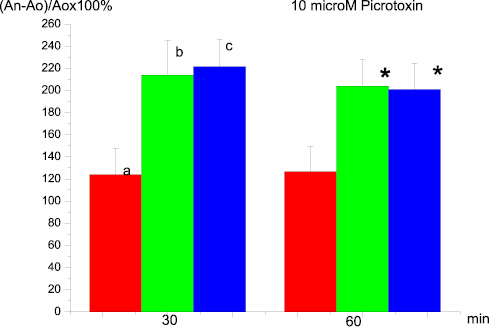
Рис. 1. Влияние преинкубации срезов гиппокампа с 10µМ пикротоксина на ДПТП: ось ординат – изменение амплитуды суммарного ВПСП по сравнению с исходной (до тетанизации). Ось абсцисс – время, 30 мин. и 60 мин. после высокочастотной стимуляции; а – контроль; в – 20 мин преинкубация; с – 100 мин. преинкубация; * p ≤ 0,05
Увеличение времени инкубации с пикротоксином до 100 мин имело такой же эффект. Таким образом, инактивация сопряженного с ГАМКА рецептором хлорного канала приводила к фасилитации ДПТП мшистых волокон в срезах гиппокампа.
Если препарат АS-100 C6 вносили в экспериментальную камеру после 20-минутной преинкубации срезов с пикротоксином и еще через 20 минут проводили тетанизацию мшистых волокон, эффекты, вызванные антагонистом, практически не изменялись (рис. 2). При увеличении времени инкубации срезов в присутствии сверхмалых концентраций антител амплитуда сформированной ДПТП оказывалась выше контрольных значений, однако различия были недостоверны (р = 0,13).
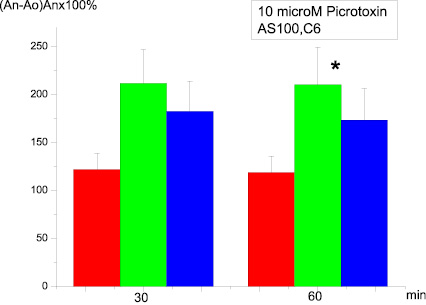
Рис. 2. Влияние на ДПТП преинкубации срезов гиппокампа с 10 µМ пикротоксином в течение 20 мин и последующей преинкубации с AS100 C6 в течение 20 мин:ось ординат – изменение амплитуды суммарного ВПСП по сравнению с исходной (до тетанизации). Ось абсцисс – время, 30 и 60 мин после тетанизации;а – контроль; в – 20 мин преинкубация; с – 100 мин преинкубация в среде Ямамото, содержащей 10 µМ пикротоксина и AS100 C6; * p ≤ 0,05
В случае же если 20-минутная инкубация срезов с АS-100 С6 предшествовала внесению пикротоксина и последующей совместной инкубации, величина амплитуды ДПТП мшистых волокон не отличалась от контрольной, то есть мы не наблюдали характерного для антагониста действия (рис. 3).
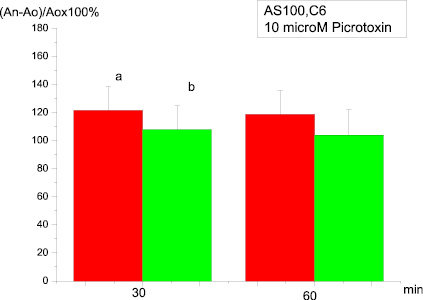
Рис. 3. Влияние на ДПТП преинкубации срезов гиппокампа с AS100 C6 в течение 20 мин и последующей преинкубации с 10 µМ пикротоксина в течение 20 мин:ось ординат – изменение амплитуды суммарного ВПСП по сравнению с исходной (до тетанизации). Ось абсцисс – время, 30 и 60 мин после тетанизации:а – контроль; в – опыт
Инкубация срезов гиппокампа с бикукулином также не влияла на величину амплитуды и латентности суммарных ВПСП мшистых волокон в ответ на тестирующие стимулы, а тетанизация приводила к выраженной фасилитации ДПТП по сравнению с контрольными срезами (рис. 4).
Нужно отметить, что в большем числе случаев на регистрируемых кривых суммарных ВПСП было отмечено появление изменений, характерных для эпилептиформной активности. Эффекты АS-100 С6 в данном случае были подобны таковым для срезов, инкубируемых в присутствии пикротоксина. В частности, фасилитация ДПТП мшистых волокон, вызываемая бикукулином, полностью «отменялась» при использовании сверхмалых концентраций антител (рис. 5).
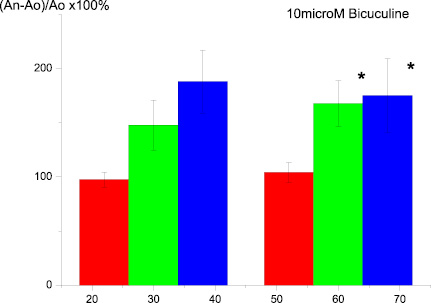
Рис. 4 . Влияние на ДПТП преинкубации срезов гиппокампа с 10 µМ бикукулина в течение 20 мин:ось ординат – изменение амплитуды суммарного ВПСП по сравнению с исходной (до тетанизации). Ось абсцисс – время, 30 и 60 мин после тетанизации;а – контроль; в – 20 мин с бикукулином; c – 100 мин в растворе содержащем бикукулин; * p ≤ 0,05
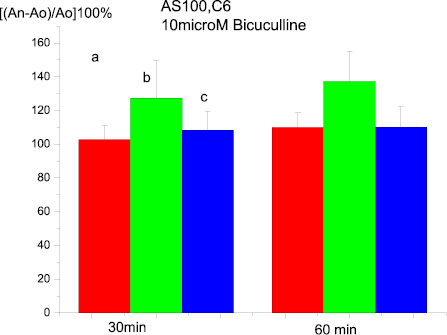
Рис. 5. Влияние на ДПТП преинкубации срезов гиппокампа с AS100 C6 в течение 20 мин и последующей преинкубации с 10 µМ бикукулина в течение 20 мин:ось ординат – изменение амплитуды суммарного ВПСП по сравнению с исходной(до тетанизации). Ось абсцисс – время, 30 и 60 мин. после тетанизации:а – контроль; в – 20 мин. С AS100 C6 + 20 мин с бикукулином;c – 100 мин в растворе содержащем AS100 C6 и бикукулин
ГАМК-эргическая система играет важную роль в поддержании нормальной электрической активности нейронов гиппокампа и, прежде всего, в предупреждении возникновения судорожной активности. Тормозные ГАМК-содержащие волокна поступают в гиппокамп в составе перфорантного пути от крупных нейронов энторинальной коры, и большинство полиморфных интернейронов гиппокампа (корзинчатые, моховидные, клетки канделябры) также содержат ГАМК [3].
Основное количество работ по изучению ГАМК-эргических сигналов в срезах гиппокампа посвящено эпилептиформной активности и участию интернейронов в функционировании внутренних сетей гиппокампа, число же работ по исследованию роли ГАМК в ДПТП относительно невелико и выполнены они в основном на системе синаптических связей «коллатерали Шаффера – пирамидные нейроны области СА1» [9]. Показано, что антагонисты ГАМКА рецептора бикукулин и пикротоксин усиливают ДПТП за счет отмены гиперполяризующего влияния ГАМК на пирамиды СА1 и активации NMDA-рецептора глутамата [5]. Синапсы мшистых волокон содержат небольшие количества ГАМК [10], участвующей, вероятно, в ауторегуляции вызываемого глутаматом возбуждения.
Инкубация с бикукулином или пикротоксином приводила к усилению ДПТП мшистых волокон по сравнению с контрольными срезами, содержащимися в стандартной среде, что выражалось в существенно большем увеличении амплитуды суммарного ВПСП через 60 минут после тетанизации. Хотя в наших экспериментах мы намеренно использовали сравнительно низкие концентрации антагонистов ГАМКА-рецептора, в ряде случаев на регистрационных кривых было отмечено появление эпилептиформной активности.
Антитела к белку S-100 в сверхмалых концентрациях практически «отменяли» вызванные применением антагонистов эффекты, что позволяет предположить модулирующий эффект препарата на активность ГАМК-А-рецептора. Поскольку действие АS-100 С6 выявлено только в случае пре-инкубации до внесения антагониста или пролонгированной совместной инкубации, очевидно, временной интервал модуляции активности рецептора составляет несколько десятков минут (в нашем случае – 20 мин).
Тот же временной интервал был характерен для эффекта «отмены» АS-100 С6 блокирования индукции ДПТП антителами к белку S-100 в высоких концентрациях, то есть эффект мог быть обусловлен частично или полностью модуляцией состояния ГАМКА рецептора сверхмалыми дозами антител. В то же время вопрос о механизмах модулирующего влияния сверхмалых концентраций антител к белку S-100 на ГАМКА рецептор, а именно является ли эта модуляция прямой или опосредованной, остается открытым.
Заключение
Полученные результаты свидетельствуют о способности сверхмалых концентраций антител к белку S-100 нормализовать модифицированную антагонистами ГАМКА рецептора синаптическую пластичность мшистых волокон гиппокампа. Это, в свою очередь, может являться дополнительным подтверждением того, что анксиолитическая и антидепрессивная активность препарата антител связана с его действием на ГАМК-эргическую систему мозга.
Рецензенты:
Ратушняк А.С., д.б.н., зав. лабораторией «Биомедицинская информатика», ФГБУН «Конструкторско-технологический институт вычислительной техники Сибирского отделения Российской академии наук», г. Новосибирск;
Запара Т.А., д.б.н., ведущий научный сотрудник, ФГБУН «Конструкторско-технологический институт вычислительной техники Сибирского отделения Российской академии наук», г. Новосибирск.
Работа поступила в редакцию 11.04.2013.
Библиографическая ссылка
Береговой Н.А., Сорокина Н.С., Старостина М.В., Штарк М.Б., Эпштейн О.И. ВЛИЯНИЕ СВЕРХМАЛЫХ КОНЦЕНТРАЦИЙ АНТИТЕЛ К БЕЛКУ S-100 НА МОДУЛЯЦИЮ СИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ ГИППОКАМПА АНТАГОНИСТАМИ ГАМКА РЕЦЕПТОРА // Фундаментальные исследования. 2013. № 6-2. С. 341-345;URL: https://fundamental-research.ru/ru/article/view?id=31510 (дата обращения: 14.02.2026).



