С тех пор, как стали доступны препараты , обогащенные тяжелыми изотопами углерода 13С и 14С, исследователей привлекало изучение реакции изотопного обмена в молекулах СО:
12С 18О + 13С 16О ↔ 12С 16О + 13С 18О (1)
на различных катализаторах [4–11]. Это связано прежде всего с тем, что данная реакция позволяет получить дополнительные сведения о взаимодействии адсорбированной СО с поверхностью катализаторов и механизме каталитических реакций. Родиевые катализаторы находят широкое применение во многих гетерогенно-каталитических реакциях с участием СО: синтез Фишера-Тропша, реакция окисления СО.
В настоящей работе были исследованы промышленный катализатор КНТР-2 (0,1 %Rh–0,4 %Pt/Al2O3), (НИФХИ им. Карпова Л.Я), приготовленные методом пропитки катализаторы, содержащие 5 и 10 масс % родия и чистый носитель γAl2O3.
Материалы и методы исследования
Кинетику гомомолекулярного изотопного обмена (ГМИО) СО изучали в стеклянной вакуумной установке статическим методом с принудительной циркуляцией газа в интервале температур –78...+400 °С при давлении СО 20 мм рт. ст. Для проведения реакции (1) использовали неравновесную смесь молекул СО с содержанием изотопов 18О и 13С 15–20 % каждого. За меру активности катализатора принимали скорость обмена, рассчитываемую по уравнению первого порядка относительно глубины обмена.
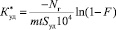 [молекул СО/см2 с], (2)
[молекул СО/см2 с], (2)
где Nг – количество СО в реакционном контуре, молекулы; S – удельная поверхность катализатора, м2/г; m – навеска катализатора, г; t – время, с; 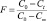 – степень обмена, где с0, сt и с∞ – соответственно начальная , текущая и равновесная концентрации одной из изотопных разновидностей молекул СО.
– степень обмена, где с0, сt и с∞ – соответственно начальная , текущая и равновесная концентрации одной из изотопных разновидностей молекул СО.
За ходом обмена следили по изменению отношения концентраций 12С18О и 13С18О в периодически отбираемых пробах газа, которые анализировали на масс-спектрометре МИ-1309. (пики I30 и I31). Для каждой пробы проводили по 4 замера. Относительная ошибка в определении концентрации составляла 1 % от измеряемой величины.
Образец, помещенный в реактор, подвергали стандартной обработке, которая включала в себя прогрев при 400 °С в течение 3–4 часов с откачкой диффузионным насосом до остаточного давления 10–6 мм рт. ст., после этого восстанавливали в водороде при 250 °С и p = 20 мм рт. ст в условиях циркуляции газа до прекращения изменения давления, после чего водород откачивали в течение 1 часа, при t = 400 °С до p = 10–6 мм рт. ст., катализатор охлаждали до заданной температуры и выдерживали при этой температуре 30 минут. Такой обработке образец подвергался перед измерением при каждой температуре, во избежание искажения результатов вследствие влияния СО на свойства поверхности. Таким образом, каждое измерение проводилось на «свежеоттренированной» поверхности.
Удельную поверхность образцов определяли методом БЭТ по низкотемпературной адсорбции криптона. Число атомов металла на поверхности, величину активной поверхности, ее долю от общей поверхности, дисперсность металла, размер его кристаллов определяли по адсорбции водорода при –196 °С. Характеристики катализаторов приведены в таблице.
Характеристики исследованных катализаторов.
|
№ п/п |
Катализатор |
|
|
|
|
Dм |
l, A |
|
1 |
0.1 %Rh-0/4 %Pt/γAl2O3 |
140 |
1,1 |
0,8 |
1,5 1019 |
0,5 |
11 |
|
2 |
5 %Rh/γAl2O3 |
140 |
2,4 |
1,7 |
3,2 1019 |
0,1 |
79 |
|
3 |
10 %Rh-/γAl2O3 |
140 |
5,8 |
4 |
7,7 1019 |
0,1 |
70 |
Примечания: 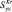 r – полная удельной поверхности катализаторов, рассчитанная по адсорбции криптона;
r – полная удельной поверхности катализаторов, рассчитанная по адсорбции криптона;  – значения удельной поверхности металла;
– значения удельной поверхности металла; 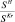 , % – доля поверхности металла от общей поверхности катализатора;
, % – доля поверхности металла от общей поверхности катализатора; 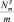 – число атомов металла, находящихся на поверхности, отнесенное к массе образца; Dм – дисперсность, l – размер кристаллов металла в ангстремах.
– число атомов металла, находящихся на поверхности, отнесенное к массе образца; Dм – дисперсность, l – размер кристаллов металла в ангстремах.
Результаты исследования и их обсуждение
1. Зависимость Куд оттренированных катализаторов от температуры
На рис. 1, представлена зависимость К-уд от температуры в координатах уравнения Аррениуса для исследованных катализаторов.
Установлены следующие особенности гомообмена на данных катализаторах:
1. На 0,1 %Rh–0,4 %Pt/γAl2O3 и на чистом носителе наблюдаются 2 области протекания обмена—низкотемпературная и высокотемпературная. В высокотемпературной области на КНТР-2 наблюдался гетерообмен С18О с кислородом поверхности. Рассчитанные скорости гетерогенного обмена при 323 °С в 90 раз ниже, чем скорости гомомолекулярного обмена СО.
(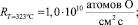
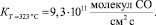 )
)
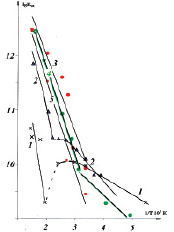
Рис. 1. Зависимость удельной каталитической активности родиевых катализаторов от температуры: 1 – γ-Al2O3; 2 – КНТР-2; 3 – 10 %Rh/ γ-Al2O3; 4 – 5 %Rh/ γ-Al2O3, 5–10 %Rh/ γ-Al2O3 при проведении опытов от 400 до 25 °С
2. На 5 %Rh/γAl2O3 низкотемпературная область выражена гораздо слабее, чем на КНТР-2,на 10 %Rh/γAl2O3 низкотемпературная область отсутствует, при +220 °С происходит заметное зауглероживание поверхности за счет протекания на ней реакции диспропорционирования СО. (В пробах обнаруживался СО2 при Т > +70 °С, причем его количество возрастало с температурой) На высокопроцентных родиевых катализаторах гетерообмена С18О с кислородом поверхности не наблюдалось.
2. Адсорбция СО
Исследована адсорбция СО на 0,1 %Rh–0,4 %Pt/γAl2O3 при +25, +130, +160, +190, +206, +250 и +310 °С в интервале давлений 0,5–5 мм рт. ст. Адсорбция протекала быстро. Обработка изотерм по уравнению Ленгмюра показала, что в данном интервале давлений и степеней заполнения (θ = 0,3–0,5) адсорбция является обратимой. Рассчитаны константы адсорбционного равновесия b, и, по их зависимости от температуры, теплоты адсорбции СО. Они оказались очень низкими: в интервале +25...+190 °С ΔHадс = –6 кДж/моль, в интервале +190...+310 °С ΔHадс = –14 кДж/моль. Сравнение изотерм адсорбции СО на γAl2O3 и КНТР2 при +25 °С показало их резкое различие: атомы металла блокируют электронно-акцепторные центры γAl2O3.
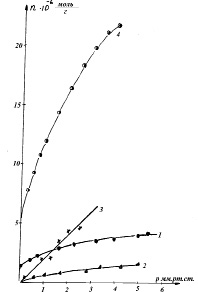
Рис. 2. Изотермы адсорбции СО на КНТР-2 (1,2), γ-Al2O3(3), 10 %Rh/ γ-Al2O3(4)
Изобара адсорбции демонстрирует уменьшение адсорбируемого количества СО с повышением температуры. Сопоставление результатов адсорбции H2 и CО позволило рассчитать число молекул СО, приходящихся на 1 атом металла: при +160..+310 °С это значение в среднем равно 1, при 130 °С – 1,3, при +25 °С – 1,65. Эти значения использованы при обсуждении механизма обмена на данном катализаторе.
Исследована адсорбция СО на 10 %Rh/γAl2O3 при +25, +200 и + 350 °С. Адсорбция протекала довольно медленно с энергией активации 19 кДж\моль, увеличивалась с ростом температуры. На 1 атом металла приходилось, в среднем, по 3 молекулы СО.
На рис. 3 представлена для всех трех Rh-катализаторов зависимость от температуры в высокотемпературной области значений Куд, полученных отнесением скорости обмена на единицу поверхности родия, определенной по адсорбции водорода. Для КНТР-2 скорость обмена отнесена не просто к количеству металла, измеренному по адсорбции водорода, а именно к количеству родия, в предположении, что 0,4 %Pt/γAl2O3 не активна.
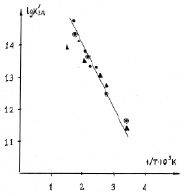
Рис. 3. Зависимость Куд от Т исследованных родиевых катализаторов, отнесенная к поверхности металла: ◙ – 5 %Rh/γAl2O3; ▲ – 10 %Rh/γAl2O3; ● – КНТР-2
В литературе имеются ссылки [8] на то, что платиновая фольга была не активна в отношении обмена при +300–1000 К, однако Винтер [10] наблюдал обмен на Pt/SiO2 при комнатной температуре. В работе [5] проведено подробное исследование изотопного обмена СО на образцах электронного аналога платины–металлического палладия в точно таких же условиях, в которых проводились исследования в данной работе. Отмечена его крайне низкая активность, так, при 200 °С Куд = 8,4∙108 молекул/см2с, при 375 °С Куд = 2,86∙1011 молекул/см2с. В тех же условиях на КНТР-2 были получены следующие значения Куд: при 200 °С Куд = 6,3∙1010 молекул/см2с, при 375 °С Куд = 2,88∙1012 молекул/см2с, т.е. при 200 °С Куд КНТР-2 превышает Куд Pd в 75 раз, при 375 °С – в 10 раз.
Из рис. 3 видно, что все точки легли на одну прямую. Это подтверждает правило Борескова и доказывает, что обмен в этой области катализируется именно металлическим родием и на всех катализаторах протекает по одному и тому же механизму с энергией активации Е = 35 ± 0,4 кДж/моль, несмотря на различия в адсорбции СО и протекание параллельных процессов (диспропорционирования СО).
Вывод об идентичности механизма обмена в высокотемпературной области на всех трех катализаторах позволяет обсудить характер этого механизма, используя результаты, полученные на том или ином катализаторе. Итак, можно сделать выводы, что:
1) гомообмен протекает не за счет гетерообмена с кислородом, поскольку на высокопроцентных катализаторах гетерообмена не наблюдалось;
2) механизм не является диссоциативным, поскольку на низкопроцентном КНТР-2 диссоциации не наблюдались;
3) адсорбция не является лимитирующей стадией высокотемпературного обмена, поскольку на КНТР-2 протекает быстро, а на 10 %Rh/Al2O3 энергия активации адсорбции намного ниже, чем энергия активации обмена.
Механизм является ассоциативным, обмен протекает между двумя линейно хемосорбированными молекулами СО , а элементарный акт взаимодействия между ними и является лимитирующей стадией, т.е. имеет место механизм Ленгмюра–Хиншельвуда.
Влияние носителя проявляется в том, что обмен может активно проходить по низкотемпературному механизму, который осуществляется за счет адсорбции на частично окисленных атомах родия.
Результаты данного исследования были доложены на Российских и международных конференциях [1–3].
Автор выражает благодарность за помощь в выполнении экспериментальной части работы дипломницам Мухиной Е.М., Сафарян М.С., а также профессору Жаворонковой К.Н. за обсуждение результатов экспериментов.
Рецензенты:
Альтзельцер В.С., д.х.н., профессор, ОАО «Научно исследовательский институт резиновых и латексных изделий», г. Москва;
Гладской В.М., д.т.н, профессор Института системной автоматизации и инноватики МГУТУ им. К.Г. Разумовского, г. Москва.
Работа поступила в редакцию 04.04.2012
Библиографическая ссылка
Бреева Н.В. ИЗОТОПНЫЙ ОБМЕН В МОЛЕКУЛАХ СО НА НАНЕСЕННЫХ РОДИЕВЫХ КАТАЛИЗАТОРАХ // Фундаментальные исследования. 2013. № 6-1. С. 84-87;URL: https://fundamental-research.ru/ru/article/view?id=31419 (дата обращения: 12.03.2026).




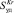 ,м2/г
,м2/г
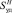 , м2/г
, м2/г
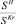 , %
, %
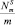 , ат./г
, ат./г