Традиционно в экспериментальной и прикладной репродукции лабораторных и сельскохозяйственных животных используют стимуляцию созревания ооцитов с применением гонадотропных гормонов (суперовуляция). Целью такой стимуляции является получение большего количества зрелых ооцитов для оплодотворения, дальнейшей трансплантации или криоконсервирования эмбрионов. Известно, что гормональная стимуляция влияет на характер овуляции и качество полученных ооцитов [1, 8–10, 12], что, в свою очередь, отражается на качестве эмбрионов и их способности к дальнейшему развитию. Альтернативным подходом к повышению выхода созревших in vitro ооцитов животных являются методы стимуляции их развития действием физических факторов [3, 5]. Существующие данные о влиянии стимуляции на морфологическую и функциональную целостность ооцитов животных требуют дополнительных методов оценки их качества. Целью исследования было изучение влияния импульсной и гормональной стимуляции созревания на качество ооцитов мыши, оцененное по их морфологическим признакам, электропроводности и уровню оплодотворения in vitro.
Материалы и методы исследований
Эксперименты с животными выполняли согласно требованиям «Европейской конвенции защиты позвоночных животных, используемых с экспериментальной и другой научной целью». Мыши были распределены на три группы. Первую группу (контроль) составили самки (n = 8) с установленной по вагинальным мазкам стадией эструса, которая соответствует спонтанной овуляции. У самок второй группы (n = 13), не определяя стадии полового цикла, вызывали суперовуляцию путем введения гонадотропных гормонов: 5 МЕ ГСЖК («Folligon», Голландия) и через 46–48 ч. 5 МЕ хорионического гонадотропина человека (чХГ, «Прегнил», «Органон», Голландия). Из антральных фолликулов самок третьей группы (n = 6) выделяли ооцит-кумулюсные комплексы (ОКК), которые импульсно стимулировали и осуществляли культивирование для созревания ооцитов в условиях in vitro [5]. Электропроводность зрелых ооцитов трех экспериментальных групп определяли в изотоническом для ооцитов 0,3 М растворе сахарозы, который является непроводящей средой и при его использовании может быть определена собственная электропроводность ооцитов [6]. Оплодотворение созревших ооцитов проводили по общепринятой методике [2, 4].
Результаты исследований и их обсуждение
Уровень выхода зрелых ооцитов со сформированным первым полярным тельцем в группе гормонально стимулированных ооцитов был достоверно ниже, чем при спонтанной овуляции, и достоверно не отличался для импульсно стимулированных ооцитов (табл. 1). В отличие от стимулированных ооцитов в группе спонтанно овулировавших ооцитов отсутствовали ооциты с морфологическими признаками дегенерации. Среди ооцитов, подвергавшихся гормональной стимуляции, преимущественным видом дегенерации была фрагментация и отсутствие кумулюса на время выделения ооцитов из яйцеводов, а среди импульсно стимулированных ооцитов к этой категории было отнесены клетки, имевшие грануляцию цитоплазмы.
Для выявления скрытых нарушений у морфологически нормальных ооцитов использовали их удельную электропроводность, которую измеряли при помощи метода импульсной кондуктометрии [6]. Во всех трех группах удельная электропроводность ооцитов возрастала с увеличением величины напряженности приложенного электрического поля. Для спонтанно созревших ооцитов (n = 45) электропроводность отдельных клеток характеризовалась близкими значениями (рис. 1). Необратимый электрический пробой мембраны ооцитов этой группы не наблюдался, что свидетельствовало о высокой стойкости к действию электрического импульса ооцитов, полученных в естественном половом цикле.
Таблица 1
Влияние гормональной и импульсной стимуляции на морфологическое состояние ооцитов мыши
|
Группа |
Количество животных, гол. |
Количество ооцитов |
||||||
|
Общее, n |
с полярным тельцем |
без полярного тельца |
с дегенерацией |
|||||
|
n |
% |
n |
% |
n |
% |
|||
|
I |
8 |
34 |
27 |
79,4 ± 6,9a |
7 |
20,6 ± 6,9d |
0 |
0 |
|
II |
13 |
138 |
76 |
55,1 ± 4,2b |
56 |
40,6 ± 4,2e |
6 |
4,3 ± 1,7 |
|
III |
6 |
36 |
26 |
72,2 ± 7,5c |
8 |
22,2 ± 6,9f |
1 |
2,8 ± 2,7 |
Примечание. a:b – p < 0,01; b:c, d:e, e:f – p < 0,05.
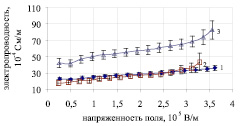
Рис. 1. Зависимость удельной электропроводности ооцитов мыши от напряженности электрического поля в 0,3 М растворе сахарозы. Ооциты получены в результате: 1 – спонтанной овуляции; 2 и 3 – стимуляции ГСЖК + чХГ (суперовуляция)
Среди морфологически нормальных, зрелых ооцитов, полученных в результате индукции суперовуляции, выявлены две группы клеток, существенно отличавшихся по электропроводности (рис. 1). Ооциты одной группы характеризовались более низкими значениями электропроводности и большей стойкостью к электрическому пробою, причем в общем пуле зрелых ооцитов (n = 33) количество таких клеток составило 57,6 %. Вторая группа клеток была менее численной (соответственно 42,4 %), и ооциты этой группы характеризовались более высокими значениями электропроводности и были менее стойкими к электрическому пробою. Электропроводность ооцитов с меньшими значениями была подобна электропроводности спонтанно овулировавших ооцитов. Значения электропроводности других ооцитов этой экспериментальной группы были более высокими, и при увеличении напряженности поля до 3,5 кВ/см в отдельных случаях для них регистрировали необратимый электропробой мембраны с разрушением ооцита, вероятно, в результате коллоидно-осмотического лизиса.
В группе импульсно стимулированных перед созреванием in vitro ооцитов мыши (n = 13) не наблюдалось разделения на группы по электропроводности, хотя имел место больший разброс значений этого показателя по сравнению с группой спонтанно овулировавших ооцитов. Необратимый электропробой цитоплазматической мембраны в ооцитах этой группы зафиксирован для одной клетки (7,7 %). Это может указывать на большее подобие качества импульсно стимулированных ооцитов ооцитам, полученным в естественном половом цикле.
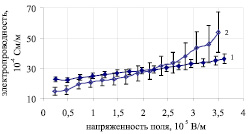
Рис. 2. Зависимость удельной электропроводности ооцитов мыши от напряженности электрического поля в 0,3 М растворе сахарозы. Ооциты получены в результате: 1 – спонтанной овуляции; 2 – созревания in vitro после импульсной стимуляции незрелых ОКК
Способность ооцитов к оплодотворению изучали как интегральный показатель их качества после гормональной и импульсной стимуляции созревания (табл. 2).
Таблица 2
Влияние гормональной и импульсной стимуляции на уровень оплодотворения in vitro ооцитов мыши
|
Группа |
Количество ооцитов |
||||||
|
общее, n |
оплодотворенных |
неоплодотворенных |
дегенерированных |
||||
|
n |
% |
n |
% |
n |
% |
||
|
I |
51 |
38 |
74,5 ± 6,1a |
10 |
19,6 ± 5,6 |
3 |
5,9 ± 3,3c |
|
II |
48 |
26 |
54,2 ± 7,2b |
12 |
25,0 ± 6,3 |
10 |
20,8 ± 5,9d |
|
III |
52 |
35 |
67,3 ± 6,5ab |
12 |
23,1 ± 5,8 |
5 |
9,6 ± 4,1cd |
Примечание. a:b, c:d – p < 0,05.
Ооциты, подвергавшиеся гормональной стимуляции, показали наиболее низкий уровень оплодотворения среди трех экспериментальных групп. В этой группе оплодотворяемость была на 20,3 % (p < 0,05) и на 13,1 % ниже аналогичного показателя в группах спонтанно созревших и импульсно стимулированных к созреванию ооцитов соответственно. Уровень оплодотворения импульсно стимулированных ооцитов был ниже уровня оплодотворения спонтанно созревших в естественном половом цикле ооцитов мыши, хотя достоверно не отличался от него. Это может свидетельствовать о наиболее выраженной неоднородности по качеству гормонально стимулированных к созреванию ооцитов.
Из полученных данных следует, что гормональная стимуляция созревания существенно влияет на морфологические признаки ооцитов, что согласуется с результатами других авторов [1, 8, 13]. Известно, что при гормональной суперовуляционной обработке общее количество созревающих ооцитов возрастает за счет увеличения митотической активности в меньших фолликулах и предотвращения атрезии больших фолликулов или возвращения некоторых атретических фолликулов в состояние созревания [1, 9, 11]. Это является вероятной причиной морфофункциональных различий ооцитов, полученных в результате индукции суперовуляции. Возможно, именно поэтому увеличивается также и количество дегенерированных ооцитов. Причиной морфофункциональных нарушений и снижения жизнеспособности полученных эмбрионов могут быть также нарушения биосинтеза, имеющие место при экзогенной гормональной стимуляции созревания [7, 11].
Заключение
Таким образом, зрелые, морфологически нормальные ооциты мыши, полученные в результате индукции суперовуляции с использованием последовательных инъекций животным ГСЖК и чХГ, разделяются на две группы по электропроводности в изотоническом 0,3 М растворе сахарозы. Импульсно стимулированные перед созреванием in vitro ооциты и созревшие спонтанно в естественном половом цикле имеют подобную по значениям электропроводность и разделения на группы по этому показателю не имеют. Уровень оплодотворения вне организма гормонально стимулированных ооцитов мыши является достоверно более низким по сравнению с уровнем оплодотворения спонтанно овулировавших ооцитов. Импульсно стимулированные ооциты мыши не отличаются по уровню оплодотворения in vitro от ооцитов, полученных в естественном половом цикле мышей.
Рецензенты:
Лиманский А.П., д.б.н., главный научный сотрудник ГУ «Институт микробиологии и иммунологии им. И.И. Мечникова НАМН Украины», г. Харьков;
Гордиенко Е.А., д.б.н., профессор, зам. директора Института проблем криобиологии и криомедицины НАН Украины, г. Харьков.
Работа поступила в редакцию 22.02.2013.
Библиографическая ссылка
Колесникова А.А., Шигимага В.А., Смольянинова Е.И. ВЛИЯНИЕ СТИМУЛЯЦИИ СОЗРЕВАНИЯ НА ЭЛЕКТРОПРОВОДНОСТЬ И ОПЛОДОТВОРЯЕМОСТЬ ООЦИТОВ МЫШИ // Фундаментальные исследования. 2013. № 4-4. С. 896-899;URL: https://fundamental-research.ru/ru/article/view?id=31293 (дата обращения: 05.03.2026).



