Органобентонит (бентон) представляет собой продукт взаимодействия естественных монтмориллонитовых глин (бентонитов) с олеофилизаторами, в частности, с четвертичными аммониевыми солями (ЧАС) [3].
До недавнего времени органобентониты (бентоны) производились только за рубежом по технологии, осуществляемой в восемь стадий: диспергирование (пептизация) исходного бентонита, фильтрация глинистой суспензии, приготовление разбавленного раствора четвертичной аммониевой соли, взаимодействие разбавленной бентонитовой суспензии с разбавленным раствором ЧАС при перемешивании и нагревании, декантация и фильтрация, промывка продукта, сушка его в распылительной сушилке. Большим недостатком этой технологии является ее многостадийность, ведение процессов в ничтожных концентрациях, высокая энергоемкость, малая производительность, большое количество отходов в виде сточных вод, пыли, органических продуктов, а также тепла в окружающую среду.
Первая отечественная технология получения органобентонита была разработана специалистами фирмы «Консит-А». Это способ получения органофильного бентонита путем подачи бентонитового глинопорошка в водный раствор четвертичной аммониевой соли и их перемешивания в течение 0,5–0,7 часа с последующей сушкой полученного продукта. Причем в смеситель вначале загружают бентонитовый глинопорошок, а затем постепенно добавляют четвертичную аммониевую соль. В этом случае кристаллическая структура слоистая, и в системе присутствуют нанопространства между элементарными пластинами алюмосиликата, куда могут быть внедрены молекулы полимера или активных компонентов (например, лекарств или бактерицидных препаратов) [4]. Это значительно расширяет спектр применения органобентонита.
Традиционно органобентониты широко используются при производстве лакокрасочных материалов, т.к. повышают адгезию красок, их термостойкость и атмосферостойкость, снижают их стекаемость, что, помимо экономии красок, повышает культуру производства. Следует отметить также положительное влияние органобентонита на величину показателя укрывистости лакокрасочных материалов, то есть на снижение расхода красок в расчете на 1 м2 окрашиваемой поверхности [6].
При введении органобентонита в рецептуры эмалей, масляных и прочих красок можно использовать в качестве полярного растворителя этилацетат, бутилацетат, ацетон, спирты, гликоли, целлозоль, пропиленкарбонат и даже воду. Можно также вводить органобентонит в систему в виде так называемой пасты-основы (то есть предварительно замачивая и затем перемешивая его, например, в уайт-спирите, толуоле или их смеси) [7].
Исследованиями ряда авторов доказана высокая сорбционная способность органобентонита [3, 4, 6].
Для очистки питьевой и сточной воды традиционно применяют адсорбцию. В основном в качестве сорбентов используют активные угли, синтетические сорбенты и некоторые отходы производства (золу, шлаки, опилки). Наиболее универсальными считаются активные угли, производство которых сложное и происходит в несколько стадий [5]. В этой связи перспективным является использование в процессе водоочистки в качестве сорбента органобентонита.
Цель работы – исследование свойств биологически активного органобентонита по отношению к микроорганизмам и обоснование перспектив его использования для водоочистки.
Материалы и методы исследования
Объектом исследования был органобентонит, предоставленный ООО НПП «Лисскон» (рисунок). Для оценки свойств органобентонита по отношению к микроорганизмам использовали взвесь стандартных тест-штаммов Escherichia coli 113–13 и Staphylococcus aureus 209 Р, полученных из музея бактериальных культур Государственного научного учреждения Саратовского научно-исследовательского ветеринарного института Россельхозакадемии.
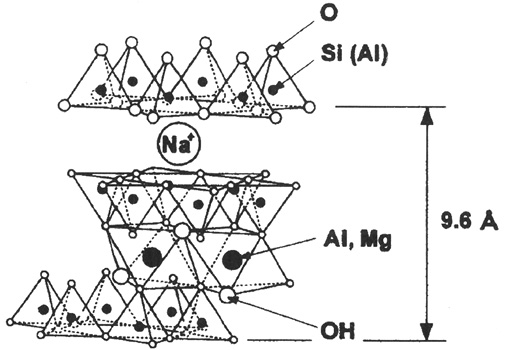
Структура элементарной ячейки Na-монтмориллонита
Взвесь микроорганизмов готовили в физиологическом растворе по стандарту мутности ГИСК имени Тарасевича № 10, титровали до концентрации 500 000 клеток в 1 мл и добавляли в раствор органобентонита, выдерживали в течение 30 минут при комнатной температуре. Затем делали высев 0,1 мл надосадочной жидкости на питательные среды.
Посевы инкубировали при температуре 37 °С в течение 48 часов. Учет роста микроорганизмов производили по количеству колониеобразующих единиц (КОЕ) согласно методическим указаниям по микробиологическим методам исследований [1]. В качестве контроля производили высев исходного разведения микроорганизмов, а также исследовали на микробную контаминацию нестерилизованные образцы органобентонита.
Все исследования проведены в 3–5 кратных повторностях. Статистическую обработку экспериментальных данных проводили по общепринятым методикам с применением пакета прикладных программ Microsoft Excel 2003 (for Windows XP).
Результаты исследования и их обсуждение
На первом этапе работы была проведена проверка контаминации исходного органобентонита различными группами микроорганизмов путем посева водного раствора образцов на питательные среды, оптимальные для различных эколого-физиологических групп микроорганизмов. Учет гетеротрофных бактерий проводили по наличию роста на чашках Петри с ГРМ-агаром, дрожжеподобных грибов – на агаре Сабуро, микромицетов – на среде Чапека. Оценивали морфологию выросших колоний и изучали морфологию клеток микроорганизмов общепринятыми методами микроскопирования: с окраской мазков синькой Леффлера, по Граму и по Цилю-Нильсону на споры. Полученные результаты представлены в табл. 1.
Таблица 1
Контаминация органобентонита микроорганизмами
|
Объект исследования |
Дрожжи |
Грибы |
Споры бацилл |
Сапрофитные кокки |
|
Органобентонит |
- |
- |
+ |
+ |
Примечание: «–» – отсутствие микроорганизмов; «+» – наличие микроорганизмов.
Установлено, что в исходном органобентоните присутствуют споры бацилл и сапрофитные кокки, отсутствуют палочковидные гетеротрофные бактерии, дрожжи и грибы. Известно, что размеры спор бацилл составляют от 1,2 до 1,5 мкм, а размер кокковых форм – от 0,2 до 0,4 мкм. Факт их обнаружения в органобентоните подтверждает наличие пор, в которых могут задерживаться такие формы микроорганизмов, а также служит косвенным доказательством наноразмерности структуры органобентонита [2]. При исследовании посевов стерилизованных образцов органобентонита микроорганизмы не выявлены.
На втором этапе производили оценку антимикробных свойств исследуемого органобентонита. В табл. 2 представлены результаты учета КОЕ на питательных средах при высеве взвеси микроорганизмов после контакта с органобентонитом (опыт) и исходных разведений (контроль).
Таблица 2
Количество КОЕ на питательных средах при обработке взвеси микроорганизмов органобентонитом
|
Вид микроорганизмов |
Количество КОЕ в чашках Петри Опыт Контроль |
|
|
E. coli |
18,6 ± 3,4 |
96,8 ± 8,6 |
|
S. aureus |
32,4 ± 2,8 |
91,7 ± 5,4 |
Учитывая размеры кишечной палочки и золотистого стафилококка, которые составляют 0,4–0,8 и 0,2–0,4 мкм соответственно [2], можно сделать заключение о способности органобентонита задерживать эти микроорганизмы. Бактерицидная способность органобентонита в наших исследованиях не выявлена.
На основании полученных данных разрабатывается технология использования органобентонита для комплексной очистки питьевой и сточной воды от ПАВ и различных микроорганизмов, в том числе и патогенных.
Рецензенты:
Сергеева И.В., д.б.н., профессор, зав. кафедрой ботаники и экологии Саратовского государственного аграрного университета им. Н.И. Вавилова, г. Саратов;
Коннова С.А., д.б.н., профессор, зав. кафедрой биохимии и биофизики, НИУ СГУ им. Н.Г. Чернышевского, г. Саратов.
Работа поступила в редакцию 28.01.2013.
Библиографическая ссылка
Тихомирова Е.И., Заматырина В.А., Бойченко Е.А., Кошелев А.В. ЭКОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ОРГАНОБЕНТОНИТОВ // Фундаментальные исследования. 2013. № 4-3. С. 660-662;URL: https://fundamental-research.ru/ru/article/view?id=31251 (дата обращения: 28.01.2026).



