Эстрогены влияют на дифференцировку различных тканей всего организма [5]. Развитие репродуктивных органов находится в прямой зависимости от гормонального влияния [4]. Основным местом синтеза эстрогенов являются яичники и желтое тело, доказано также образование этих гормонов в надпочечниках, семенниках и плаценте.
В настоящее время обнаружены два типа эстрогеновых рецепторов (ER) в тканях млекопитающих, в том числе и у человека – ER-α и ER-β. Они экспрессируются во многих тканях органов человека: ER-α – в передней доле гипофиза, матке, влагалище, яичках, печени, почках, ER-β – преимущественно в щитовидной железе, растущих фолликулах яичников, коже, предстательной железе, хряще, костях, мочевом пузыре, легких, желудочно-кишечном тракте [6].
Цель настоящей работы – определить методом иммуногистохимии с применением моноклональных антител локализацию эстрогеновых рецепторов (ER) в тканях экспериментальных животных (крыс) в различные периоды постнатального развития.
Материалы и методы исследования
В работе использован материал от самок млекопитающих в различные периоды постнатального развития в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Иммуногистохимическое исследование проводили с использованием системы визуализации Ultra Vision ONE c применением моноклональных антител ER фирмы Labvision (США). После депарафинизации и регидратации срезов осуществляли демаскировку антигенов кипячением образцов в 10 мМ цитратном буфере на водяной бане. Визуализацию результатов после иммуногистохимической реакции с моноклональными антителами проводили с помощью непрямой стрептавидин-биотиновой пероксидазной реакции. Срезы докрашивали гематоксилином Карацци и заключали в канадский бальзам.
Для морфометрического исследования использовали мазки изолированных гладких моцитов. Измерение линейных размеров лейомиоцитов и их ядер производили в двух взаимноперпендикулярых направлениях с помощью программы обработки и анализа изображений Image Tool версии 3.0. В соответствии с полученными цифровыми данными вычисляли объемы гладких миоцитов и их ядер (Хесин Я.Е.). Статистическое исследование данных проводили с использованием статистического пакета SPSS одноименной фирмы.
Проверка данных на соответствие нормальному распределению состояла из следующих процедур:
а) построение гистограмм с наложенной нормальной кривой и нормальных вероятностных графиков;
б) проверка на соответствие нормальному распределению одновыборочным тестом Колмогорова‒Смирнова.
Для описания выборочной совокупности данных использовали средние значения со стандартной ошибкой среднего показателя или стандартным отклонением, для определения статистически значимых различий между значениями показателей в группах данных были использованы непараметрические критерии Манна‒Уитни (для двух независимых групп) и Крускала‒Уоллиса (для более чем двух независимых групп).
Результаты исследования и их обсуждение
У мышей ядра эпителиальных и стромальных клеток влагалища характеризуются выраженной экспрессией эстрогеновых рецепторов в первый день жизни. Эпителий и строма влагалища более чувствительны к эстрогенам, чем ткани стенки матки [8, 9].
У мышей влагалище закрыто к моменту рождения и не открывается до 24–28-дневного возраста, когда наступает первая овуляция, свидетельствующая о наступлении полового созревания у самок [1]. Открытие влагалища происходит благодаря подъему уровня эстрогенов. Под действием эстрогенов также происходит первая кератинизация влагалища, которая наступает спустя 24–120 часов после появления отверстия влагалища. Кроме того, и пренатальное воздействие, и постнатальное введение эстрогенов экспериментальным животным способно вызывать преждевременное появление вагинального отверстия [2, 10].
Эстрогены индуцируют апоптоз эпителиальных клеток влагалища с образованием просвета [7]. Установлено, что в процессе кавитации просвет образуется за счет апоптоза клеток, расположенных в центральной части [3].
У 4-недельных самок крыс иммуногистохимическим методом установлена локализация ER-α у клеток базального и парабазального слоев эпителия, лейомиоцитов (рис. 1).
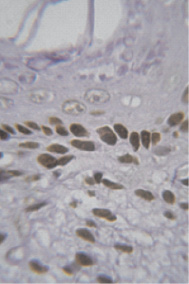
Рис. 1. Иммуноцитохимическая реакция к эстрогеновым рецепторам клеток базального и парабазального слоев эпителия влагалища новорожденной крысы. Об.100, ок. 10
У 6-недельных (пубертатный период) самок крыс ER экспрессируются в ядрах глубоких слоев эпителия, а также в ядрах мышечных и стромальных клеток. Незначительное окрашивание цитоплазмы и экстрацеллюлярных компонентов может быть связано с неспецифическими реакциями, т.к. они не являются мишенью для воздействия антител к ER (рис. 2).
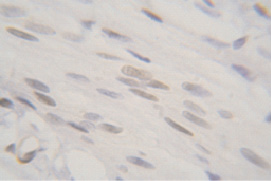
Рис. 2. Иммуноцитохимическая реакция к эстрогеновым рецепторам лейомиоцитов гладкой мышечной ткани стенки влагалища крысы, пубертатный период. Об.100, ок. 10
У половозрелых животных определяется положительная экспрессия к ER в тканях влагалища: ядра базального и парабазального слоев эпителия, лейомиоцитов, стромальных клеток обнаруживают положительную иммуногистохимическую реакцию.
Биохимический механизм действия эстрогенов, вероятно, связан со стимуляцией синтеза РНК в клетках и тканях репродуктивных органов, вследствие чего изменяются скорость и объем биосинтеза белков. Линейные корреляции между биологическими реакциями (такими как синтез РНК) и насыщенностью рецепторов (вплоть до нескольких тысяч) удается наблюдать в одном ядре. Увеличение содержания эстрогенов стимулирует транслокацию рецепторов к эстрадиолу из цитоплазмы в ядро. Увеличение содержания ядерного рецептора связано с клеточным ростом. При изучении влияния эстрогенов на синтез РНК и белка в незрелой матке крыс было показано, что при первичной стимуляции эстрогенами в течение фазы клеточного роста и дифференцировки происходит синтез ДНК, всех видов РНК (особенно мРНК) и многих белков. Повторное введение эстрогенов вызывает быстрое увеличение продукции мРНК, контролирующих синтез специфических «экспортируемых» белков (овальбумин, кональбумин и др). Таким образом, эстрогены стимулируют активность ядрышковой и нуклеоплазменной РНК-полимераз в соответствующих клетках-мишенях, вызывая синтез большого количества белков.
Уровень экспрессии ER-α в ядрах мышечных клеток у половозрелых животных, возможно, коррелирует с установленными нами незначительными колебаниями размеров ядер клеток во время разных фаз эстрального цикла у самок экспериментальных животных (крысы) (таблица).
Морфометрические показатели гладких миоцитов мышечной оболочки влагалища половозрелых крыс в зависимости от стадий эстрального цикла
|
faza1 |
V клетки |
V ядра |
Яйцо |
|||
|
Среднее |
Стд. ошибка среднего |
Среднее |
Стд. ошибка среднего |
Среднее |
Стд. ошибка среднего |
|
|
Проэструс |
3266,22 |
381,40 |
181,43 |
21,17 |
,0863 |
,0086 |
|
Метэструс |
3857,39 |
416,61 |
173,76 |
21,27 |
,0659 |
,0058 |
|
Диэструс |
3718,18 |
507,79 |
151,83 |
16,98 |
,0587 |
,0034 |
|
Эструс |
3590,86 |
335,60 |
150,66 |
12,09 |
,0650 |
,0047 |
Выводы
Таким образом, в ходе проведенного исследования установлена положительная экспрессия эстрогеновых рецепторов ядрами клеток базального и парабазального слоев эпителия, гладких миоцитов мышечной оболочки влагалища и стромальных клеток. Под влиянием эстрогенов происходит канализация эпителия влагалища путем апоптоза в период полового созревания с наступлением первой овуляции.
Рецензенты:
Ямщиков Н.В., д.м.н., профессор, заведующий кафедрой гистологии и эмбриологии, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара;
Cуворова Г.Н., д.б.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара.
Работа поступила в редакцию 21.12.2012.
Библиографическая ссылка
Шурыгина О.В. ЭСТРОГЕНОВЫЕ РЕЦЕПТОРЫ В ТКАНЯХ СТЕНКИ ВЛАГАЛИЩА МЛЕКОПИТАЮЩИХ // Фундаментальные исследования. 2013. № 3-1. С. 181-183;URL: https://fundamental-research.ru/ru/article/view?id=31173 (дата обращения: 13.01.2026).



