Пациенты с хирургическими заболеваниями органов брюшной полости, особенно панкреатитом, всегда относились к категории трудных. Одной из основных причин летальности больных панкреатитом является эндогенная интоксикация, приводящая к полиорганной недостаточности [1, 7, 8]. В патогенезе эндогенной интоксикации важную роль отводят синдрому кишечной недостаточности, развивающемуся при многих заболеваниях (перитонит, кишечная непроходимость, панкреонекроз и др.) [1, 6, 9, 10]. Важнейшее значение при этом имеют мембранодеструктивные процессы в тканях кишечника, к возникновению которых причастны свободно-радикальные реакции перекисного окисления липидов, чрезмерная фосфолипазная активность и гипоксия [3, 4]. Одним из путей предупреждения данного состояния является использование препаратов, способных влиять на указанные процессы [5, 8].
Целью работы явилось установление эффективности комбинированной терапии с включением нового антиоксиданта этоксидола и ангиопротектора пентоксифиллина в коррекции энтеральной недостаточности при панкреонекрозе и изучение патогенетических механизмов данной терапии.
Материалы и методы исследования
В основу работы положены экспериментальные исследования на взрослых беспородных половозрелых собаках обоего пола (n = 24), разделенных на две группы. Животным моделировали острый деструктивный панкреатит по способу В.М. Буянова с соавт. (1989) [2]. Проводили срединную лапаротомию, пунктировали желчный пузырь, забирали желчь с последующим лигированием места пункции. Затем желчь вводили в паренхиму вертикальной части поджелудочной железы по 0,6 мл в 8 точках. В контрольные сроки (1, 3, 5-е сутки) животным обеих групп выполняли релапаротомию, проводили макроскопическую оценку органов брюшной полости, измеряли ряд биофизических параметров кишечника, осуществляли забор крови из брыжеечных и бедренных вен, биопсию тонкой кишки. В первой группе животные получали инфузионную терапию (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы животного), во второй группе лечение дополняли внутривенным введением 5 % раствора этоксидола в дозе 10 мг/кг и внутримышечным введением пентоксифиллина из расчета 20 мг 2 раза в сутки. Экспериментальные исследования проводились под внутривенным наркозом с использованием тиопентал-натрия из расчета 0,04 г/кг массы животного.
Исследования проведены в соответствии с этическими требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., «Об утверждении правил лабораторной практики» (приказ МЗ РФ от 19.06.2003 г. № 267)) и одобрены локальным этическим комитетом.
Интраоперационно окислительно-восстановительный потенциал тканей кишечника определяли на универсальном ионометре ЭВ-74 с платиновым электродом, а электродом сравнения служил хлорсеребряный электрод. Коэффициент диффузии кислорода в тканях определяли на основе учета темпа падения диффузного тока восстановления по уравнению И.М. Эпштейна (Труфанов Л.А., 1991). Изменение гистогематической проницаемости регистрировалось по капиллярной фильтрации и потере белка (метод Лендиса) (Чернух А.М. и др., 1984). Липиды из ткани кишечника экстрагировали хлороформметаноловой смесью (Хиггинс Дж.А., 1990), фракционировали методом тонкослойной хроматографии. Полярные фосфолипиды разделяли на пластинах фирмы «Merk» на стеклянной основе, нейтральные липиды – на силикагелевых пластинах для обращенно-фазной тонкослойной хроматографии (Хиггинс Дж.А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware). Активность фосфолипазы А2 изучали в среде, содержащей 10 ммоль трис-HCL-буфер (рH 8,0), 150 ммоль тритон Х-100, 10 ммоль CaCl2 и 1,2 ммоль субстрата, в качестве которого использовали фосфатидилхолины яичного желтка (Трофимов В.А., 1999). Активность альфа-амилазы определяли методом ферментативного гидролиза крахмала, регистрируя данные на ФЭКе при длине волны 630–690 нм. Выраженность эндогенной интоксикации в локальном (брыжеечном) и общем кровотоке оценивали по следующим показателям: содержание молекул средней массы определяли спектрофотометрическим методом на спектрофотометре СФ-46 при длине волны 254 и 280 нм (Пикуза О.И., Шакирова Л.З., 1994); общую и эффективную концентрацию альбумина (ОКА и ЭКА) в сыворотке крови – флуоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд»; резерв связывания альбумина (РСА) определяли по формуле РСА = ЭКА/ОКА; индекс токсичности (ИТ) плазмы – по формуле ИТ = ОКА/ЭКА – 1 (Грызунов Ю.А., Добрецов Г.Е., 1994). Проводили лазерную доплеровскую флоуметрию микроциркуляторного русла тканей кишечника с помощью анализатора ЛАКК-02 (ООО НПП «ЛАЗМА», Россия). Содержание диеновых и триеновых конъюгатов (ДК и ТК) оценивали спектрофотометрическим методом (Ганстон Ф.Д., 1986). Уровень малонового диальдегида (МДА) определяли спектрофотометрическим методом по реакции с тиобарбитуровой кислотой (Sigma) (Егоров Д.Ю., Козлов А.В., 1988).
Статистическую обработку полученных данных производили общепринятыми методами статистики с определением достоверности различий между данными в опытной и контрольной группах на основе расчета критерия Стьюдента. Выявленные закономерности и связи изучаемых параметров между группами и признаками были значимыми при вероятности безошибочного прогноза р = 95 % и более.
Результаты исследования и их обсуждение
Эксперименты показали, что выбранная модель оказалась адекватной для решения поставленных задач. У животных обеих групп развивалась деструктивная форма острого панкреатита. При моделированном остром деструктивном панкреатите со стороны кишечника возникали выраженные функционально-метаболические нарушения.
В указанный период наблюдения в кишечнике выявлены существенные изменения транскапиллярного обмена и биоэнергетики. Так, на первые сутки развития деструктивного панкреатита отмечалось заметное изменение транскапиллярного обмена и электрогенеза тканей кишечника. На конечном этапе исследования (5-е сутки) микроциркуляторные нарушения в тканях кишечника нарастали, количество капиллярного фильтрата и потеря белка существенно превосходили норму на 147,8 и 237,5 % (p < 0,05) соответственно.
Исследования показали, что на фоне развития панкреонекроза патологические изменения в значительной степени затрагивали и электрогенез тканевых структур кишечника. Регистрировалось снижение окислительно-восстановительного потенциала ткани на 26,9–66,5 % (p < 0,05). В тканевых структурах кишечника отмечено значительное снижение (на 26,3–60,1 %, p < 0,05) коэффициента диффузии кислорода.
Изучение микроциркуляции в тканях кишечника выявило существенные изменения исследуемых показателей, что было выявлено в виде снижения показателя микроциркуляции на 51,7–76,8 % (p < 0,05), повышения индекса шунтирования на 17,1–30,2 % (p < 0,05), увеличения влияния миогенного и нейрогенного компонентов сосудистого тонуса на 21,7–31,5 и 19,4–69,4 % (p < 0,05) соответственно (таблица).
В тканях кишечника выявлена выраженная интенсификация процессов перекисного окисления липидов и активизация фосфолипазных систем. Оказалось, что уже через сутки после моделирования острого панкреатита уровень первичных и вторичных продуктов перекисного окисления липидов в тканях кишечника резко возрастал.
Анализ липидограмм выявил существенные модификации липидного состава тканей кишечника. Установлены заметные отклонения уровня основных мембранообразующих липидов и резкое увеличение содержания фракций липидов, обладающих детергентным действием, в частности, лизоформ фосфолипидов (рост более чем в 3 раза) и свободных жирных кислот (рост более чем в 1,7 раза). Другие фракции липидов были также подвержены существенным изменениям. Безусловно, диагностированные мембранодестабилизирующие явления в тканях кишечника явились основой для нарушения барьерной его функции, что было подтверждено при установлении уровня гидрофобных и гидрофильных токсических продуктов в плазме крови, оттекающей от кишечника.
Показатели микроциркуляции кишечника при панкреонекрозе
|
Показатель |
Исходные данные |
Этапы наблюдения (от момента моделирования) |
||
|
1-е сутки |
3-и сутки |
5-е сутки |
||
|
ПМ |
31,2 ± 1,5 |
15,1 ± 0,65* |
11,2 ± 0,51* |
7,25 ± 0,20* |
|
НТ |
0,72 ± 0,03 |
0,86 ± 0,02* |
0,98 ± 0,05* |
1,22 ± 0,06* |
|
МТ |
0,92 ± 0,04 |
1,12 ± 0,01* |
1,19 ± 0,03* |
1,21 ± 0,05* |
|
ПШ |
0,76 ± 0,05 |
0,89 ± 0,04 |
0,98 ± 0,02* |
0,99 ± 0,04* |
Примечание: * – достоверность отличия по отношению к исходу при p < 0,05; ПМ – показатель микроциркуляции, НТ – нейрогенный тонус, МТ – миогенный тонус, ПШ – показатель шунтирования.
Таким образом, при остром деструктивном панкреатите развитие энтеральной недостаточности сопряжено с формированием мембранодеструктивных явлений и нарушением микроциркуляции тканевых структур органа. Указанное явилось основой нарушения его барьерной функции. Кишечник при этом оказался одним из «источников» эндогенной интоксикации. Полученный фактический материал явился основой для совершенствования терапии панкреонекроза. Перспективным представляется применение лечебных агентов, способных корригировать выявленные механизмы формирования энтеральной недостаточности при остром панкреатите.
Во второй группе в лечение животным включали этоксидол и пентоксифиллин в вышеуказанных дозах. Были выявлены следующие результаты.
Экспериментально установлено, что с первых суток применения апробируемой терапии отмечалось сдерживание прогрессирования нарушений транскапиллярного обмена и электрогенеза тканей кишечника. На конечном этапе исследования (5-е сутки) положительный эффект лечения был наиболее выражен, что проявилось в частичной коррекции микроциркуляторных нарушений в тканях кишечника: количество капиллярного фильтрата и потеря белка снижались относительно контроля на 22,4 и 43,2 % (p < 0,05), но оставались достоверно выше нормы. Регистрировалось увеличение окислительно-восстановительного потенциала ткани на 13,5–21,4 % (p < 0,05) относительно контроля, исходных значений данный показатель также не достигал. Применение этоксидола и пентоксифиллина способствовало повышению коэффициента диффузии кислорода на 11,2–24,1 % (p < 0,05) в тканевых структурах кишечника относительно контрольных данных.
Изучение микроциркуляции в тканях кишечника также выявило положительный лечебный эффект апробируемой схемы терапии. Показатель микроциркуляции возрастал на 101,7–215,2 % (p < 0,05), индекса шунтирования снижался на 10,2–14,3 % (p < 0,05), уменьшалось влияние миогенного и нейрогенного компонентов сосудистого тонуса на 12,5–16,7 и 10,3–25,1 % (p < 0,05) соответственно относительно данных контрольной группы исследования. Отметим, что данные показатели не достигали исходных величин даже к концу наблюдения.
Изучение процессов перекисного окисления липидов и активности фосфолипазы А2 в ткани кишечника на фоне применения этоксидола и пентоксифиллина показало снижение содержания первичных и вторичных продуктов перекисного окисления липидов в тканях кишечника по сравнению с контрольными данными на 13,3–44,5 и 14,5–21,4 % (p < 0,05) соответственно и уменьшение активности фосфолипазы А2 – на 23,1–34,5 % (p < 0,05) (рис. 1).
Анализ липидограмм выявил частичную коррекцию липидного состава тканей кишечника. По сравнению с контрольными данными установлено снижение содержания фракций липидов, обладающих детергентным действием, в частности, лизоформ фосфолипидов (уменьшение на 32,4–52,1 %, p < 0,05) и свободных жирных кислот (снижение на 9,7–28,9 %, p < 0,05). По сравнению с нормой данные показатели были достоверно выше на всех сроках наблюдения. Другие фракции липидов были также подвержены положительным изменениям (рис. 2).
Изучение уровня гидрофобных и гидрофильных токсических продуктов в плазме крови выявило снижение выраженности интоксикационного синдрома. Индекс токсичности плазмы крови, оттекающей от кишечника, уменьшался на 36,0–49,0 % (p < 0,05), уровень молекул средней массы снижался на 12,1–25,1 % (p < 0,05) относительно данных контрольной группы. Следует отметить, что полного купирования синдрома эндогенной интоксикации не отмечалось (рис. 3).
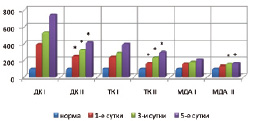
Рис. 1. Сравнительная оценка показателей интенсивности перекисного окисления липидов при панкреонекрозе на фоне инфузионной (I) и апробируемой терапии (II) (* – изменения показателей, достоверные по отношению к контрольному уровню р < 0,05)
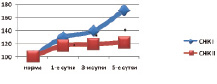
Рис. 2. Содержание свободных жирных кислот (СЖК, %) тканей кишечника при панкреонекрозе на фоне инфузионной (I) и апробируемой терапии (II) (* – изменения показателей, достоверные по отношению к контрольному уровню р < 0,05)
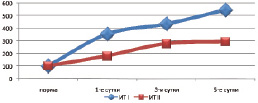
Рис. 3. Сравнительная оценка индекса токсичности локального кровотока при панкреонекрозе на фоне инфузионной (I) и апробируемой терапии (II) (* – изменения показателей, достоверные по отношению к контрольному уровню р < 0,05)
Заключение
Таким образом, в заключение следует отметить эффективность комбинированного применения антиоксиданта этоксидола и ангиопротектора пентоксифиллина в терапии энтеральной недостаточности при панкреонекрозе, что проявилось в частичной коррекции функционального состояния ткани кишечника и, как следствие, в снижении выраженности интоксикационного синдрома. Следует подчеркнуть, что основными саногенетическими механизмами данной комбинации лекарственных препаратов являются их способность снижать интенсивность процессов перекисного окисления липидов и активность фосфолипазных систем, а также корригировать нарушения микроциркуляции в тканях кишечника. Такое воздействие указанных лечебных агентов на кишечник обусловливает сдерживание прогрессирования мембранодеструктивных явлений в его тканевых структурах, что ведет к пролонгации барьерной функции органа.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Работа поступила в редакцию 11.01.2013.
Библиографическая ссылка
Власов А.П., Суслов А.В., Анаскин С.Г., Шибитов В.А., Логинов М.А., Полозова Э.И. ЭНТЕРОПРОТЕКТОРНАЯ ТЕРАПИЯ ПРИ ПАНКРЕОНЕКРОЗЕ // Фундаментальные исследования. 2013. № 3-1. С. 41-45;URL: https://fundamental-research.ru/ru/article/view?id=31142 (дата обращения: 21.02.2026).



