Ранее в [5] мы обсудили актуальность вопроса увеличения растворимости различных лекарственных субстанций путем получения их твердых дисперсий с различными вспомогательными веществами. Были рассмотрены возможности твердофазной механохимической технологии для синтеза таких композиционных материалов. Преимущества механохимического «подхода» были продемонстрированы на примерах малорастворимых лекарственных веществ (ЛВ), подвергающихся аморфизации, либо обладающих кислотно-основными свойствами – ацетилсалициловой кислоты и растительных флавоноидов. Далее, в [4] было описано получение и свойства твердых дисперсий лекарственных веществ (ЛВ) с полисахаридами и растительным сапонином – глицирризиновой кислотой и их водных растворов.
В этой части нашей работы мы рассмотрим физико-химические аспекты получения твердых дисперсий полисахаридов и ЛВ, а именно:
– изменения молекулярно-массовых характеристик полисахаридов;
– возможные механизмы образования межмолекулярных комплексов;
– доказательства существования межмолекулярных комплексов типа «гость-хозяин» в растворах полученных твердых дисперсий состава полисахарид-ЛВ методом ЯМР-спектроскопии;
– обоснование режимов механохимической обработки при получении твердых дисперсий.
Механохимические трансформация полисахаридов
Одной из основных физико-химических характеристик макромолекул полисахаридов являются молекулярные массы, изменяющиеся в широких пределах от ~103 до ~107 Да. В технологических процессах получения продуктов на основе таких полимеров их макромолекулы могут подвергаться механическим воздействиям, приводящим к частичной деструкции – разрыву цепей. В результате происходит уменьшение средней молекулярной массы и возрастает полидисперсность [1]. Эти деструктивные изменения могут быть наиболее выражены в «сухих» технологических процессах, например, измельчении, таблетировании, смешении и т.д. Примером таких процессов является механохимическое твердофазное получение супрамолекулярных комплексов лекарственных веществ с водорастворимыми полимерами (полисахаридами) [4].
Так, в одной из наших ранних работ [8] была исследована вязкость растворов яблочного пектина и его комплексов включения, полученных при совместной механообработке медамина и яблочного пектина. Для растворов пектина наблюдался аномальный ход зависимости характеристической вязкости от концентрации, т.е. растворы пектина проявляли свойства слабых электролитов. Однако эти свойства постепенно уменьшались при увеличении механической нагрузки (от 20 до 60 g), что объясняется уменьшением молекулярной массы пектина с 19900 до 5400. Для растворов комплексов такой зависимости не наблюдалось и при этом не происходило столь значительного уменьшения вязкости растворов, что позволяет предположить стабилизирующую роль субстанции низкомолекулярного лекарственного вещества.
В работе [2] методом гель-проникающей хроматографии [16] проведено более детальное изучение молекулярно-массовых характеристик полисахаридов – декстранов 10, 40, 70, гидроксиэтилкрахмала 200/0,5, арабиногалактанов из лиственницы и камеди акации при их механической обработке ударно-истирающими воздействиями в ротационной и планетарной мельницах. Анализ гель-проникающей хроматографией исходных и механически обработанных образцов полисахаридов показал, что полимеры подвергаются частичной деструкции, что было подтверждено расчетными характеристиками молекулярно-массовых распределений исследованных полисахаридов до и после механической обработки (табл. 1).
Из данных табл. 1 следует, что при использовании интенсивного режима механической обработки (планетарная мельница) происходит значительное снижение молекулярных масс полисахаридов и небольшое изменение их полидисперсности Mw/Mn. По мере увеличения молекулярной массы Мw исходных полимеров степень механодеструкции повышается, что согласуется с литературными данными [1]. Интересно отметить, что макромолекулы с высокой степенью «разветвления» – ГЭК и АГ деструктируются на приблизительно равные фрагменты. Во всех полисахаридах не происходит значительного увеличения степени полидисперсности, вероятно, из-за преимущественной механодеструкции их высокомолекулярных фракций. Очевидно, что характер механодеструкции связан со строением макромолекул полисахаридов и физико-химическими механизмами разрыва их цепей. В [11] была предложена модель механодеструкции линейных синтетических полимеров, которая предполагала, что наибольшую вероятность разрыва при механическом воздействии имеют звенья, находящиеся в середине макромолекулы. При качественном рассмотрении, характер механодеструкции ГЭК и АГ близок к этой модели. В случае декстранов и фибрегама механизм механодеструкции может быть иной.
Отдельного обсуждения заслуживают результаты, полученные по арабиногалактану из древесины лиственницы. При использовании наиболее интенсивного режима механической обработки (планетарная мельница и ротационная мельница со смешанной шаровой загрузкой) происходит значительное снижение молекулярной массы макромолекул арабиногалактана. Согласно полученным хроматограммам его макромолекулы Mw = 17,3 кДа (Mn = 13,9 кДа) количественно «разбиваются» на 2 практически равных фрагмента Mw = 8,3 кДа (Mn = 7,7 кДа). Причем степень полидисперсности Mw/Mn при этом уменьшается до 1,08. Полученные данные позволяют предположить, что нативные макромолекулы АГ состоят из двух одинаковых по молекулярной массе фрагментов, связанных относительно непрочной связью, подвергающейся разрыву в условиях интенсивной механической обработки. Интересно отметить, что макромолекулы АГ с ММ (Molecular Mass) ~9 кДа также являются основным продуктом химической деструкции АГ из канадской лиственницы [15].
Таблица 1
Характеристики молекулярно-массового распределения полисахаридов
|
Образец |
Способ получения |
Mn, кДа |
Mw, кДа |
Mw/Mn |
Весовые доли макромолекул, кДа |
|
|
10 % |
90 % |
|||||
|
Фибрегам |
Исходный |
146,6 |
256,7 |
1,8 |
< 75,9 |
< 528,2 |
|
м/о в АГО-21 |
31,4 |
55,2 |
1,8 |
< 16,3 |
< 113,5 |
|
|
м/о в ВМ-12 |
120,3 |
231,6 |
1,9 |
< 60,3 |
< 478,4 |
|
|
Арабиногалактан |
исх. |
13,9 |
17,3 |
1,2 |
< 9,0 |
< 27,9 |
|
м/о в АГО-2 |
9,3 |
11,2 |
1,2 |
< 6,1 |
< 18,4 |
|
|
м/о в ВМ-1 |
13,1 |
16,3 |
1,2 |
< 8,1 |
< 26,2 |
|
|
Гидроксиэтилкрахмал |
Исходный |
47,9 |
116,9 |
2,4 |
< 20,9 |
< 265,3 |
|
м/о в АГО-2 |
26,6 |
55,2 |
2,1 |
< 12,7 |
< 118,9 |
|
|
м/о в ВМ-1 |
45,6 |
105,5 |
2,3 |
< 20,0 |
< 237,6 |
|
|
Декстран 70 |
Исходный |
30,9 |
76,4 |
2,5 |
< 14,0 |
< 174,7 |
|
м/о в АГО-2 |
22,7 |
54,8 |
2,4 |
< 10,4 |
< 123,5 |
|
|
м/о в ВМ-1 |
29,6 |
73,5 |
2,5 |
< 13,4 |
< 169,2 |
|
|
Декстран 40 |
Исходный |
24,6 |
38,0 |
1,5 |
< 13,3 |
< 72,3 |
|
м/о в АГО-2 |
19,5 |
31,9 |
1,6 |
< 10,4 |
< 61,3 |
|
|
м/о в ВМ-1 |
24,3 |
37,4 |
1,5 |
< 13,0 |
< 71,2 |
|
|
Декстран 10 |
Исходный |
8,3 |
13,4 |
1,6 |
< 4,2 |
< 26,4 |
|
м/о в АГО-2 |
8,0 |
12,1 |
1,5 |
< 41,9 |
< 22,7 |
|
|
м/о в ВМ-1 |
8,3 |
13,4 |
1,6 |
< 4,2 |
< 26,3 |
|
Примечания:
1 – механическая обработка в планетарной мельнице, ускорение 40 g, 20 мин;
2 – механическая обработка в шаровой мельнице, ускорение 1 g, 4 часа.
Из табл. 1 также следует, что в «мягких» условиях механической обработки можно практически избежать механодеструкции исследуемых полисахаридов. Следует отметить, что именно в этих условиях достигается наибольшее увеличение водорастворимости ЛВ из полученных твердых дисперсий. Следовательно, именно нативные, а не подвергшиеся механодеструкции макромолекулы полисахаридов способны образовывать наиболее прочные межмолекулярные комплексы типа «гость-хозяин». Кроме того, с точки зрения перспектив использования изученных композиций в составе БАД (биологически активных добавок) и лекарственных средств в технологических процессах их приготовления желательно избегать заметного изменения молекулярно-массовых характеристик полимерных материалов, так как в противном случае могут потребоваться дополнительные испытания и стандартизация продуктов. По нашему мнению, именно эти «мягкие» условия механической обработки в большинстве случаев являются предпочтительными.
Молекулярная динамика и строение комплексов арабиногалактана
На примере систем АГ-ЛВ [3] проведено исследование молекулярной динамики межмолекулярных комплексов, а также подвижности фрагментов макромолекул АГ методом Н1 ЯМР-спектроскопии. Для характеристики комплексов применим метод ЯМР-релаксации. Известно, что времена спин-решеточной Т1 и спин-спиновой Т2 релаксации очень чувствительны к межмолекулярному взаимодействию и к диффузионной подвижности молекул [9]. При попадании молекулы внутрь комплекса времена релаксации протонов существенно сокращаются из-за замедления диффузионной подвижности. В ситуации, когда молекулы в комплексе и в растворе находятся в состоянии быстрого обмена, изменение сигнала ЯМР при варьировании задержки между импульсами описывается моноэкспоненциальным законом. В случае же так называемого медленного обмена (по сравнению с временем релаксации) наблюдается би- или триэкспоненциальная кинетика:
A(t) = P1.exp(–t/T21) + P2.exp(–t/T22) + + P3.exp(–t/T23).
Компоненты P1, Р2 и Р3 соответствуют доле протонов/молекул, различающихся различной диффузионной подвижностью. Например, в случае равновесия молекула ЛВ в комплексе – молекула ЛВ в растворе, компонента P1 относится к доле молекул, находящихся в комплексе, а P2 – доле молекул в растворе. Типичные значения Т2 для молекул в растворе 0,5–1 с, а в комплексе – 0,03–0,09 с. Уменьшение времени Т21 означает снижение молекулярной подвижности молекул ЛВ в комплексе.
Аналогичное рассмотрение применимо для изучения «внутренней» подвижности в полимерах, когда различные части макромолекулы различаются по подвижности, вероятно обусловленной вращением и конформационными переходами в отдельных фрагментах макромолекул.
Рассмотрим полученные результаты измерений Т2 для изученных образцов.
Арабиногалактан. Кинетика спада сигнала ЯМР в водном растворе демонстрирует триэкспоненциальную закономерность. Её рассчитанные параметры для арабиногалактана, а также комплексов ЛВ-АГ приведены в табл. 2. Можно предположить, что короткие времена релаксации соответствуют внутренним протонам, а длинные – внешним протонам полимерного клубка. В результате механической активации в планетарной мельнице и частичной механодеструкции (см. табл. 1) увеличивается молекулярная подвижность внутренних фрагментов макромолекулы и снижается их доля.
Таблица 2
Параметры времен спин-спиновой релаксации макромолекул арабиногалактана в водных растворах
|
Образец |
P1, % |
T21, мс |
P2, % |
T22, мс |
P3, % |
T23, мс |
|
Арабиногалактан исходный |
24,5 ± 4,9 |
1,6 ± 0,4 |
41,7 ± 5,2 |
12 ± 4 |
33 ± 8 |
77 ± 20 |
|
Арабиногалактан, м/а в планетарной мельнице 10 мин |
14,6 ± 0,5 |
2,0 ± 0,2 |
49,2 + /-1,7 |
41 ± 2 |
36,2 ± 1,9 |
199 ± 9 |
В спектрах Н1 ЯМР порошкообразной субстанции АГ, на фоне широкой линии, обусловленной неусредняемым в твердых телах диполь-дипольному взаимодействию, наблюдается относительно узкая линия шириной ~ 6 кГц, свидетельствующая о наличии «подвижной» фазы. Интегральная интенсивность ее составляет до ~ 15 % от количества ядер 1Н в образце. Учитывая, что содержание влаги в АГ не превышает 2 % по массе, разумно предположить, что наблюдаемая «подвижная фаза» относится к фрагментам макромолекул АГ, вероятно боковых цепей. По нашему мнению, повышенная подвижность фрагментов макромолекулы может способствовать образованию межмолекулярных комплексов ЛВ-АГ при механической активации в твердом состоянии и в водных растворах.
Системы АГ-ЛВ. В большинстве случаев наблюдается выраженная биэкспоненциальная кинетика, подтверждающая нахождение молекул ЛВ как в свободном состоянии, так и в комплексе с АГ. При этом доля связанных молекул ЛВ в механически активированных образцах увеличивается, и их молекулярная подвижность уменьшается. Времена релаксации «свободных» молекул ЛВ практически не изменяются. Характеристические линии 1Н ЯМР азалептина (Clozapine) и мезапама (Medazepam) при комплексообразовании смещается в слабое поле, вероятно, из-за протонирования молекул за счет небольших количеств остатков уроновых кислот (uronic acid), присутствующих в АГ. Это смещение также увеличивается в механически активированных образцах. В случае индометацина (Indometacin) и сибазона (Diazepam) химические сдвиги при комплексообразовании не изменяются. Исходя из условий «медленного обмена», можно предположить, что время жизни молекул ЛВ в комплексе с АГ составляет ~ ≥ 100 мс.
Весьма показателен пример системы АГ-сибазон. В растворах этих смесей, не подвергшихся механической обработке, наблюдается моноэкспоненциальный спад сигнала, однако с более короткими временами, чем у свободного сибазона. Очевидно, в данном случае имеет место «быстрый» обмен молекул сибазона между раствором и комплексом. В механически активированных смесях наблюдается биэкспоненциальный спад, что свидетельствует о замедлении скорости обмена и более прочном комплексообразовании.
Таким образом, во всех растворах исследованных смесей ЛВ-АГ аналогично данным по повышению растворимости динамическая ЯМР-спектроскопия также указывает на образование межмолекулярных комплексов «полисахарид–ЛВ». Наиболее вероятно, что сайтами комплексообразования являются пространства между боковыми цепями этих разветвленных макромолекул. В отличие от циклодекстринов ансамбли макромолекул полисахаридов, в частности, арабиногалактана (рисунок), микрогетерогенны – имеет место определенное распределение по массам и структуре.
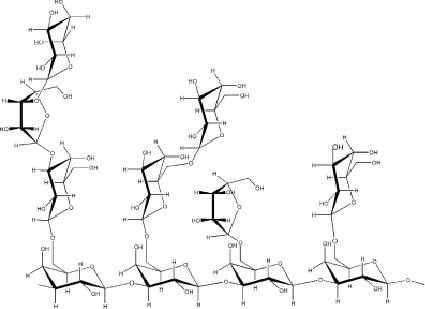
Структура макромолекулы полисахарида арабиногалактана
Вследствие этого построение молекулярной модели комплекса крайне затруднено. По-видимому, основной вклад в механизм связывания вносят так называемые гидрофобные взаимодействия, типичные для комплексов циклодекстринов типа «гость-хозяин». Определенным подтверждением этому служит факт более прочного комплексирования наиболее липофильных, практически нерастворимых в воде ЛВ [4]. В этом случае высокоразветвленная структура макромолекул АГ [7] наиболее благоприятна для комплексообразования. Однако определенный вклад могут вносить и кулоновские взаимодействия при наличии кислотно-основных групп в полисахаридах и ЛВ [14, 6, 13, 10].
Возникает вопрос, а образует ли арабиногалактан комплексы включения с ЛВ, имеющими относительно высокую водорастворимость? Интересные результаты были получены при исследовании комплексообразования арабиногалактана с салициловой кислотой (СК) методом ЯМР релаксации. Салициловая кислота имеет относительно большую водорастворимость – до 2,2 г/л при +25 °С и увеличение ее растворимости за счет комплексообразования с арабиногалактаном относительно невелико. Данные растворимости СК и ее комплексов с арабиногалактаном приведены в табл. 1 [4]. Все это может указывать на относительно низкую стабильность межмолекулярных комплексов. Однако относительно высокая концентрация ее растворов позволяет получать качественные спектры 1Н ЯМР и измерять времена релаксации ароматических протонов салициловой кислоты и ее комплекса с арабиногалактаном, полученным при совместной механохимической обработке, а также путем физического смешения растворов СК и АГ. В результате было обнаружено, что кинетика спада сигнала эха протонов СК существенно укорачивается в комплексе по сравнению с чистым раствором. Это указывает на уменьшение подвижности молекулы СК и может служить доказательством образования комплекса включения. Учитывая, что исходный комплекс был приготовлен в весовых соотношениях 1:10, что соответствует примерно 15:1 в мольном соотношении, можно предположить, что одна макромолекула AГ может включать в себя 10 и более молекул «гостя». Необходимо отметить, что в отличие от большинства малорастворимых ЛВ, описанных ранее в [4], все измеренные кинетики описываются моноэкспоненциальной зависимостью, что в случае комплекса означает наличие быстрого обмена молекулами «гостя» между комплексом и раствором. Измерение кинетики спада сигнала эха протонов СК при различных концентрациях комплекса позволило рассчитать константу стабильности данного комплекса в водном растворе. Оценка константы стабильности комплекса СК-АГ дает величину K = 2,3 ± 0,1∙103 M–1, в предположении, что скорость реакции СК + АГ ↔ СК–АГ слабо зависит от присутствия нескольких молекул СК в макромолекуле арабиногалактана.
Аналогичные измерения были сделаны для комплексов, приготовленных смешением водных растворов СК и АГ в том же соотношении при 300 °К. Расчет константы стабильности комплекса СК + АГ дает величину K = 9 ± 1∙102 M–1. Анализ этих данных показывает, что комплексы, приготовленные «механохимическим» способом, обладают повышенной в ~2,5 раза стабильностью. Различие в величинах T21 равных 140 и 261 мс, вероятно, указывает и на разное строение комплексов приготовленных разными способами. Можно предположить, что при механическом воздействии происходит более глубокое проникновение молекулы лекарства в матрицу полисахарида, и эта структура сохраняется при растворении комплекса.
Обнаружено также, что константы стабильности К(Т) всех комплексов быстро уменьшаются с ростом температуры. Например, для «механохимического» комплекса СК-АГ, К(293) = 2300 М–1, К(320) = 700 М–1. Из температурной зависимости К(Т) рассчитаны термодинамические параметры образования комплекса (табл. 3).
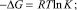
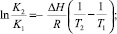
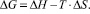
Таблица 3
Термодинамические параметры образования комплексов СК с АГ (в М–1) в водных растворах при 293 °К. Погрешность расчета ΔG не превышает 5 %, а ΔH и ΔS не более 10 %.
|
Термодинамические параметры комплексообразования |
Комплексы СК-АГ, приготовленные механохимически |
Комплексы СК-АГ, образованные при смешении растворов СК и АГ |
|
ΔG (кДж∙моль–1) |
–18,8 |
–16,9 |
|
ΔH (кДж∙моль–1) |
–32,9 |
–16,8 |
|
ΔS (Дж∙моль–1К–1) |
–48,1 |
~0 |
Как видно из полученных значений, для комплексов салициловой наблюдается очень значительный выигрыш в энтальпии в результате комплексообразования, что указывает на определяющую роль Ван-дер-Ваальсовых взаимодействий [12]. А резкое падение стабильности комплекса с температурой объясняется высоким отрицательным изменением энтропии.
Особо необходимо отметить, что комплексы, приготовленные путем смешения водных растворов СК и АГ, обладают существенно меньшей стабильностью. Это следует из более высоких значений времен релаксации протонов СК в таком комплексе и меньшим значением констант стабильности К(Т). Сравнение «механохимического» и «физического» комплексов указывает, что большая стабильность комплекса, приготовленного механохимически, может быть обусловлена более глубоким проникновением молекулы «гостя» внутрь макромолекулы АГ и более высокими энергетическими затратами на сольватацию арабиногалактана (вытеснение молекул «гостя» молекулами воды).
Заключение
Таким образом, в настоящей работе изучены процессы механодеструкции полисахаридов и найдены условия получения их твердых дисперсий, позволяющие минимизировать эти нежелательные процессы. На основании изучения параметров молекулярной подвижности методом спектроскопии ЯМР в твердой и жидкой фазах доказано образование межмолекулярных комплексов полисахаридов и молекул лекарственных веществ по типу «гость-хозяин». Показано повышение стабильности межмолекулярных комплексов, сформировавшихся в твердой фазе при механохимическом получении твердых дисперсий, по сравнению с комплексами, образовавшимися в водных растворах. Предложена гипотеза о характере межмолекулярных взаимодействий в изученных комплексах.
Рецензенты:
Мордвинов В.А., д.б.н., заведующий лабораторией молекулярной и клеточной биологии, заместитель директора по научной работе Института цитологии и генетики СО РАН, г. Новосибирск;
Верещагин Е.И., д.м.н., профессор, заведующий кафедрой анестезиологии и реаниматологии Новосибирского государственного медицинского университета, г. Новосибирск.
Работа поступила в редакцию 11.01.2013.
Библиографическая ссылка
Душкин А.В., Метелева Е.С., Чистяченко Ю.С., Поляков Н.Э. ХИМИЧЕСКИЕ ТРАНСФОРМАЦИИ И МОЛЕКУЛЯРНАЯ ДИНАМИКА ПОЛИСАХАРИДОВ И ИХ МЕЖМОЛЕКУЛЯРНЫХ КОМПЛЕКСОВ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ В РАСТВОРАХ И ТВЕРДЫХ ФАЗАХ // Фундаментальные исследования. 2013. № 1-3. С. 789-795;URL: https://fundamental-research.ru/ru/article/view?id=31030 (дата обращения: 13.03.2026).



