Переломы ацетабулярной области составляют 5,9–20 % от всех повреждений таза и являются одними из наиболее сложных повреждений тазобедренного сустава [5]. Ранее на экспериментальной модели нами было установлено замедленное течение репаративного процесса при заживлении ацетабулярного перелома в условиях аппаратной фиксации отломков [8, 11]. Тем не менее отдельные работы экспериментально-клинического и морфологического характера не отражают всей совокупности дистрофических изменений в анатомических структурах тазобедренного сустава при его повреждениях, что препятствует поиску новых подходов к регуляции репаративного морфогенеза костной и хрящевой тканей [6, 8, 11]. Одним из новых направлений экспериментальной медицины является изучение эффективности метаболических препаратов с антиоксидантными свойствами при лечении внутрисуставных повреждений и профилактики их последствий [13]. Целью исследования являлась морфологическая характеристика заживления ацетабулярного перелома в условиях чрескостного остеосинтеза и стимуляции репаративного остеогенеза внутрисуставным введением фармакологических препаратов метаболического действия.
Материалы и методы исследований
Работа основана на анализе результатов экспериментов, проведенных на 16 беспородных собаках обоего пола, возраст которых составлял от 1 года до 3 лет (хирург-экспериментатор д.б.н. В.В. Краснов). Содержание, уход и эвтаназия животных осуществлялись в соответствии с требованиями Министерства здравоохранения РФ к работе экспериментально-биологических клиник, а также «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» [3]. Проведение исследований разрешено этическим комитетом учреждения.
Животным двух экспериментальных групп выполнено моделирование перелома вертлужной впадины, внешняя фиксация аппаратом, внутрисуставные инъекции. В I группе (n = 8) животным внутрисуставно вводили физиологический раствор, во II группе (n = 8) выполняли инъекции смеси официнальных растворов аскорбиновой кислоты, глюкозы и аутологичной плазмы крови. Для пролонгированного управляемого введения растворов в полость сустава использовали автоматизированный дозатор лекарственных веществ НДЛ-3 (Россия), который закрепляли на опоре аппарата внешней фиксации. В суставную полость вводили катетер «Перификс», подводя его рабочий конец к зоне перелома суставной впадины. Для обеспечения стерильности растворов лекарственных веществ использовали фильтр «Перификс» 0,2 мкм [10].
Стимуляцию репаративного процесса в группе II осуществляли пролонгированным дозированным введением смеси растворов лекарственных веществ в полость сустава. Официнальные растворы аскорбиновой кислоты и глюкозы применяли в конечной концентрации 5 %. Аутологичную плазму получали по стандартной технологии из крови экспериментальных животных [4]. Указанные препараты смешивали ex temporae в определенном соотношении и вводили по заданной схеме [9].
На 21-е сутки после операции в обеих группах аппарат демонтировали, так что срок фиксации отломков был сокращен в два раза (в сравнении с общепринятым – для повреждений данного типа) [8]. Образцы тканей для гистологического исследования забирали на 14-е и 42-е сутки послеоперационного периода. Объектами исследования являлись ипсилатеральные тазобедренные суставы. Материал помещали в смесь 2 %-х растворов глутарового и параформальдегидов на фосфатном буфере (рН 7,4) с добавлением 0,1 % пикриновой кислоты на 7–14 суток, затем декальцинировали в Трилоне Б и заливали в парафин. Срезы толщиной 6–7 мкм окрашивали гематоксилином и эозином, альциановым синим при рН 1,0 и 2,5 – для выявления кислых сульфатированных и несульфатированных гликозаминогликанов. Морфометрическое исследование гистологических препаратов проведено с использованием проекционного микроскопа Visopan («Reichert-Jung», Австрия). Процентное соотношение площадей тканей в зоне сращения перелома оценивали с использованием тест-системы [1]; измерения выполняли не менее чем в 40 полях зрения. Статистическую обработку данных производили с применением программы AtteStat, версия 10.8.8 (свидетельство № 2002611109 от 28.06.2002). Результаты представлены в виде значений среднего арифметического и стандартной ошибки среднего.
Результаты исследований и их обсуждение
Через 14 суток после выполнения оперативного вмешательства в группе I на гистологических препаратах определялось преимущественно соединительнотканно-хрящевое сращение отломков вертлужной впадины. Площадь соединительной ткани в зоне интермедиарного сращения отломков составляла 38 ± 1,5 %, хрящевой – 45 ± 4,1 %, костной – 17 ± 2,8 %. Новообразованный участок суставной выстилки был сформирован хорошо васкуляризированной рыхлой соединительной тканью. В гиалиновом хряще суставной выстилки отломков и головки бедренной кости сохранялась зональная структура. Бесклеточная зона была разрыхлена, снижена клеточная плотность тангенциальной зоны. Компактная субхондральная пластинка имела остеонное строение, отмечали локальные разрушения линии остеохондрального соединения и инвазию сосудов в кальцифицированную зону хряща без нарушения пограничной линии (tidemark). Гистохимическое исследование выявляло ослабление альцианофилии тангенциальной и переходной зон, более выраженное в головке бедренной кости.
На 42 сутки после выполнения оперативного вмешательства (через 21 сутки после демонтажа аппарата) в группе I сращение отломков вертлужной впадины формировали костная, соединительная и преимущественно хрящевая ткани (рис. 1 а, б). Площадь костной ткани составляла 14 ± 2,4 %, соединительная и хрящевая ткани занимали соответственно 33 ± 3,2 и 53 ± 5,6 %. Высота зоны сращения увеличивалась в результате краевой резорбции остеотомированных поверхностей отломков, их прогрессирующего смещения во фронтальной плоскости. На периостальной поверхности тазовой кости располагались обширные наслоения мелкопетлистого губчатого костного вещества. Гистологическое строение внутрикостных кровеносных сосудов свидетельствовало о декомпенсации нарушений кровоснабжения. Новобразованный участок суставной выстилки в I группе формировала соединительная ткань с высокой клеточной и сосудистой плотностью, врастающая в суставную полость. В гиалиновом хряще суставной выстилки отломков развивались необратимые дистрофические изменения – от разрушения либо узурации тангенциальной зоны до полного замещения гиалинового хряща волокнистой хрящевой или соединительной тканью. В субхондральной костной пластинке обнаруживались трещины, мозаично расположенные очаги резорбции и склерозирования (рис. 1 в). Гиалиновый хрящ суставной выстилки и субхондральная пластинка головки бедренной кости претерпевали однотипные, но менее выраженные дистрофические изменения. В суставной выстилке обеих сочленяющихся поверхностей отмечали общее ослабление альцианофилии, в особенности при рН 2,5 (рис. 1 г, д).
а)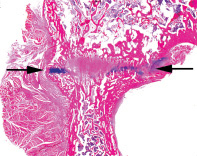 б)
б)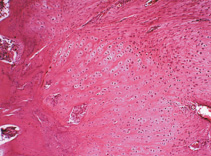 в)
в) г)
г) д
д
Рис. 1. Гистологическое строение вертлужной впадины при лечении её перелома в условиях внешней фиксации и интраартикулярного введения физиологического раствора: а – фиброзно-хрящевое сращение отломков (зона сращения указана стрелками); б – волокнистая хрящевая и соединительная ткани зоны сращения; в, г, д – гиалиновый хрящ и субхондральная костная пластинка отломков. Парафиновые срезы. а, б, в – окраска гематоксилином и эозином; г – окрашивание альциановым синим при рН 1,0; д – окрашивание альциановым синим при рН 2,5. А – сканограмма гистологического препарата; б-д – оцифрованные изображения полей зрения, об. 10×. Срок эксперимента – 42 суток после операции, 21 сутки после демонтажа аппарата
В группе II через 14 суток после выполнения оперативного вмешательства в трех экспериментальных случаях формировалось костное сращение отломков, образованное губчатым костным веществом. В одном случае сращение было костно-соединительнотканно-хрящевым, площадь костной ткани в зоне сращения составляла 61 ± 0,5 %, соединительной ткани – 36 ± 1,8 %, хрящевой ткани – лишь 3 ± 1,9 %. В губчатом веществе отломков отмечали активный эндостальный и периостальный остеогенез. Строение внутрикостных микрососудов отражало изменения, типичные для стадии посттравматического отека и затруднения венозного оттока крови. Зональное строение гиалинового хряща суставных поверхностей сохранялось во всех экспериментальных случаях. При этом в части полей зрения наблюдали разрыхление либо отсутствие бесклеточного слоя, незначительное очаговое ослабление альцианофилии бесклеточного слоя и верхней порции тангенциальной зоны при рН 1,0 и рН 2,5. Других отличий от структуры хряща интактных животных не было выявлено. Через 42 суток после операции (21 сутки после демонтажа аппарата) в группе II в трех экспериментальных случаях наблюдали периостальное и интермедиарное сращение отломков, образованное губчатым костным веществом (площадь костной ткани в зоне сращения – 100 %) (рис. 2 а, б). У одного животного были сформированы компактная и субхондральная костные пластинки. В одном экспериментальном наблюдении сращение перелома было костно-соединительнотканно-хрящевым, соотношение площадей костной, соединительной и хрящевой тканей составляло 58 ± 1,4; 18 ± 6,9 и 24 ± 8,4 % соответственно. Грубоволокнистые костные трабекулы подвергались перестройке и компактизации. Регенерат имел зональное строение – к остеотомированным поверхностям отломков примыкали костные отделы, образованные сетью грубоволокнистых трабекул; между ними располагался волокнистый хрящ с прослойками васкуляризированной рыхлой соединительной либо костной ткани.
Новообразованный участок суставной поверхности в трех опытах II группы был сформирован гиалиновым хрящом, в одном – слабо васкуляризированной соединительной тканью. В гиалиновом хряще суставной выстилки отломков и головки бедренной кости сохранялась зональная структура. Отмечали утолщение бесклеточной пластинки, снижение клеточной плотности тангенциальной зоны. Строение прочих зон не имело выраженных отличий от интактной нормы (рис. 2 в). Гистохимическое исследование выявляло неравномерное снижение интенсивности окрашивания тангенциальной и радиальной зон при рН 1,0. При рН 2,5 альцианофилия снижалась более значительно и так же неравномерно (рис. 2 г, д).
а)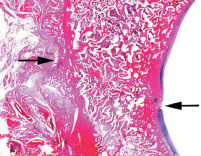 б)
б) 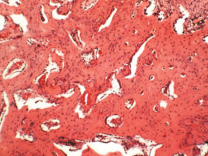 в)
в)  г)
г)  д)
д) 
Рис. 2. Гистологическое строение вертлужной впадины при лечении её перелома в условиях внешней фиксации и интраартикулярного введения смеси растворов лекарственных веществ: а – костное сращение отломков (зона сращения указана стрелками); б – губчатая костная ткань зоны сращения; в, г, д – гиалиновый хрящ и субхондральная костная пластинка отломков. Парафиновые срезы; а, б, в – окраска гематоксилином и эозином; г – окрашивание альциановым синим при рН 1,0; д – окрашивание альциановым синим при рН 2,5; а – сканограмма гистологического препарата; б-д – оцифрованные изображения полей зрения, об. 10×. Срок эксперимента – 42 суток после операции, 21 сутки после демонтажа аппарата
Заключение
В результате проведенных исследований продемонстрировано положительное влияние интраарикулярного введения смеси аскорбиновой кислоты, глюкозы и плазмы крови с целью создания оптимальных условий для репаративного остеогенеза при лечении внутрисуставного перелома тазовой кости. Морофологически доказана возможность сокращения периода фиксации отломков и снижения выраженности дистрофических изменений в гиалиновом хряще суставной выстилки. Полученный эффект, по-видимому, обусловлен очищением суставной полости от токсических продуктов распада тканей благодаря ее капельному дренированию при сохранении в межотломковом пространстве фибринового сгустка и находящихся в нем малодифференцированных клеток, что является необходимым условием начальной стадии репаративного процесса [12]. Интраартикулярное введение метаболических активных веществ – аскорбиновой кислоты и глюкозы – обеспечивает активизацию клеточного дыхания и энергетические потребности клеток зоны сращения, инактивацию токсических продуктов перекисного окисления [2, 7].
Рецензенты:
Краснов В.В., д.б.н., ведущий научный сотрудник научной клинико-экспериментальной лаборатории патологии осевого скелета и нейрохирургии ФГБУ «РНЦ ВТО» имени акад. Г.А. Илизарова Минздрава России», г. Курган;
Лунева С.Н., д.б.н., профессор, руководитель клинико-экспериментального лабораторного отдела ФГБУ «РНЦ ВТО» имени акад. Г.А. Илизарова Минздрава России», г. Курган.
Работа поступила в редакцию 10.01.2013.
Библиографическая ссылка
Силантьева Т.А. МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ЗАЖИВЛЕНИЯ АЦЕТАБУЛЯРНОГО ПЕРЕЛОМА В УСЛОВИЯХ ЧРЕСКОСТНОГО ОСТЕОСИНТЕЗА И СТИМУЛЯЦИИ ИНТРААРТИКУЛЯРНЫМ ВВЕДЕНИЕМ ПРЕПАРАТОВ МЕТАБОЛИЧЕСКОГО ДЕЙСТВИЯ // Фундаментальные исследования. 2013. № 1-3. С. 590-594;URL: https://fundamental-research.ru/ru/article/view?id=30991 (дата обращения: 30.12.2025).



