Лечение инфекционных заболеваний, вызываемых вирусами, остается трудно разрешимой проблемой практической терапии. Для молекулярного изучения протеома клеток, в том числе подвергшихся действию вирусной инфекции, активно используются протеомные и фосфопротеомные технологии, благодаря которым становится возможным оценить статус сигнального пути клетки и идентифицировать сигнальные белки, задействованные в ответе на любую вирусную инфекцию вне зависимости от таксономической принадлежности вируса. Такие белки являются наиболее перспективной клеточной мишенью для разработки средств антивирусной терапии, однако для проведения анализа методами протеомики и фосфопротеомики необходима отработка методик предобработки клеточных гомогенатов, применяемых для данного анализа [4, 3].
Как известно, N- и О-связанные олигосахариды являются основными структурными компонентами многих белков, при этом разнообразие олигосахаридных структур, а именно изменение структуры и разная степень насыщенности сайтов гликозилирования в гликопротеине, вносят свой вклад в неоднородность по массе, что обуславливает существенные трудности при анализе белков с использованием различных протеомных и фосфопротеомных методов. Поскольку О-связанные олигосахариды обычно меньше по массе, чем N-связанные гликаны, но при этом являются более многочисленными и более гетерогенными по структуре, подготовка биологического материала к протеомному и фосфопротеомному анализу должна включать дегликозилирование О-гликопротеинов.
Целью настоящей работы явилась разработка метода дегликозилирования гликопротеинов с последующим введением ковалентной метки и визуализацией паттерна первично негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате для проведения протеомного и фосфопротеомного анализа с использованием J-агрегатов.
Материалы и методы исследования
Приготовление лизата клеток, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 или вариантом М, полученным из штамма ЭК-328
Суспензию клеток почки эмбриона свиньи СПЭВ после заражения штаммом вируса клещевого энцефалита ЭК-328 или вариантом М штамма ЭК-328 и обработки тщательно перемешивали на ротаторе и отбирали аликвоты следующего объема:
При титре 1:512 – 0,25 мл.
При титре 1:256 – 0,5 мл.
При титре 1:128 – 1 мл.
К клеточным суспензиям в среде DMEM добавляли 100 мг стеклянных шариков диаметром 0,8 мм, 10 мкл на мл коктейля ингибиторов протеолиза «Halt Protease Inhibitor Cocktail» («Thermo Fisher Scientific Inc.», США) и подвергали интенсивной обработке на встряхивателе ВП1-2: 10 серий по 30 с для каждого препарата, поддерживая температуру препарата около 0 °С путем инкубации на ледяной бане. Затем к суспензиям добавляли детергент Triton X-100 до конечной концентрации 1 % и инкубировали на льду при периодическом встряхивании в течение 3 часов. Суспензии декантировали, осветляли посредством центрифугирования при 2000 g в течение 30 мин и замораживали в жидком азоте для дальнейшего использования.
Предобработка клеточных гомогенатов: проведение О-дегликозилирования гликопротеинов по механизму β-элиминирования с последующей ковалентной модификацией дегликозилированных белков цианиновым красителем JC-1
В качестве буферного раствора для клеточного гомогената использовали буферный раствор со слабощелочным pH 7,2 на основе 100 мМ Tris-HCl с добавлением 100 мМ NaCl. Образец объемом 400 мл предварительно концентрировали на ячейке для тангенциальной ультрафильтрации («Amicon», США). Первичный концентрат диализовали против буферного раствора Tris-HCl 100 мМ, NaCl 100 мМ в течение суток при + 4°С. Для дальнейшей работы использовали 3 фракции первого пика. К фракции первого пика вирусного материала объемом 0,5 мл добавляли 0,5 мл 0,1 М раствора NaOH и 38 мг NaBH4. Смесь тщательно перемешивали, нагревали 16 часов при + 45 °С, после этого к смеси добавляли 10 мкл∙10–4 М цианинового красителя JC-1, растворенного в бинарном растворе ацетон–Tris-HCl (С = 0,05 М, pH = 8,5), и инкубировали 15 мин при комнатной температуре. После завершения инкубации вирусный препарат подвергали окончательной очистке методом катионообменной хроматографии на Sepharose 6 Fast Flow при pH 7,2.
Анализ белков из первичного и предобработанного препаратов вирусного гомогената с помощью 2D-электрофореза
Для изучения белкового состава препаратов, полученных до и после проведения О-дегликозилирования гликопротеинов по механизму β-элиминирования с последующим мечением дегликозилированных белков цианиновым красителем JC-1, использовали 2D-электрофорез по О’Фареллу. Для визуализации белков пластины ПААГ окрашивали азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit» в соответствии с инструкцией производителя («Thermo Fisher Scientific Inc.», США). Гель-документацию полученных двумерных электрофореграмм проводили методом сканирования на сканере «Epson expression 1680» или с помощью цифровой фотокамеры Panasonic Lumix DMC-GF2C.
Идентификация паттерна негликозилированных и дегликозилированных белков из очищенного предобработанного гомогената клеток, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 или вариантом М, полученным из штамма ЭК-328
Для однозначной идентификации паттерна изначально негликозилированных и дегликозилированных белков из предобработанного препарата вирусного гомогената после проведения электрофоретического анализа всех белков и окрашивания геля азотнокислым серебром проводили вторичное окрашивание модифицированных красителем дегликозилированных гликопротеинов. Для этого окрашенную азотнокислым серебром пластину ПААГ помещали в камеру для горизонтального электрофореза multiSUB MAXI («Cleaver Scientific Ltd», Великобритания), добавляли 1200 мл 10–5 М цианинового красителя JC-1 в бинарном растворе ацетон–Tris-HCl (С = 0,05 М, pH = 8,5), содержащем также предварительно растворенный ПАВ цетилпиридиний бромид в концентрации 10–3 М. После завершения инкубации раствор для окрашивания сливали, гель промывали охлажденным до +4 °С раствором PBS и документировали формирование молекулярных цепочек J-агрегатов на базе ковалентно-модифицированных красителем дегликозилированных гликопротеинов с помощью трансиллюминатора синего цвета со светофильтром янтарного цвета Safe ImagerTM 2.0 («Life Technologies», США) или UVIblue («Uvitec Cambridge», Великобритания) и цифровой фотокамеры Panasonic Lumix DMC-GF2C в темной комнате.
Результаты исследования и их обсуждение
На основе метода О-дегликозилирования гликопротеинов по механизму β-элиминирования [4, 3] был разработан и оптимизирован способ идентификации паттерна первично негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате посредством ковалентного связывания дегликозилированных гликопротеинов с цианиновым красителем JC-1 [1], электрофильное присоединение которого, как и в случае с DTT и BAP, происходит по двойной связи [4]. Структурная формула красителя JC-1, используемого в качестве ковалентной метки и базиса для образования J-агрегатов, а также постадийная схема проведения дегликозилирования белков с введением ковалентной модификации и визуализацией паттерна негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате с использованием J-агрегатов, приведены на рис. 1 и 2 соответственно.
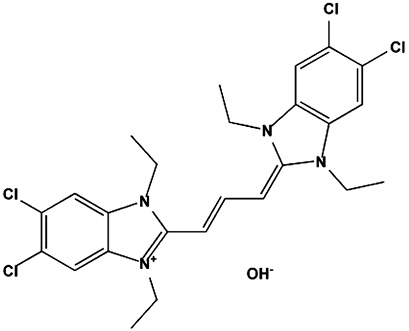
Рис. 1. Структурная формула красителя JC-1, используемого в качестве ковалентной метки и как базиса для образования J-агрегатов
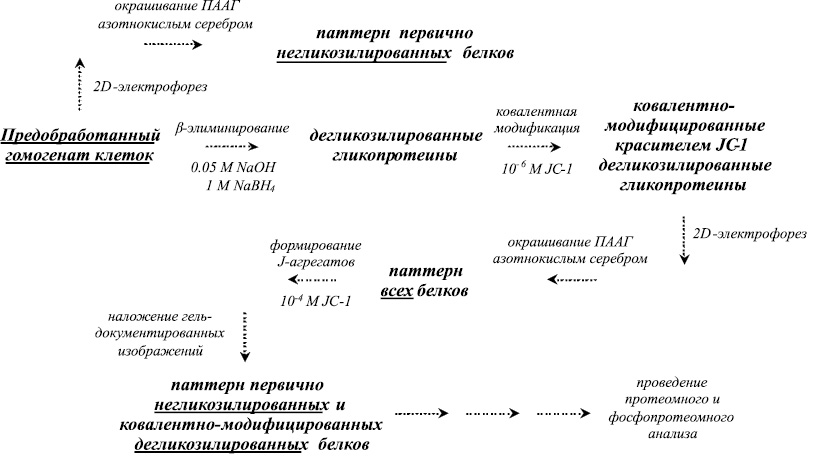
Рис. 2. Постадийная схема преобработки гомогенатов клеток, зараженных модельными штаммами вирусов посредством проведения дегликозилирования гликопротеинов с последующим введением ковалентной метки и визуализацией паттерна негликозилированных и дегликозилированных белков в предобработанном клеточном гомогенате с использованием J-агрегатов
До и после проведения дегликозилирования гликопротеинов по механизму β-элиминирования с ковалентной модификацией и мечением дегликозилированных белков цианиновым красителем JC-1 проводился 2D-электрофорез по О’Фареллу с последующей визуализацией паттерна изначально негликозилированных и модифицированных красителем дегликозилированных белков посредством окрашивания гелей азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit» фирмы Thermo Fisher Scientific Inc., США. Далее осуществлялось наложение гель-документированных изображений, полученных после проведения электрофоретического анализа паттерна первично негликозилированных белков (рис. 3 (1,4)) и паттерна всех белков (рис. 3 (2,5)), что позволяло определить возможный паттерн изначально негликозилированных и ковалентно-модифицированных дегликозилированных белков без возможности подтверждения или опровержения артефактности проявившихся на пластине ПААГ полос, предположительно соответствующих именно дегликозилированным гликопротеинам.
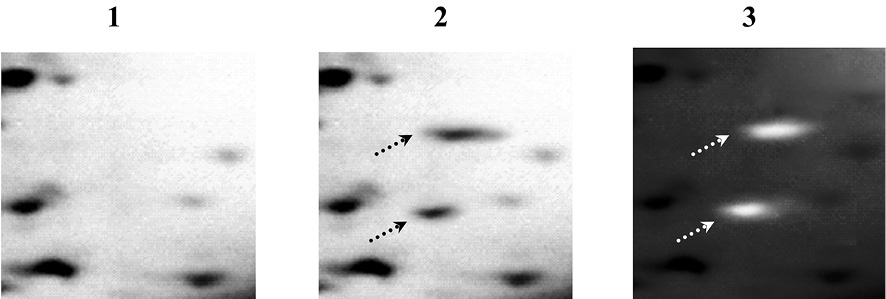
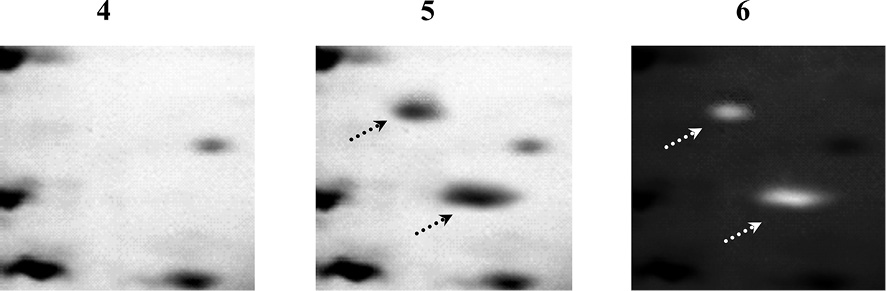
Рис. 3. Электрофоретический анализ паттерна негликозилированных и дегликозилированных белков в гомогенате клеток СПЭВ, зараженных модельным штаммом вируса клещевого энцефалита ЭК-328 (1–3) или вариантом М штамма ЭК-328 (4–6): до проведения дегликозилирования гликопротеинов (1,4), после дегликозилирования и ковалентной модификации гликопротеинов красителем JC-1 без обработки пластины ПААГ (2,5) и с обработкой раствором цианинового красителя JC-1 с образованием упорядоченных молекулярных цепочек J-агрегатов (3,6). Белки разделены методом 2D-электрофореза по О’Фареллу и окрашены на общий белок азотнокислым серебром с использованием набора «PageSilver™ Silver Staining Kit». Стрелками указаны полосы, соответствующие дегликозилированным гликопротеинам
После идентификации паттерна всех белков посредством оценки гель-документированных изображений двумерных электрофореграмм методом сканирования на сканере Epson expression 1680 или с помощью цифровой фотокамеры Panasonic Lumix DMC-GF2C с целью подтверждения проявления на пластине ПААГ полос, соответствующих именно дегликозилированным гликопротеинам, гель помещался в горизонтальную электрофорезную камеру и проводилось окрашивание первично меченых дегликозилированных белков посредством добавления цианинового красителя JC-1 в высокой концентрации с образованием упорядоченных молекулярных цепочек J-агрегатов. Ковалентная модификация дегликозилированных белков может быть осуществлена с использованием других цианиновых красителей, в том числе окса- и тиацианиновых красителей [2, 5], способных к образованию полимолекулярных J-агрегатов. В свою очередь повторная идентификация с использованием трансиллюминатора синего цвета со светофильтром янтарного цвета Safe ImagerTM 2.0 («Life Technologies», США) или UVIblue («Uvitec Cambridge», Великобритания) и цифровой фотокамеры Panasonic Lumix DMC-GF2C в темной комнате с последующим наложением гель-документированных изображений, полученных после проведения электрофоретического анализа паттерна первично негликозилированных белков (рис. 3 (1,4)) и паттерна всех белков (рис. 3 (2,5)) после окрашивания геля азотнокислым серебром, а также паттерна модифицированных красителем дегликозилированных гликопротеинов после вторичного окрашивания (рис. 3 (3,6)), которое приводит к образованию J-агрегатов, позволяет однозначно определить паттерн изначально негликозилированных и ковалентно-модифицированных дегликозилированных белков.
Заключение
Таким образом, в настоящей работе предложен удобный и простой способ определения паттерна изначально негликозилированных белков и ковалентно-модифицированных дегликозилированных белков с использованием J-агрегатов, что делает данный метод оптимальным для использования при подготовке биологического материала к протеомному и фосфопротеомному анализу. Настоящая работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», Государственный контракт от 14 февраля 2011 г. № 16.512.11.2060.
Рецензенты:
Фаизов Т.Х., д.б.н., заведующий лабораторией молекулярно-генетического анализа ФГУ «Федеральный центр токсикологической и радиологической безопасности животных», г. Казань;
Морозов И.А., д.м.н., профессор, заместитель директора по научной работе Института полиомиелита и вирусных энцефалитов имени М.П. Чумакова Российской академии медицинских наук (ИПВЭ им. М.П. Чумакова РАМН), Московская обл., Ленинский р-н., поселок сельского типа Институт полиомиелита.
Работа поступила в редакцию 26.11.2012.
Библиографическая ссылка
Шибаева А.В., Шибаева А.В., Смирнова М.С., Маракасова Е.С., Маракасова Е.С., Кудыкина Ю.К., Леонович О.А., Казеева Т.Н., Елагина Е.М., Лебедева А.А., Кузнецова Т.В., Кузнецова Т.В., Зарипова Р.С., Савилова А.М., Шевелев А.Б. Новый метод подготовки биологического материала к проведению протеомного и фосфопротеомного анализа // Фундаментальные исследования. 2013. № 1-1. С. 51-55;URL: https://fundamental-research.ru/ru/article/view?id=30872 (дата обращения: 15.02.2026).



