Длительное применение (начиная с 1959 года) метронидазола в качестве противопротозойного препарата при лечении урогенитального трихомониаза привело к формированию устойчивых форм Trichomonas vaginalis. Опубликованы сообщения о более чем 100 резистентных к метронидазолу штаммах из США, порядка 20 - описаны европейскими учёными [6, 13]. До сих пор неясны механизмы развития резистентности простейшего к метронидазолу. Согласно мнению некоторых авторов [1, 10, 11, 12], лекарственная устойчивость Tr. vaginalis может быть обусловлена в первую очередь снижением активности пируват-ферродоксин-оксиредуктазы микробной клетки, что приводит к снижению накопления цитотоксических нитро-радикальных ионных интермедиатов. Другие исследователи этого феномена утверждают, что резистентность может быть связана с нарушением транспортных систем клетки, включая феномен выброса, либо с тем, что в состав микробиоценоза половых органов могут входить микроорганизмы, способные захватывать нитрогруппы и тем самым снижать активность метронидазола и его аналогов [5, 6, 8, 9].
Наши экспериментальные исследования позволяют предположить о существенной роли цитоплазматической мембраны (ЦПМ) простейшего в формировании популяции резистентных штаммов Trichomonas vaginalis. Адаптивные изменения ЦПМ являются проявлениями наследуемой модификационной изменчивости [2, 3, 4, 7].
Целью наших исследований было изучение формирования резистентности Trichomonas vaginalis к метронидазолу.
Поставленная цель требовала решения следующих задач:
1. Выделение и изучение in vitro предположительно резистентных форм Trichomonas vaginalis в клинических изолятах, полученных от неизлеченных больных.
2. Получение устойчивых к метронидазолу штаммов Trichomonas vaginalis при длительном проточном культивировании.
3. Изучение роли цитоплазматической мембраны простейшего в формировании лекарственной устойчивости.
4. Выявление модификационного характера резистентности урогенитальной трихомонады к метронидазолу.
Материалы и методы исследования
Исходя из поставленной цели и соответствующих задач, нами были проведены две серии опытов на проточной культуре урогенитальной трихомонады в период с 2009 по 2011 г. главным образом на базе ЛКЦ г. Саратова. Проточное культивирование осуществлялось на ферментёре собственной конструкции, проходящей в настоящее время процедуру патентования.
Для первой серии опытов инокулят для культивирования брался от двух групп пациентов мужского пола (всего 32 человека), в возрасте наибольшей сексуальной активности (18-39 лет): 1 группа - пациенты с низкой комплаентностью, наблюдающиеся у специалиста (26 человек); 2 группа - заболевание, не поддающееся лечению длительное время (6 человек). У больных имели место различные клинические проявления, согласно которым им в разное время ставился диагноз «Урогенитальный трихомониаз» (А 59.0 по МКБ-Х). Предположительно, именно такие категории больных либо заражены резистентными формами Trichomonas vaginalis, либо сами создают условия для образования таких штаммов. Инокуляционная доза составляла 500 кл/мл.
В ходе данной серии опытов нами было осуществлено длительное культивирование паразита, результатом которого стало получение чистых культур Tr.vaginalis. Впоследствии каждая из 32 культур была подвержена действию трихомонацидных концентраций метронидазола и тинидазола. Используемые концентрации (метронидазол 2,0 мкг/мл; тинидазол 1,0 мкг/мл) были получены методом серийных разведений. Исходная концентрация препаратов составляла 1:1000, а каждая последующая в 2 раза ниже, чем предыдущая. Длительность культивирования в первой серии опытов зависела от группы пациентов и составляла от 7 до 21 суток.
Для второй серии опытов инокулят брался у пациентов так же мужского пола (18 человек), ранее не получавших лечение противопротозойными препаратами, обратившихся в лечебное учреждение впервые, и которым на основании клинических и лабораторных исследований был поставлен диагноз «Урогенитальный трихомониаз» (А 59.0 по МКБ-Х). Инокуляционная доза в этой серии опытов так же, как и в первой составляла 500 кл/мл.
Культивирование во второй серии опытов с материалом, полученным от нелеченных пациентов, проводилось, как с пересевом на стационарную среду при культивировании сроком до 21 суток, так и без пересева при непрерывном культивировании 60 суток. В этой серии опытов половина культур, выбранных произвольно, подвергалась воздействию вышеописанной концентрации метронидазола, а другая половина подвергалась комплексному воздействию и препарата, и ЭМИ. Облучение культур производилось на 7-е, 11-е, 13-е и 21-е сутки. В качестве источника лазерного излучения использовался физио- терапевтический прибор - «Узор-А-2К», СВЧ-излуче- ния - аппарат «Луч-4». Интенсивность, длина волны, а также экспозиция были одинаковы во всех сериях опытов и в целом соответствовали таковым при физиотерапевтических процедурах.
Для диагностической оценки результатов изолированного и комплексного воздействия экзогенных факторов на жизнедеятельность простейших, выявления резистентных к метронидазолу изолятов Trichomonas vaginalis были использованы методы микроскопирования, культивирования в диагностической среде «Vagicult», полимеразной цепной реакции. Кроме того, нами была произведена оценка изменения барьерных функций мембран, заключающаяся в измерении утечки УФ-поглощающих веществ до и после обработки ЭМИ облучением. Измерение утечки УФ-поглощающих веществ проводили путем определения оптической плотности супернатанта, при 260 нм в 1 см кювете на спектрофотометре СФ-2000. В качестве УФ-поглощающего агента использовали оксид железа III (Fe3O3). Контролем служил супернатант культур, не подвергавшихся действию ЭМИ.
Результаты исследования и их обсуждение
В ходе проведения первой серии опытов мы наблюдали элиминацию паразита при воздействии на него противопротозойными препаратами, согласно схемам лечения рекомендаций СDC от 2006 г. Полученные результаты отображены в диаграмме.
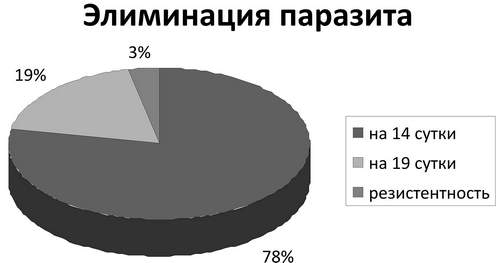
При концентрации метронидазола 2,0 мкг/мл гибель Tr.vaginalis происходила на 14 сутки в изолятах от двадцати одного пациента 1-й группы и четырёх пациентов 2-й группы, что составило 78 % от всех культур. В оставшихся изолятах наблюдали умеренный рост простейшего. Эти штаммы были подвергнуты действию тинидазола в концентрации, равной 1,0 мкг/мл в течение 5 суток, после чего наблюдали элиминацию паразита на 19 день опыта в изолятах, взятых у пяти больных из 1-й группы и одного больного из 2-й группы соответственно, составляющих в целом 19 % от всех культур. В одном изоляте (3 % от всех культур) от одного пациента 2-й группы наблюдали продолжение роста и жизнедеятельности, несмотря на проводимую противопротозойную терапию, что может свидетельствовать о развитии резистентности простейшего в данной культуре. Эксперимент был завершён на 30 сутки.
Во второй серии опытов при воздействии только метронидазолом на изоляты, полученные от половины пациентов, наблюдалось экспотенциальное снижение количества клеток простейшего на выходе из ферментёра с дальнейшей тотальной элиминацией на 14-17 сутки культивации. При комплексном воздействии метронидазола и ЭМИ на оставшиеся изоляты наблюдались следующие явления. На 7-е сутки культивирования в условиях комплексной обработки происходило значительное увеличение клеток простейшего в отделяемой из ферментёра культуральной жидкости (до 2,6 млн/мл, при контроле - 430-600 тыс. клеток/мл). На 14-17 сутки непрерывного культивирования наблюдалось снижение количества клеток трихомонад до 150-210 тыс. в мл. На 21 сутки в отделяемом из ферментёра клетки простейшего не определялись, но выявлялись паразиты из субстратов носителей ферментёра в количестве 300-380 клеток на мл. Они имели округлую форму и размеры 8-10 мкм. Пересев этих штаммов на стационарную среду давал рост трихомонад, устойчивых к метронидазолу. Дальнейшая культивация данных штаммов Tr.vaginalis в условиях проточного культивирования при отсутствии экзогенных лекарственных и ЭМИ воздействий на 40-60 сутки приводила к возвращению чувствительности паразита к 5-НИ.
В опытах на полученных нами резистентных штаммах трихомонад по измерению утечки УФ-поглощающего вещества (Fe2O3) было установлено, что в супернатанте концентрация этого соединения была выше, чем в культурах с нерезистентными штаммами, что свидетельствовало об усилении барьерной функции мембран клеток простейшего и уменьшении диффузии оксида железа в цитоплазму. Общеизвестно, что ЭМИ изменяют вязкость липидной компоненты мембран, энергетическую активность мембран, которые принимают активное участие во всех функциях организма. Под действием лазерного и КВЧ излучений изменяется форма билипидного слоя клеточных мембран, что приводит к переориентации головок липидов и, как следствие, уменьшению диффузной проницаемости. Перечисленные процессы могут лежать в основе феномена наследуемой модификационной изменчивости, приводящей к временной резистентности трихомонад к 5-НИ [2, 4].
Выводы
1. Низкая комплаентность пациентов и хронические формы трихомониаза не являются достоверной причиной формирования резистентности урогенитальной трихомонады к 5-НИ.
2. Проведение опытов на практически стерильной среде в виде монокультуры позволяет подтвердить выводы ряда авторов о «непричастности» сопутствующей в обычных условиях in vivo микрофлоры в формировании устойчивости трихомонад к метронидазолу и его производным.
3. Комплексное воздействие 5-НИ и ЭМИ при длительном проточном культивировании позволяет создать условия для формирования устойчивых к 5-НИ форм Trichomonas vaginalis.
4. У резистеных штаммов наблюдали увеличение барьерных функций цитоплазматических мембран, что говорило о роли ЦПМ в формировании резистентности к 5-НИ.
5. Выявленная резистенность носила временный характер, что говорит о принадлежности её к наследуемой модификационной изменчивости, характерной для простейших.
Библиографическая ссылка
Горчаков Д.А., Луцевич И.Н., Софьина А.В., Софьин В.С. ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ TRICHOMONAS VAGINALIS КАК ПРОЯВЛЕНИЕ НАСЛЕДУЕМОЙ МОДИФИКАЦИОННОЙ ИЗМЕНЧИВОСТИ У ПРОСТЕЙШИХ // Фундаментальные исследования. 2012. № 12-1. С. 40-43;URL: https://fundamental-research.ru/ru/article/view?id=30758 (дата обращения: 28.02.2026).



