Симпатическая нервная система и нейротрансмиттер норадреналин (НА) играют важную роль в процессе липолиза триглицеридов белой жировой ткани [1]. Взаимодействие норадреналина с ?-адренорецепторами приводит к активации Gs-белков, аденилатциклазы, увеличению уровня сАМР и активации протеинкиназы А (PKA). Фосфорилирование протеинкиназой А гормон-чувствительной липазы и перилипина инициирует липолиз [5]. На клетках бурого жира показано, что активация β-адренорецепторов может вызывать рост не только сАМР, но и Са 2+ [4]. Механизмы β-адренорецептор-зависимого повышения [Ca 2+ ]i в адипоцитах белой жировой ткани неизвестны. В данной работе на первичной культуре белых адипоцитов мышей предполагалось установить участие β-адренорецепторов и их подтипов в формировании Са 2+ -сигнала, пути передачи этих сигналов, участие Са 2 + каналов эндоплазматического ретикулума.
Материалы и методы исследования
В экспериментах использовали первичную культуру белых адипоцитов мыши на 9 день культивирования (9 DIV), полученную из мезенхимальной фракции стволовых клеток эпидидимального жирового депо в соответствии с общепринятой методикой [8]. Измерение динамики цитозольного кальция ([Ca 2+ ]i) проводили с помощью системы анализа изображений «Cell observer» (Carl Zeiss, Германия) на базе моторизованного микроскопа Axiovert 200M с высокоскоростной черно-белой CCD-камерой AxioCam HSm. Источником света служила ртутная лампа НВО 100. Возбуждение флуоресценции Fura-2 проводили при двух длинах волн (340 и 387 нм) с использованием запирающих светофильтров BP 340/30 и BP 387/15, регистрация в области (465–555) нм (светофильтр эмиссии ВР 510/90). Для формирования изображения использовали объектив Plan Neofluar 20×/0.3. В эксперименте получали серии изображений культуры с интервалом 3 сек. Для обработки серий изображений использовали программу Image J 1.44). Клетки загружали кальций-чувствительным зондом Fura-2 (Molecular probes, USA) в сбалансированном солевом растворе Хэнкса (HBSS), содержащем 10 мМ HEPES, pH 7,4 при 37 °С в течение 40 мин с последующей отмывкой от красителя в течение 15 мин. Построение графиков осуществляли помощью программы Origin-8. Результаты, представленные в работе, получены на 4-х клеточных культурах с 5-ю повторами для каждой культуры.
Результаты исследования и их обсуждение
Ранее нами было показано на культуре белых адипоцитов, что норадреналин (НА) в физиологических концентрациях вызывает 3 типа кальциевых ответов у белых адипоцитов. Поскольку НА взаимодействует с α1-, α2- и β-адренорецепторами адипоцитов белого жира, то для выделения Са2+ -ответа, инициируемого β-адренорецепторами, эксперименты были проведены в присутствии ингибитора ?1- и ?2-адренорецепторов – фентоламина (рис. 1). Как следует из рисунка, Са2+ -ответ начинается после лаг-периода и представляет собой медленное увеличение цитозольного кальция.
Похожие Са 2 + -ответы были зарегистрированы под действием изопротеренола (агонист β1, β2, β3-адренорецепторов), и BRL (агонист β3-адренорецепторов) (рис. 2). Максимальная амплитуда увеличения [Ca2+]i наблюдалась при аппликации агониста β3-адренорецепторов, что согласуется с данными о том, что β3-адренорецепторы селективно экспрессированы в зрелых адипоцитах [7]. Следует отметить, что изменения [Ca2+]i под действием каждого из трех агонистов обычно развивается медленный двухфазный ответ.
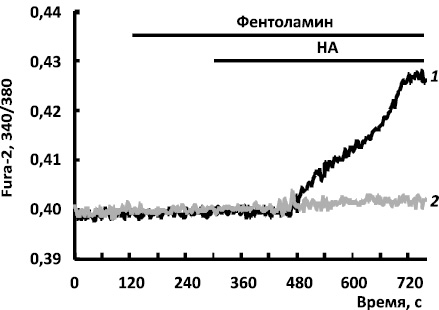
Рис. 1. Изменение [Ca2 + ]i в адипоцитах белого жира при активации ?-адренорецепторов норадреналином (НА)на фоне антагониста ?1,2-адренорецепторов – фентоламина
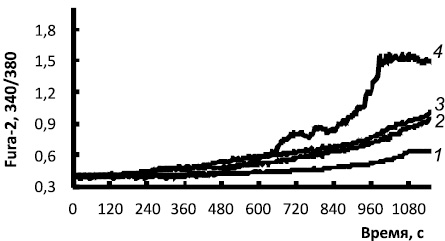
Рис. 2. Увеличение [Ca2 + ]i в дифференцированных белых адипоцитах при активации ?-адренорецепторов и протеинкиназы А. Активация ?-адренорецепторов селективными агонистами – изопротеренол (?1,2,3, кривая 1), BRL-37344 (?3, кривая 2), аденилатциклазы (форсколин, кривая 3) и протеинкиназы А (8-Bromo-cAMP, кривая 4) ? приводит к медленному увеличению [Ca2+]i
Для доказательства специфичности Ca2+ -ответа были использованы селективные ингибиторы β-адренорецепторов пропраналол и α1-, α2-адренорецепторов фентоламин. Как следует из табл. 1, пропраналол полностью подавлял Са2+ -ответ под действием изопротеренола, а фентоламин не оказывал влияния на этот ответ.
Для определения источника увеличения Са2+ были проведены эксперименты с ингибиторами различных Са2+ -транспортирующих систем (каналов). В табл. 1 показано, что в присутствии ксестоспонгина (ингибитора IP3-рецепторов) происходит подавление амплитуды Са2+-ответа на 84 %. Таким образом, повышение Са2+ является следствием активации IP3-рецепторов. Известно, что для целого ряда невозбудимых клеток мобилизация Са2+ является IP3- и Са2+ -зависимой, а активность IP3R регулируется фосфорилированием различными протеинкиназ.
Таблица 1
Изменение [Са2+]i под действием 3 µM изопротеренола и антагонистов рецепторов
|
Мишени |
Антагонисты мишеней |
Эффект |
|
β-адренорецепторы |
Пропранолол, 3 µM |
Подавление [Са2+ ]I на 100 % |
|
α1-,α2-адренорецепторы |
Фентоламин, 5 µM |
Нет эффекта |
|
IP3-рецепторы |
Ксестоспонгин, 0,5µM |
Подавление амплитуды [Са2+ ] i на 84 % |
В последующих экспериментах мы показали, что Са 2+ -ответ, инициированный активацией β-адренергических рецепторов, сопряжен с активацией аденилатциклазной системы. Активация b-адренорецепторов адипоцитов приводит к опосредованной G-белками стимуляции аденилатциклазы и к образованию вторичного мессенджера – сАМР. Эти события можно имитировать либо добавлением форсколина – непосредственного активатора аденилатциклазы, либо добавлением к клеткам проникающего через плазматическую мембрану аналога сАМР – 8-Br-cAMP. Соединение 8-Br-cAMP является более резистентным к действию фосфодиэстераз, чем сАМР и активирует РКА.
Как следует из рис. 2, медленное увеличение внутриклеточного кальция происходит также при активации аденилатциклазы и протеинкиназы А с помощью проникающего аналога сАМР. Таким образом, воздействия, влияющие на увеличение в клетке сАМР, также вызывают повышение [Ca2+]i . Основной мишенью сАМР в клетках является ПКА. Добавление к клеткам ингибитора протеинкиназы А Н-89 подавляло Ca2+ -ответы под действием сАМР (табл. 2), что указывает на участие этого фермента в повышении [Ca2+]i под действием сАМР в адипоцитах белого жира. Для ряда клеток показано, что протеинкиназа А фосфорилирует IP3- и рианодиновые рецепторы энодлазматического ретикулума, и это приводит к увеличению активности Са2+ -каналов этих рецепторов [6]. Как следует из табл. 2, ингибитор IP3-рецепторов подавлял амплитуду Са2+ сигнала на 83 %, а ингибитор рианодиновых рецепторов полностью подавлял Са2+ сигнал у 20 % клеток.
Таблица 2
Изменение [Ca2+]i под действием 5 µM 8-Br-cAMP и ингибиторов
|
Мишени |
Антагонисты мишеней |
Эффект |
|
Протеинкиназа А |
H-89, 200 нМ |
Подавление[Ca2+]I на 100 % |
|
IP3R |
Ксестоспонгин C, 0,5 µM |
Подавление амплитуды [Ca2+]i на 83 % |
|
Рианодиновые рецепторы (RyR) |
Рианодин, 1 µM |
Подавление [Ca2+]I полное у 20 % клеток |
Адипоциты белой жировой ткани играют главную роль в поддержании энергетического гомеостаза организма при голодании и физической нагрузке за счет липолиза запасенных триглицеридов. Процесс липолиза активируется адреналином и норадреналином через β-адренорецепторы, аденилатциклазу, сАМР, РКА и фосфорилирование гормончувствительной липазы и перилипина [5]. Мишенями протеинкиназы А являются и Са2+ -транспортирующие системы клетки, такие как Са2+ -каналы эндо/саркоплазматического ретикулума и плазматической мембраны и Са2+ -АТРазы [6]. Ранее было показано, что активация β-адренорецепторов клеток бурого жира вызывает увеличение [Ca2+]i [3]. В данной работе показано, что агонисты β-адренорецепторов, активатор аденилатциклазы форсколин или проникающий негидролизуемый аналог сАМР – 8-Br-cAMP вызывают медленное (по сравнению с Са2+ -ответами на агонисты α-адренорецепторов) повышение [Са2+]. В генерации этого Са2+ -сигнала участвуют не только протеинкиназы А, Са2+ -каналы IP3R- и RyR-рецепторов, но и Са2+ -каналы плазматической мембраны (неопубликованные данные). Эти факты свидетельствуют в пользу того, что один агонист (НА), активируя α- и β-рецепторы, создает условия для конвергенции таких сигнальных путей, регулирующих уровни cAMP, cGMP и Ca2+, как аденилатциклазный и фосфоинозитидный [8].
Заключение
Представленный в данной работе медленный Са2+ -сигнал, по-видимому, необходим клеткам для повышения базового уровня кальция, который влияет на частоту и амплитуду Са2+ -ответов на множество гормонов и трансмиттеров, сопряженных с активацией Са2+ -систем сигнализации. В таких параметрах, как частота и амплитуда, закодирована сигнальная информация, передаваемая в ядро на экспрессию специфических генов [2].
Работа выполнена при финансовой поддержке: ФНМ – 01201258223; ГК 16.512.11.2092 – 01201179771; ФНМ – 01201256033; РФФИ № 10-04-01306.
Библиографическая ссылка
Туровский Е.А., Туровская М.В., Толмачева А.В., Долгачева Л.П., Зинченко В.П., Дынник В.В. β-АДРЕНОРЕЦЕПТОРЫ КАК РЕГУЛЯТОРЫ ВНУТРИКЛЕТОЧНОГО КАЛЬЦИЯ В АДИПОЦИТАХ БЕЛОГО ЖИРА // Фундаментальные исследования. 2012. № 11-5. С. 1059-1062;URL: https://fundamental-research.ru/ru/article/view?id=30706 (дата обращения: 04.02.2026).



