Фагоцитирующие клетки крови – гетерогенная популяция, опосредующая антиинфекционную резистентность в рамках естественного иммунитета (гранулоциты) и адаптивного иммунитета (процессинг и представление антигенов моноцитами) [4]. Накоплено много данных об участии моноцитов и гранулоцитов в развитии соматических заболеваний, например, ишемической болезни сердца и атеросклероза, а также в формировании злокачественных образований [5, 6, 7]. Кроме того, фагоциты генерируют активные формы кислорода (АФК) и в случае нарушения своих функций становятся источником повреждения и гибели клеток [8]. В связи с этим поиск соединений, способных модулировать функциональную активность фагоцитов, является актуальной проблемой современной медицинской науки и практики.
Цель настоящей работы – исследовать влияние биназы (РНКазы Bacillus intermedius) на E. coli- и форболмиристатацетат-зависимую генерацию АФК в моноцитах и гранулоцитах крови человека. Выбор объекта исследования обусловлен тем, что ранее нами было показано, что биназа в зависимости от концентрации оказывает дифференцированное действие на функциональную активность перитонеальных макрофагов крысы [2].
Материалы и методы исследований
РНКаза Bacillus intermedius (биназа) – катионный белок с молекулярной массой 12,3 кДа, изоэлектрической точкой pI 8,9 и максимальной каталитической активностью при рН 8,5. В работе использовали гомогенный препарат РНКазы, полученный по методу [1].
Генерацию АФК в моноцитах и гранулоцитах измеряли методом проточной цитометрии с использованием тест-набора Phagoburst® (OPREGEN Pharma, Germany) по инструкции производителя. Для индукции АФК применяли лиофильно высушенную опсонизированную культуру бактерий E. coli и форбол-12-миристат-13-ацетат (ФМА). Внутриклеточную продукцию АФК регистрировали при окраске дигидрородамином 123 (DHR123).
Выделение суспензии лейкоцитов периферической крови
Лейкоциты выделяли из венозной крови здоровых доноров-добровольцев, от которых было получено информированное согласие. Протокол исследования одобрен этическим комитетом ГАУЗ РКБ-2 МЗ РТ. Гепаринизированную венозную кровь отстаивали в течение 30 минут при 37 °С, отбирали слой сыворотки с лейкоцитами и отмывали клетки центрифугированием (200 g, 10 мин). Полученный осадок лейкоцитов ресуспензировали в фосфатно-солевом буфере (pH 7,4) до конечной концентрации 106 клеток/мл и раскапывали по 250 мкл в пробирки для проточной цитометрии (Falcon 352054, BD).
Детекция АФК в тесте Phagoburst®
В опытные пробы вносили раствор биназы в фосфатно-солевом буфере (конечная концентрация 400 и 40 мкг/мл) и 20 мкл рабочего раствора DHR123 по инструкции производителя. DHR123 под действием АФК превращался в родамин 123 (Rh123), флуоресценцию которого регистрировали на проточном цитофлуориметре FACSCalibur (Becton Dickinson, USA), оснащенном двумя лазерами с длиной волны 488 и 635 нм. В качестве положительного контроля использовали образец, стимулированный ФМА (10–7 М). На каждый вариант опыта просчитывали не менее 25000 клеточных событий. Моноцитарный и гранулоцитарный гейты определяли по параметрам светорассеяния. Измерения проводили в программе CellQuest Pro (BD Biosciences), статистический анализ полученных результатов выполняли по критерию Колмогорова-Смирнова и критерию χ2 с коррекцией Yates в пакете прикладных программ Statistica 6,0.
Результаты исследований и их обсуждение
Согласно схеме, принятой нами ранее, эксперименты проводились с двумя концентрациями биназы: 40 мкг/мл (Bi-40) – нетоксичная и 400 мкг/мл (Bi-400) – токсичная [3]. Полученные результаты представлены в таблице. В качестве индуктора АФК наряду с E. сoli мы использовали ФМА, который инициирует кислородный взрыв без адгезии и поглощения патогена.
Влияние биназы на индукцию АФК в моноцитах и гранулоцитах
|
Образец |
Моноциты |
Гранулоциты |
||
|
Доля АФК-генерирующих клеток, % |
Геометрическое среднее генерации АФК/клетку, усл. ед. |
Доля АФК-генерирующих клеток, % |
Геометрическое среднее генерации АФК/клетку, усл. ед. |
|
|
Клетки интактные |
3,29 |
8,54 |
0,05 |
24,10 |
|
Клетки + Bi-40 |
2,87 |
8,03 |
0,16 |
31,10 |
|
Клетки + Bi-400 |
5,84 |
11,31 |
0,36 |
32,20 |
|
Клетки + E. coli |
25,88A |
8,83 |
42,49B |
44,50B |
|
Клетки + Bi-40 + E. coli |
25,62A |
8,72 |
51,43B, C |
46,10B, C |
|
Клетки + Bi-400 + E. coli |
17,83A |
7,87 |
55,18B, C |
71,00B, C |
|
Клетки + ФMA |
74,43A |
14,60A |
97,98B |
131,00B |
|
Клетки + Bi-40 + ФМА |
68,78A |
14,61A |
98,05B |
151,20B |
|
Клетки + Bi-400 + ФМА |
65,92A |
12,10A |
97,99B |
113,40B |
Примечания:
A – P < 0.01 по сравнению с контролем (интактные моноциты);
B – P < 0.001 по сравнению с контролем (интактные гранулоциты);
C – P < 0.01 по сравнению с гранулоциты + E. Coli.
Моноциты: ФМА и E. сoli стимулируют генерацию АФК в моноцитах. Биназа в обеих концентрациях достоверно не влияет на базальную продукцию АФК. В моноцитах, in vitro стимулированных E. сoli, биназа в исследованных концентрациях не увеличивает долю АФК-продуцирующих клеток и не меняет интенсивность продукции АФК/клетку (таблица). В моноцитах, стимулированных ФMA in vitro, биназа также достоверно не модифицирует генерацию АФК.
Гранулоциты: ФМА и E. сoli стимулируют генерацию АФК в гранулоцитах. Биназа в обеих концентрациях достоверно не влияет на базальную продукцию АФК. В условиях окислительного взрыва, стимулированного E. coli, биназа концентрационно зависимо увеличивает долю клеток, продуцирующих активные формы кислорода, на 21 и 30 % (P < 0,01, (см. таблицу). У гранулоцитов, стимулированных E. coli, снижается интенсивность прямого светорассеяния, что указывает на уменьшение диаметра клеток (рисунок). Биназа не модифицирует изменение диаметра гранулоцитов, вызванное E. coli (данные не показаны). Таким образом, биназа, per se не увеличивая долю спонтанно АФК-генерирующих гранулоцитов, меняет физиологическое состояние последних, заставляя их откликаться на стимуляцию E. coli количественным (процент АФК-генерирующих клеток) и качественным (интенсивность генерации АФК/клетку) приростом продукции кислородных радикалов (см. таблицу).
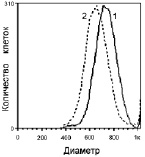
Изменение диаметра гранулоцитов:1 – интактные клетки, диаметр = 734 усл. ед.; 2 – клетки, стимулированные E. coli, диаметр = 658 усл. ед. (P < 0,01, критерий Колмогорова‒Смирнова)
В гранулоцитах человека, in vitro стимулированных ФMA, биназа не меняет долю клеток, продуцирующих активные формы кислорода. Но при этом наблюдается тенденция к разнонаправленному концентрационно зависимому действию биназы на интенсивность продукции АФК на клетку (см. таблицу).
Выполненные исследования показали, что биназа избирательно и различным образом действует на E. coli – и ФМА-зависимый окислительный взрыв в гранулоцитах и не влияет на эти процессы в моноцитах. Характер ответа гранулоцита зависит от концентрации биназы и от от используемого индуктора. Если опсонизированные E. coli активируют фагоциты через Fc-рецепторы, то действие ФМА опосредовано только протеинкиназой С (ПКС). Форболовые эфиры (в том числе ФМА) легко проникают в клетку и, имея структурное сходство с диацилглицерином, взаимодействуют с его участком связывания на молекуле ПКС. Далее активированная ПКС осуществляет фосфорилирование НАДФН-оксидазы, которая в свою очередь инициирует продукцию активных форм кислорода (респираторный взрыв) [9]. Таким образом, в гранулоцитах биназа модулирует генерацию АФК как на мембранном (индуктор E. coli), так и на внутриклеточном (индуктор ФМА) уровне.
Заключение
Полученные результаты демонстрируют избирательность действия биназы на клетки крови человека и обосновывают дальнейшее изучение биназы в качестве модулятора индукции АФК в фагоцитах.
Рецензенты:
Ишмухаметова Д.Г., д.б.н., профессор кафедры биохимии Института фундаментальной медицины и биологии ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань;
Медянцева Э.П., д.х.н., зав. лабораторией иммунохимических методов анализа, профессор кафедры аналитической химии Химического института им. А.М. Бутлерова ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань.
Работа поступила в редакцию 07.11.2012.
Библиографическая ссылка
Миронов В.А., Ширшиков Ф.В., Калачева Н.В., Черепнев Г.В. ВЛИЯНИЕ БИНАЗЫ НА ИНДУКЦИЮ АКТИВНЫХ ФОРМ КИСЛОРОДА В ГРАНУЛОЦИТАХ И МОНОЦИТАХ ВЕНОЗНОЙ КРОВИ ЧЕЛОВЕКА // Фундаментальные исследования. 2012. № 11-4. С. 855-857;URL: https://fundamental-research.ru/ru/article/view?id=30668 (дата обращения: 18.12.2025).



