Известно, что кратковременные эпизоды гипоксии защищают нейроны от гибели при глобальной гипоксии и ишемии. При этом кратковременные эпизоды гипоксии подавляют увеличение концентрации Са2+ в цитозоле ([Ca2+]i), вызванное последующей глобальной ишемией [9]. Однако, наряду с защитным эффектом, кратковременные эпизоды гипоксии часто вызывают симптомы постгипоксической гипервозбудимости, которая, как известно, является фактором, приводящим к гибели клеток [10].
Увеличение концентрации внутриклеточного кальция при действии глутамата может вызывать широкий спектр реакций нейронов, начиная с нормальной синаптической нейропластичности и регуляции возбудимости нервных клеток до формирования нейротоксических эффектов, приводящих к апоптозу. Продолжительный вход Са2+ в цитозоль через активированные глутаматом рецепторы-каналы и потенциал-управляемые кальциевые каналы представляет собой ключевой фактор гибели нейронов при гипоксии и ишемии [6].
Цель данного исследования состоит в определении механизма формирования постгипоксической гипервозбудимости нейронов гиппокампа, а также роли внутриклеточного кальциевого депо в формировании постгипоксического спонтанного кальциевого импульса (s[Ca2+]i).
Материалы и методы исследования
В экспериментах использовали смешанную нейроглиальную культуру клеток гиппокампа крысы, выделенную из мозга новорожденных (2–4 дня) крыс породы Spraque Dawley в соответствии с общепринятой методикой [1]. Исследовали влияние кратковременных эпизодов гипоксии на амплитуду кальциевого ответа нейронов гиппокампа при аппликации агониста NMDA-рецепторов – N-methyl-d-aspartate в безмагниевой среде. Концентрацию цитозольного кальция измеряли с помощью флуоресцентного зонда Fura-2. Уровень цитозольного кальция в клетках, нагруженных кальциевым зондом, регистрировали с помощью системы анализа изображений «Cell observer» (Carl Zeiss, Германия), на базе моторизованного микроскопа Axiovert 200M. В эксперименте использовали культуру гиппокампа 8-10 DIV. Измерения проводили при температуре 28 °С. Для подачи веществ использовали систему, позволяющую производить добавки агонистов и антагонистов рецепторов при полной смене среды. Для создания гипоксии в ячейку с клетками подавали среду (солевой раствор Хенкса с 20 мМ HEPES), из которой предварительно в течение 20 минут вытеснялся кислород с помощью продувки аргоном, при этом воздушная часть ячейки также была заполнена аргоном.
Эксперимент состоял из 3-кратковременных эпизодов гипоксии по 3 минуты, каждый из которых сменялся 10-минутной реоксигенацией. Аппликация NMDA производилась перед первым эпизодом гипоксии (контроль) и после каждого из трех эпизодов гипоксии-реоксигенации. Время аппликации агонистов составляло 30 секунд с последующей отмывкой агониста 10 мл среды и реоксигенацией в течение 10 минут.
Для построения графиков и статистической обработки использовали программу OriginPro 8.0. В случае кратковременного (транзитного) сигнала амплитуду измеряли по максимальному значению флуоресценции за период аппликации вещества. Ошибка среднего при измерении амплитуд составляла 0,04. Исходный уровень сигнала в клетках обычно составлял 0,23 ± 0,07 (здесь и далее среднее значение ± стандартное отклонение).
Результаты исследования
и их обсуждение
Изменение [Ca2+]i, вызываемое активацией NMDA-рецепторов и кратковременной гипоксией.
Кратковременная аппликация агониста NMDA-рецепторов – N-methyl-d-aspartate в концентрации 10 мкМ в безмагниевой среде вызывает резкое увеличение [Ca2+]i в нейронах гиппокампа. После отмывки NMDA клетки быстро восстанавливают базальный уровень Са2+ в цитозоле. Амплитуды кальциевых ответов (АКО) индивидуальных нейронов различаются, но строго повторяются в каждой клетке при повторных кратковременных добавках NMDA. Эпизоды гипоксии вызывают незначительное увеличение [Ca2+]i в 45 ± 08 % нейронов гиппокампа (не показано). Амплитуда индуцированного гипоксией увеличения Са2+ в цитозоле составила в среднем 0,03 ± 0,01 относительных единиц флуоресценции Fura-2. Возвращение флуоресценции Fura-2
к исходному уровню происходит у всех прореагировавших на гипоксию нейронов в течение 2 минут реоксигенации. Кратковременные эпизоды гипоксии вызывают прогрессирующее уменьшение АКО нейронов гиппокампа на NMDA (рис. 1). Кроме того, после активации NMDA-рецепторов и кратковременных эпизодов гипоксии во время каждого периода реоксигенации наблюдается спонтанное (синхронное) транзитное увеличение Са2+ в цитозоле (s[Ca2+]i)
у 50 % нейронов (см. рис. 1). Подобный эффект никогда не наблюдался во время кратковременных периодов гипоксии без добавления NMDA, а также при активации NMDA-рецепторов без создания условий гипоксии. Амплитуда s[Ca2+]i может увеличиваться от первого эпизода гипоксии к третьему эпизоду, что, вероятно, является симптомом постгипоксической гипервозбудимости нейронов гиппокампа, которое также наблюдается в нейронах срезов гиппокампа после кратковременных эпизодов гипоксии [7].
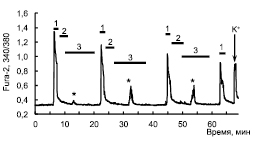
Рис. 1. Изменение [Ca2+]i в нейронах гиппокампа в ответ на аппликацию
NMDA 10 мкМ (1), при действии кратковременных эпизодов гипоксии (2)
и во время периода реоксигенации (3). Аппликация NMDA производилась в среде без магния. Представлен усредненный ответ 52 нейронов. Здесь и далее звездочкой *
отмечена генерация s[Ca2+]i во время периода реоксигенации
Постгипоксический спонтанный Са2+ импульс сохраняется в безкальциевой среде и ингибируется тапсигаргином.
Постгипоксический спонтанный Са2+-импульс наблюдается также во время реоксигенации в безкальциевой среде, при этом амплитуда s[Ca2+]i уменьшается в 2-3 раза (не показано). Как известно, для генерации Са2+ сигналов клетки используют наружный и запасенный во внутриклеточных депо кальций [3]. Эндоплазматический ретикулум (ЭПР) представляет собой основное внутриклеточное депо Са2+ [4]. Появление s[Ca2+]i в нейронах гиппокампа во время реоксигенации в безкальциевой среде свидетельствует об участии внутриклеточного кальциевого пула в механизме постгипоксической гипервозбудимости. Однако уменьшение амплитуды s[Ca2+]i говорит также о существенном вкладе входа кальция снаружи в формирование Са2+ импульса.
Для исследования регуляторной роли ЭПР в генерации постгипоксического кальциевого импульса клетки перед третьей аппликацией NMDA обрабатывали тапсигаргином в различных концентрациях. В концентрации 1мкМ тапсигаргин вызывает быстрое опустошение ЭПР, что сопровождается временным увеличением Са2+ в цитозоле и откачкой его во внеклеточную среду. Такая обработка клеток тапсигаргином не изменяла Са2+ ответ на NMDA, но предотвращала появление s[Ca2+]i. в период реоксигенации (рис. 2).
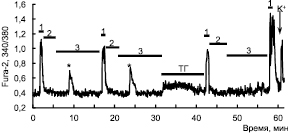
Рис. 2. Действие ингибитора SERCA – тапсигаргина на изменение [Ca2+]i в нейронах гиппокампа в ответ на аппликацию NMDA 10 мкМ (1) во время кратковременных эпизодов гипоксии (2) и периодов реоксигенации (3). Аппликация тапсигаргина (ТГ) в концентрации 1 мкМ подавляет появление s[Ca2+]i в период реоксигенации
Рианодин не влияет на генерацию s[Ca2+]i.
Преинкубирование нейронов гиппокампа с рианодином в течение 10 минут, в концентрации 1 мкМ, после второго периода реоксигенации перед третьей аппликацией NMDA не влияет на возникновение s[Ca2+]i
в период реоксигенации. На рис. 3 показано, что во время двух первых периодов реоксигенации в нейронах наблюдается появление s[Ca2+]i, а после преинкубирования клеток с рианодином амплитуда s[Ca2+]i
даже несколько увеличивается, но в пределах изменений в контроле. Таким образом, рианодиновый рецептор не участвует в формировании постгипоксической гипервозбудимости нейронов гиппокампа.
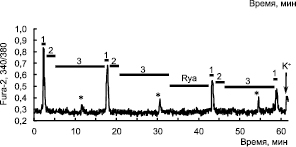
Рис. 3. Действие ингибитора рианодинового рецептора – рианодина ‒ на изменение [Ca2+]i в нейронах гиппокампа в ответ на аппликацию NMDA 10мкМ (1) во время кратковременных эпизодов гипоксии (2) и периодов реоксигенации (3). Аппликация рианодина (Rya) в концентрации
1 мкМ не влияет на появление s[Ca2+]i в период реоксигенации
Постгипоксический кальциевый импульс подавляется ингибитором фосфолипазы С (PLC).
Для исследования вклада IP3-рецепторов в высвобождение Са2+ из ЭПР при генерации s[Ca2+]i использовали один из ингибиторов PLC – U73122 [4]. Концентрации U73122, используемые в данном исследовании, не вызывают проявления неспецифических эффектов. На рис. 4 показано, что преинкубирование нейронов гиппокампа в течение 10 мин с 1–5 мкМ U73122 предотвращает появление s[Ca2+]i в период реоксигенации после активации NMDA-рецепторов и действия кратковременного эпизода гипоксии во всех нейронах. Таким образом, появление s[Ca2+]i в сетевых нейронах гиппокампа в культуре, в период реоксигенации, после активации NMDA-рецепторов и кратковременных эпизодов гипоксии не зависит от активации рианодинового рецептора, а включает высвобождение Са2+ через IP3-рецептор из тапсигаргин-чувствительного пула.
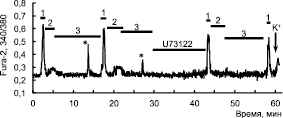
Рис. 4. Действие ингибитора фосфолипазы С – U73122 на изменение [Ca2+]i в нейронах гиппокампа в ответ на аппликацию NMDA 10мкМ (1) во время кратковременных эпизодов гипоксии (2) и периодов реоксигенации (3). Аппликация U73122 в концентрации 1 мкМ подавляет появление s[Ca2+]i в период реоксигенации
Известно, что кратковременные эпизоды аноксии (2–3 минуты) сами могут вызывать Са2+-ответы в нейронах гиппокампа крысы за счет выброса кальция в цитозоль из IP3-чувствительных внутриклеточных депо [2]. Как видно из рис. 4, ингибирование PLC не только препятствует появлению постгипоксического Са2+ импульса, но также подавляет повышение Са2+ в период гипоксии.
Считается, что в условиях гипоксии или кратковременной ишемии головного мозга возбудимость пирамидных нейронов СА1 области гиппокампа возрастает вследствие изменения активности Са2+-зависимых К+-каналов [8], а также активации неселективных катионных каналов, активируемых гиперполяризацией мембраны [5].
Заключение
В настоящей работе показано, что эффект постгипоксической гипервозбудимости возникает в сетевых нейронах гиппокампа в период реоксигенации после кратковременных эпизодов гипоксии и проявляется в возникновении спонтанного, синхронного постгипоксического Са2+-импульса, который происходит за счет активации PLC – IP3 пути мобилизации Са2+ из тапсигаргин-чувствительного пула ЭПР.
Рецензенты:
Асланиди К.Б., д.ф.-м.н., лаборатория регуляции внутриклеточных процессов Институт теоретической и экспериментальной биофизики РАН (ИТЭБ РАН), г. Пущино;
Мошков Д.А., д.б.н., профессор лаборатории ультраструктуры нейрона Института теоретической и экспериментальной биофизики РАН (ИТЭБ РАН), г. Пущино.
Работа поступила в редакцию 09.10.2012.
Библиографическая ссылка
Туровская М.В., Туровский Е.А., Зинченко В.П. РОЛЬ IP3-ЗАВИСИМОЙ МОБИЛИЗАЦИИ КАЛЬЦИЯ В ФОРМИРОВАНИИ ПОСТГИПОКСИЧЕСКОЙ ГИПЕРВОЗБУДИМОСТИ НЕЙРОНОВ ГИППОКАМПА // Фундаментальные исследования. 2012. № 11-2. С. 317-320;URL: https://fundamental-research.ru/ru/article/view?id=30528 (дата обращения: 21.12.2025).



