Нейротрансплантация фетальной и эмбриональной ткани используется в медицине и экспериментальной нейробиологии для восстановления поврежденных нейронов и нарушенных функций мозга [6]. В трансплантированной ткани дифференцируются типичные для донорской структуры нервные и глиальные клетки, отростки которых формируют сложный нейропиль внутри трансплантата и простираются в мозг реципиента. В организацию синаптических связей между нейронами вовлекаются отростки астроцитарных глиальных клеток. Они окружают синаптические комплексы и участвуют в физиологических процессах. На этом основании предложена концепция трехчастного синапса, в состав которого включают не только пре- и постсинаптические компоненты, но и окружающие их астроцитарные отростки [5]. Вместе с тем, вокруг трансплантированного материала может формироваться глиомезодермальный рубец, препятствующий реципрокным взаимодействиям между трансплантатом и мозгом. В этих условиях трансплантированные нейроны образуют функциональные синаптические связи друг с другом и представляют собой источник патологической активности. Удобной экспериментальной моделью для изучения особенностей развития и функционирования изолированной нервной ткани являются интраокулярные трансплантаты. Передняя камера глаза (ПКГ), как и мозг, обладает иммунной привилегированностью, а химический состав ее содержимого аналогичен цереброспинальной жидкости. Питание и иннервацию имплантированная ткань получает из радужной оболочки. Несмотря на дефицит нормальных афферентных источников, в трансплантатах формируется нейропиль, по плотности синаптических контактов не уступающий мозгу in situ
[1, 2]. Большинство этих синапсов принадлежит собственным нервным элементам, что приводит к формированию в части трансплантатов замкнутых морфофункциональных сетей, в которых группы нейронов отвечают на импульсы синхронно [7]. Целью настоящей работы было сравнительное морфометрическое изучение ультраструктурных параметров синаптических окончаний в комплексе с перисинаптическими астроцитарными отростками в трансплантатах септум, характеризующихся нормальной или эпилептиформной активностью.
Материал и методы исследования
Работа выполнена на крысах породы Вистар с соблюдением рекомендаций по гуманному обращению. Все процедуры с животными проводили под нембуталовым или эфирным наркозом. В качестве донорской структуры для трансплантации использовали септальную область мозга, выделенную из плодов крыс 17 дней гестации. Имплантацию в ПКГ производили крысам-самцам путем введения донорской эмбриональной ткани специальным шприцем через разрез в роговице. Через 3 мес. после операции на основании электрофизиологического тестирования трансплантаты разделили на 2 группы: с нормальной активностью (n = 3) и с эпилептиформной активностью (n = 3). В контрольной группе на одиночный электрический стимул нейроны отвечали одиночными разрядами, а в экспериментальной группе – множественными популяционными спайками. Затем трансплантаты фиксировали для гистологического и ультраструктурного анализа. Фиксацию производили 2,5 %-м раствором глутарового альдегида и дофиксацией 1 %-м раствором четырехокиси осмия. Детально процедура трансплантации и подготовки материала описана ранее [1, 2]. Ультраструктурное исследование проводили на электронном микроскопе JEOL JEM-100B. Для морфометрического анализа использовали по 100 микроизображений возбуждающих синаптических окончаний из обеих экспериментальных групп. Изображения отцифровывали, сохраняли в виде компьютерных файлов и анализировали с помощью программы UTHSCSA Image Tool. Сравнение производили по следующим параметрам: размер активной зоны синапсов (по длине постсинаптического уплотнения), периметр пресинаптической терминали (Т), длина астроцитарного отростка, находящегося в контакте с терминалью (А). Степень развития глиального окружения синапса (перисинаптическая глия) вычисляли как отношение параметров А и Т. Схематическое изображение возбуждающего синапса приведено на рис. 1. Достоверность различий определяли по критерию Стьюдента. Статистически значимыми считались различия при p ≤ 0,05.
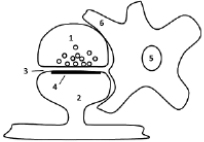
Рис. 1. Схема возбуждающего синаптического окончания в комплексе с перисинаптическим астроцитом (трехчастный синапс):
1 – пресинаптическая терминаль с синаптическими везикулами;
2 – постсинаптический дендритный шипик;
3 ‒ синаптическая щель;
4 – постсинаптическое уплотнение;
5 – ядро астроцита; 6 – перисинаптический астроцитарный отросток
Результаты исследования
и их обсуждение
Трансплантаты септума, развивающиеся в ПКГ в течение 3-х месяцев, представляли собой сферические или овальные образования размером 1–2 мм, располагающиеся между роговицей и радужной оболочкой. Поверхность трансплантатов была покрыта сплошной глиальной оболочкой, которая в некоторых участках была многорядной. В то же время соотношение нервных и глиальных клеток внутри трансплантатов визуально соответствовало нативной цитоархитектонике септальной области мозга. Нейроны располагались диффузно, и большинство из них имело типичную для септума мультиполярную форму (рис. 2).
Электронно-микроскопическое изучение трансплантированной ткани показало, что нейроны представляют собой зрелые дифференцированные элементы, а их дендриты и аксоны активно формируют синаптические взаимодействия. Принципиальных структурных различий как между самими нейронами, так и их многочисленными синаптическими связями в трансплантатах с нормальным или патологическим типом функциональной активности микроскопически не было обнаружено. Возбуждающие синаптические контакты, имеющие асимметричные активные зоны, преимущественно локализовались на дендритных шипиках, а тормозные контакты –
на телах нейронов и стволах дендритов. Нейропильные области трансплантатов представляли собой сложное переплетение нейрональных и глиальных отростков. Астроцитарные отростки, которые располагались вблизи синаптических окончаний, так называемые перисинаптические глиальные отростки, имели нерегулярную форму и окружали синаптические профили по периметру в разной степени. В некоторых синапсах тонкие астроцитарные отростки находились в непосредственной близости от синаптической щели. Главной функцией астроцитарных отростков, окружающих синаптические окончания, является поддержание метаболического, ионного и трансмиттерного гомеостаза вблизи синаптического контакта. Между синапсами и перисинаптической глией существуют двунаправленные взаимодействия [9, 12].
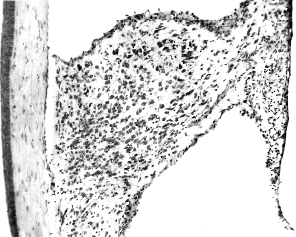
Рис. 2. Общий вид интраокулярного трансплантата септальной области мозга,
развивающегося в течение 3-х месяцев:
1 – роговица; 2 – трансплантат; 3 – радужная оболочка. Масштаб – 100 мкм
Для морфометрического исследования были отобраны синаптические контакты, отвечающие структурным характеристикам возбуждающих синапсов и имеющие выраженные постсинаптические уплотнения (ПСУ). Известно, что размер постсинаптической специализации положительно коррелирует с количеством в них рецепторов и отражает силу синаптической связи [11]. В нашем материале в обеих экспериментальных группах размеры ПСУ сильно варьировались (от 0,1 до 1,28 мкм), что свидетельствует о значительной разнице функциональной силы индивидуальных синапсов. При этом в каждом из них длина ПСУ коррелировала с размером (периметр и площадь) пресинаптического бутона, содержащего синаптические везикулы с нейромедиатором. Однако при сравнении средних значений в трансплантатах с эпилептиформной и нормальной активностью эти параметры достоверно не различались. Не наблюдалось разницы также и по средним значениям площади постсинаптических дендритных шипиков (таблица). Это является показателем того, что каждый синаптический контакт работает в своем индивидуальном режиме и его сила не определяет общую гипервозбудимость нейронов в эпилептическом фокусе. Аналогичные результаты были получены при изучении морфофункциональной корреляции в синапсах неокортекса мышей. Так, в поле бареллов при сенсорной стимуляции вибрисс общая протяженность возбуждающих активных зон не изменялась, хотя происходило значительное увеличение экспрессии транспортеров глутамата [8].
Вместе с тем, наши морфометрические данные показали, что степень астроцитарного окружения пресинаптических бутонов в трансплантатах с эпилептиформной активностью в 2 раза ниже, чем в трансплантатах с нормальной активностью (см. таблицу). Известно, что терминальные разветвления отростков астроцитов очень пластичны и быстро реагируют на изменение нейрональной активности. Контролируя ионный баланс, они очищают перисинаптические пространства от ионов калия, которые в большом количестве освобождаются во время синаптической активности [12]. С помощью мембранных транспортеров они захватывают излишки нейромедиатора из синаптической щели, ограничивая его дальнейшее распространение. Возбуждающий нейромедиатор глутамат в астроцитах деактивируется в глутамин и доставляется обратно в нейроны [9, 12]. Обнаруженное нами ослабление астроцитарного барьера вокруг синапсов в трансплантатах с эпилептиформной активностью позволяет нейромедиаторам более свободно диффундировать из синаптической щели в межклеточные пространства и активировать экстрасинаптические рецепторы и соседние активные зоны. По современным представлениям межклеточные коммуникации в мозге происходят не только при взаимодействии нервных элементов посредством аксональных волокон и синаптических контактов (wiring transmission, проводная нейропередача), но и в результате передачи нейроактивных метаболитов по экстраклеточным пространствам (volum transmission, объемная нейропередача) [4]. Более того, предполагается, что при организации нейрональных ансамблей в мозге беспозвоночных животных преобладает беспроводной, несинаптический способ трансдукции сигналов [3]. Наши результаты показывают, что в эпилептизированной ткани, развивающейся в передней камере глаза, также возрастает роль объемной передачи нейроактивных веществ, что способствует синхронизации нейрональной активности.
Данные морфометрического анализа возбуждающих синапсов в трансплантатах септума с нормальной и эпилептиформной активностью, (M ± m)
|
Структурные параметры синапсов |
Нормальная |
Эпилептиформная активность |
|
Длина ПСУ (мкм) |
0,40 ± 0,02 |
0,39 ± 0,01 |
|
Площадь пресинаптического бутона (мкм²) |
0,48 ± 0,04 |
0,39 ± 0,04 |
|
Периметр пресинаптического бутона (мкм) |
2,09 ± 0,12 |
1,98 ± 0,1 |
|
Степень глиального окружения |
0,44 ± 0,04 |
0,21 ± 0,03 * |
|
Площадь постсинаптического шипика (мкм²) |
0,14 ± 0,2 |
0,15 ± 0,02 |
Примечание. * – Достоверность различий (p ≤ 0,05) между параметрами синапсов в трансплантатах с разной функциональной активностью.
Структурные и функциональные нарушения астроцитов в эпилептическом мозге отмечают и другие исследователи. Обычно гиперактивность и синхронизацию связывают с реактивным астроглиозом, исчезновением доменной организации астроцитов и распространением возбуждающих кальциевых волн по астроцитарным сетям
[10; 12]. Однако молекулярные и клеточные основы эпилептизации чаще изучают на образцах ткани, полученных от животных с экспериментально вызванными судорогами или от больных с резистентной формой болезни после нейрохирургических операций. Морфологические изменения в такой ткани являются результатом регулярных судорожных событий и долговременной антиконвульсантной терапии. При этом нарушения в эпилептическом очаге на уровне синаптических контактов практически не исследованы. Существуют единичные данные о том, что в случаях тяжелой формы височной эпилепсии у людей параллельно с исчезновением нейронов, дендритных шипиков и синапсов разрушается и перисинаптическая глия [13]. В отличие от большинства исследований, констатирующих значительные постсудорожные дегенерационные изменения в мозге, экспериментальная модель, предложенная нами, позволяет изучать начальные эпилептогенные нарушения, происходящие на субмикроскопическом уровне.
Заключение
Микроскопическое и ультраструктурное исследование интраокулярных нейротрансплантатов септума с нормальной и эпилептиформной активностью при визуальной оценке не выявило между ними различий по нейронально-глиальному соотношению и количеству синаптических контактов. Данные морфометрического анализа показали, что размеры активных зон, являющиеся показателем функциональной силы синапсов, в двух экспериментальных группах также не различаются. Вместе с тем, в трансплантатах с патологической активностью было обнаружено значительное уменьшение степени окружения синаптических окончаний астроцитарными отростками. В свете современных представлений о синапсе как трехчастном комплексе, включающем в свой состав также и перисинаптические отростки [5], такая аномалия в организации функциональных контактов в трансплантатах с эпилептиформной активностью приводит к ухудшению обратного захвата возбуждающих нейромедиаторов, их более широкому распространению по экстраклеточным пространствам и гиперсинхронизации нейрональных ответов. Таким образом, нарушение глиально-синаптических взаимодействий, которые возникают при дифференцировке трансплантированной нервной ткани в изоляции от естественных мозговых влияний, является важным эпилептогенным фактором.
Авторы выражают благодарность А.Г. Брагину за выполнение электрофизиологического тестирования нейротрансплантатов. Работа поддержана Российским фондом фундаментальных исследований (грант № 12-04-00812).
Рецензенты:
Куликов А.В., д.б.н., зав. сектором ФГБУН «Институт теоретической и экспериментальной биофизики» РАН, г. Пущино;
Архипов В.И., д.б.н., ведущий научный сотрудник ФГБУН «Институт теоретической и экспериментальной биофизики» РАН, г. Пущино.
Работа поступила в редакцию 10.09.2012.
Библиографическая ссылка
Журавлева З.Н., Журавлев Г.И., Муганцева Е.А. ЭКСПЕРИМЕНТАЛЬНОЕ ИЗУЧЕНИЕ ГЛИАЛЬНО-СИНАПТИЧЕСКИХ ВЗАИМОДЕЙСТВИЙ В ТРАНСПЛАНТИРОВАННОЙ НЕРВНОЙ ТКАНИ // Фундаментальные исследования. 2012. № 11-2. С. 283-287;URL: https://fundamental-research.ru/ru/article/view?id=30521 (дата обращения: 06.01.2026).



