Введение
У птиц колибактериоз представляет собой типичную секундарную инфекцию и часто протекает как конечная стадия других инфекционных заболеваний (Голубева, 1985). Вирулентность штаммов Escherichia coli значительно варьирует при параллельном заражении возбудителями других болезней, такими как вирус инфекционного бурсита, мико-плазмы; необходимая для развития коли-бактериоза заражающая доза в этом случае снижается в 1000 и более раз. Чаще других вызывают колибактериоз у птиц штаммы Е. coli, принадлежащие к серо-вариантам01, 02, 035, 078, 0111. Более 58% эпизоотических штаммов не типируются коммерческими коли-сыворотками отечественного производства (Виноходов, 2003). Вышеизложенное определяет актуальность исследования биологических характеристик штаммов Е. coli, как вызывающих колибактериоз у цыплят производственно значимых кроссов, так и способных формировать протективный иммунитет.
Цель работы состояла в сравнительном анализе свойств различных штаммов Е. coli и оценке их способности продуцировать токсины в условиях in vivo и in vitro.
Материалы и методы
В работе исследовали штаммы Е. coli Б-5 (Волкова, 2006), Е. coli №388 (02) и Е. coli № 389 (078), а также полевой изолят Е. coli №1, выделенный от павшего цыпленка с признаками колибактериоза, по основным морфологическим, тикториальным, культуральным и биохимическим характеристикам с использованием общепринятых методов (Колычев, Госманов, 2006).
Микробиологические исследования включали изучение также антигенного сходства штаммов методами обратной радиальной иммунодиффузии (Фримель, 1987) и твердофазного иммунодота с антителами, меченными коллоидным золотом (Дыкман, 2008), определение характера вырабатываемых клетками штаммов токсинов (Малинин, Тарасенко, 2008). Липополисахарид (ЛПС) выделяли методом водно-фенольной экстракции (Westphal, 1965). Наличие токсинсодержащего материала (ТСМ) в культуральных жидкостях определяли на перитонеальных клетках мыши (ПКМ) с помощью НСТ-теста (Маянский, 1979)
Экспериментальные исследования проведены на 120 цыплятах яйценоского кросса «Родонит-2», которым в возрасте 22 дня вводили однократно перорально бактерии штамма Е. coli Б-5 в дозе 0,5; 1; 2 и 1000 млн. м.к. (соответственно группы 1, 2, 3 и 4). Интактные и иммунизированные цыплята были подвергнуты экспериментальному заражению вирулентными для птиц штаммами Е. coli №1, №388 (02) и № 389 (078). Кровь для исследования забирали из подкрыловой вены. Сыворотку крови получали по общепринятой методике и определяли в ней наличие специфических антител, нейтрализующих токсинсодержащий материал (ТСМ) указанных выше штаммов Е. coli. Статистическую обработку экспериментальных данных проводили по общепринятым методикам (Ашмарин и др., 1987; Лакин, 1990).
Результаты и их обсуждение
В работе были изучены основные характеристики исследуемых штаммов Е. coli. Бактерии вирулентных штаммов Е. coli, как и Е. coli Б-5, соответствовали свойствам типового вида и представляли собой грациликутные палочки длиной 1-4 мкм и толщиной 0,4-0,6 мкм. При росте на мясо-пептонном бульоне бактерии образовывали равномерное помутнение среды с образованием незначительного, легко разбивающегося при встряхивании осадка, на среде Эндо формировали колонии малиново-красного цвета с металлическим блеском, а на среде Левина - колонии темно-фиолетового цвета. Все исследуемые штаммы Е. coli сбраживали лактозу, глюкозу, маннит, дульцит, сахарозу, арабинозу, не сбраживали инозит, не усваивали цитрат натрия, не разжижали желатин, выделяли индол, не восстанавливали серу до сероводорода, давали положительную реакцию с метилротом и отрицательную реакцию Фогес-Проскауэра, восстанавливали нитраты в нитриты, не обладали фенилаланиндезаминазной и цитохромоксидазной активностью.
Для изучения формирования в организме цыплят, иммунизированных клетками штамма Е. coli Б-5 кросс-иммунитета к поверхностным антигенам изученных в работе вирулентных штаммов использовали тест обратной радиальной иммунодиффузии. Результаты теста показали, что для штамма Е. coli № 1 квадрат радиуса зоны преципитации находился в линейной зависимости как от дозы иммунизации, так и от кратности разведения сывороток крови. Это свидетельствует о том, что антитела к штамму Е. coli Б-5 образовывали иммунокомплексы in vitro не только с антигенами этого штамма, но и штамма Е. coli № 1. В то же время для штаммов Е. coli №388 (02) и №389 (078) не было обнаружено зависимости размера зоны преципитации ни от дозы предшествующей иммунизации цыплят, ни от кратности разведения сыворотки крови.
В работе использовали также метод твердофазного дот-блота с антителами, меченными коллоидным золотом. На мембране PVDF адсорбировались антигены - ЛПС и внешняя мембрана указанных штаммов. Установлено, что сыворотки крови цыплят, иммунизированных бактериями штамма Е. coli Б-5, не содержали антител к ЛПС штаммов Е. coli №1, №388 (02) и №389 (078), но имели антитела к ЛПС штамма Е. coli Б-5. Это указывает на то, что бактерицидные свойства сыворотки крови иммунизированных цыплят не были связаны с выработкой специфичных антител к ЛПС вирулентных штаммов. В дот-блоте с внешней мембраной штаммов Е. coli Б-5 и Е. coli №1 было показано образование комплексов антиген-антитело. При этом для штамма Е. coli Б-5 титр сыворотки крови составил 1:1024, а для штамма Е. coli №1 - 1:64. С внешней мембраной штаммов Е. coli №388 (02) и №389 (078) комплексы антигенантитело не образовывались. Это свидетельствовало о том, что во внешней мембране клеток штамма Е. coli №1, в отличие от штаммов Е. coli №388 (02) и №389 (078), есть структуры, взаимодействующие с антителами сыворотки крови цыплят, иммунизированных бактериями штамма Е. coli Б-5.
Была проведена также серия экспериментов по получению ТСМ из культуральных жидкостей вирулентных штаммов Е. coli. Результаты свидетельствовали о том, что ТСМ, угнетающие дыхание перитонеальных клеток мыши, присутствуют в культуральных жидкостях всех исследованных штаммов Е. coli (рис. 1). Определяли наличие в сыворотке крови цыплят специфических антител, нейтрализующих токсины указанных штаммов (см. рис. 1).
Сыворотка крови иммунизированных цыплят кросса «Родонит-2» содержала антитела, в полной мере нейтрализующие термолабильный токсин штамма Е. coli Б-5 и на 60% - ТСМ штамма Е. coli №1. ТСМ штаммов Е. coli №388 (02) и №389 (078) нейтрализовывались сывороткой крови иммунизированных цыплят в меньшей степени. Мы предположили, что токсиннейтрализующая активность сыворотки крови связана с характером токсина. ТСМ всех исследуемых штаммов были проанализированы на наличие термолабильного токсина, аналогичного токсину штамма Е. coli Б-5, по изменению способности тромбоцитов к агрегации. Средний радиус агрегатов в обогащенной тромбоцитами плазме крови при добавлении нативной культуральной жидкости штамма Е. coli №1 увеличивался на 40% по сравнению с действием прогретой культуральной жидкости, что свидетельствовало о термолабильности токсина. В то же время, радиус частиц в обогащенной тромбоцитами плазме крови при добавлении нативной культуральной жидкости штаммов Е. coli №388 (02) и №389 (078) достоверно не изменялся по сравнению с действием культуральной жидкости, прогретой при 56°С. Это указывало на отсутствие в культуральной жидкости данных штаммов термолабильного токсина.
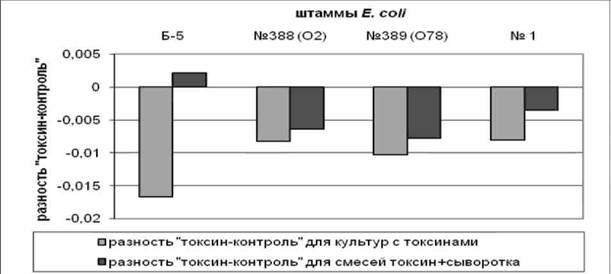
Рис. 1. Разность «токсин-контроль» (мкг формазана на 1 млн. ПКМ) для взвеси ПКМ с
ТСМ вирулентных штаммов и сывороткой крови цыплят, иммунизированных
бактериями штамма Е. coli Б-5 в дозе 1 млрд. м.к.
Заключение
Таким образом, проведенные нами исследования показали, что вирулентными для птиц являются штаммы Е. со И, продуцирующие, прежде всего, токсины: термостабильный (штаммы E.coli №388 (02) и №389 (078) или термолабильный (штамм E.coli №1). При иммунизации цыплят против колибактериоза живыми клетками штамма E.coli Б-5 отмечена бактерицидная активность сыворотки крови в условиях in vitro в отношении клеток всех изученных вирулентных штаммов Е. coli. Установлено, что сыворотка крови иммунизированных цыплят содержала специфические антитела к термолабильному токсину Е. coli Б-5, способные нейтрализовывать также ТСМ штамма Е. coli №1, и специфические антитела к ЛПС штамма Е. coli Б-5, к ЛПС других исследуемых штаммов антител не обнаружено.
СПИСОК ЛИТЕРАТУРЫ:
- Ашмарин И.П., Васильев Н.Н., Амбросов В.А. Быстрые методы статистической обработки и планирование экспериментов. - Л., 1974. - 76 с.
- Виноходов, Д.О., Поляков Н.Л. Биотестирование в птицеводстве и ветеринарии: Введение в биотестирование //Ветеринария в птицеводстве. - 2003. -№5-6.-С. 41-46.
- Волкова М.В. Разработка экспериментальной живой вакцины для профилактики колибактериоза свиней: автореф. дис. канд. биол. наук. - Саратов, 2006. - 24 с.
- Дыкман Л.А. Золотые наночастицы. Синтез, свойства, биомедицинское применение- М.: Наука.-2008.-319 с.
- Колычев Н.М., Госманов Р.Г. Ветеринарная микробиология и иммунология. -М.: КолосС. - 2006. - 432 с.
- Лакин Г.Ф. Биометрия: уч. пособие для биол. спец. ВУЗов - М.:Высш. Школа. - 1990. - 352 с.
- Малинин М.Л., Тарасенко Т.Н. Использование агрегометра для определения бактериальных токсинов / В сб.: «Современное состояние и перспективы развития патологии, морфологии и онкологии животных. Материалы Всерос. науч.-практ. конф. - Новочеркасск. - 2008. -С. 167-170.
- Иммунологические методы /Под ред. Г. Фримеля - М.:Медицина. - 1987. -226 с.
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // J. Immunol. Methods. - 1983. - V. 65. -P. 55-63.
Библиографическая ссылка
Малинин М.Л., Тихомирова Е.И., Габалов К.П. ХАРАКТЕРИСТИКА СВОЙСТВ РАЗЛИЧНЫХ ВИРУЛЕНТНЫХ ДЛЯ ПТИЦ ШТАММОВ ESCHERICHIA COLI И ИХ СПОСОБНОСТИ ПРОДУЦИРОВАТЬ ТОКСИНЫ // Фундаментальные исследования. 2009. № 4. С. 34-38;URL: https://fundamental-research.ru/ru/article/view?id=2709 (дата обращения: 09.01.2026).



