Данная работа является продолжением исследований по более приемлемому подходу к оценке ионной силы раствора полиэлектролита, являющейся немаловажным фактором, влияющим на ионную составляющую раствора и термодинамическую константу диссоциации по известному уравнению (закону разбавления) Оствальда.
Как отмечалось в предыдущих работах [1-3], концептуальный подход к оценке ионной силы раствора электролита заключается в полном учете концентраций всех равновесных частиц в титруемой системе. Обычно для сложных систем, к которым относится полиэлектролит, традиционно применялась концентрация только первого диссоциированного иона полиэлектролита [4-6], несмотря на присутствие двух- и многозарядных ионов.
Наиболее полный учет концентраций всех частиц возможен при представлении логарифмических диаграмм «lg C - lg aH+», где C представляет концентрации всех ионов в растворе; aH+ - активность сольватированного в любом растворителе протона (активность ионов лиония) [1-3].
Существующие методы расчета и определения констант диссоциации, предложенные Спикменом [4, 5], позднее Бейтсом [6], ограничиваются двухосновными кислотами и справедливы лишь для водных растворов.
Рассмотрим диссоциацию трехосновной кислоты и соответствующие константы диссоциации в упрощенном виде (без учета различных комплексов или сольватированных частиц, которые реально существуют в растворах):
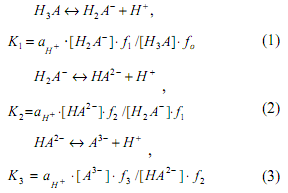
Равновесные концентрации всех частиц
[H3A],[H2A-,[HA2- ],[A3- ] ,
образующихся при титровании многоосновной кислоты, могут быть определены на диаграммах «lg aH+ - lg C» [1-3, 7]. Оценка значения коэффициентов активности f0, f1, f2, f3 проводится по уравнению Дэвиса [8]
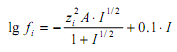
где A = 1.8246 × 106 / (ε T)3/2 = 1.6363,
I - ионная сила раствора, определяемая поизвестному уравнению:
![]()
Для определения активностей ионов лиония ан+ и последующего расчета термодинамических констант диссоциации предварительно устанавливают концентрационную зависимость ЭДС цепи (I) и ее стандартный потенциал E0 электрохимической цепи без переноса [9]
Cтеклянный электрод / НСl / AgCl, Ag (I)
В табл. 1 приведены данные измерения ЭДС цепи (I) в среде диметилформамида (ДМФ) в зависимости от моляльной концентрации хлороводородной кислоты, а также результаты оценки степени ее диссоциации и исходные величины для расчета стандартного потенциала цепи.
ЭДС цепи (I) описывается уравнением Нернста
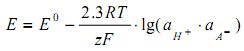 (5)
(5)
где ![]() ¯ - активность сольватированного аниона (хлорид-иона).
¯ - активность сольватированного аниона (хлорид-иона).
В уравнение (5) введем константу диссоциации кислоты
![]() (6)
(6)
и получим следующее уравнение:
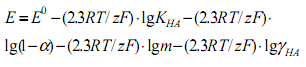 (7)
(7)
Здесь: a и γHA - степень диссоциации и коэффициент активности хлороводородной кислоты в растворе.
Если принять
![]() , то
, то
уравнение (7) может быть трансформировано в следующее:
Eизм =E0*-θ lg(1 - α) - θ lg m - θ × lg γHA
Величину E0* определяют по линейной регрессии при lg m = 0 (компьютерная программа «Расчет нормального потенциала цепи без переноса Е*» [7]), получена величина 0.3473 В (коэффициент регрессии r = 0.9880).
Степень диссоциации хлороводородной кислоты может быть оценена по уравнению (8) при допущении, что коэффициент активности нейтральной молекулы HCl в разбавленных растворах равен нулю:
Таблица 1. Данные для расчета стандартного потенциала цепи (I)
|
m(HCl) |
Eизм,В |
α |
0.059· lg(α·m) |
(α·m)1/2 |
E" |
|
0.12897 |
0.307 |
0.3865 |
0.07684 |
0.2233 |
0.3838 |
|
0.064484 |
0.295 |
0.5120 |
0.08740 |
0.1817 |
0.3824 |
|
0.032242 |
0.282 |
0.5964 |
0.10124 |
0.1387 |
0.3832 |
|
0.016121 |
0.270 |
0.6789 |
0.11568 |
0.1046 |
0.3857 |
|
0.0080605 |
0.258 |
0.7446 |
0.13108 |
0.0775 |
0.3891 |
|
0.0040302 |
0.244 |
0.7805 |
0.14763 |
0.0561 |
0.3916 |
|
0.0020151 |
0.226 |
0.7797 |
0.16542 |
0.0396 |
0.3914 |
![]()
Стандартный потенциал цепи (I), полученный по данным табл.1 (последние столбцы), рассчитан по программе «Расчет параболической функции y = a0× xn + a1× xn-1 + ... + an для определения стандартных потенциалов Е 0 (стандартных ЭДС) электрохимических цепей» [7] и равен Ео = 0.3928 В.
Лимонная кислота титруется гуанидином в среде ДМФ с образованием двух скачков (рис. 1): 1-й скачок соответствует нейтрализации первой карбоксильной группы, 2-й - совместной нейтрализации второй и третьей карбоксильных групп кислоты [10].
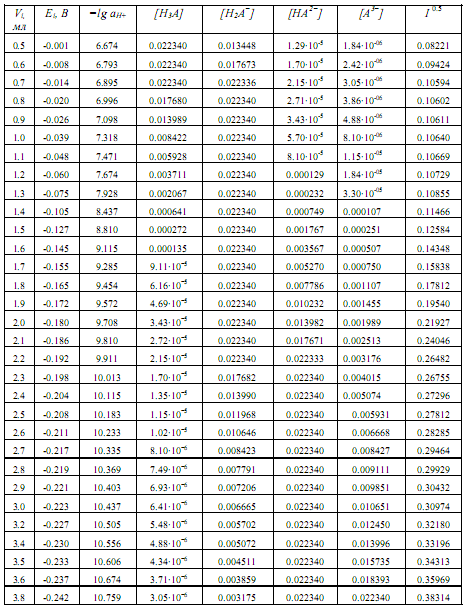
Рассмотрим пример определения термо-динамических констант диссоциации трехосновной (лимонной) кислоты в среде ДМФ. В табл.2 приведена часть данных потенциометрического титрования 0.073125 н. раствора лимонной кислоты 0.11207 н. раствором гуанидина в ДМФ (Vi мл титранта, Еизм, В), активности лионий-ионов (lg aH+) в процессе титрования, равновесные концентрации всех частиц ([H3A], [H2A-], [HA2-], [A3-]) в титруемой системе, определяемые по рис.2, ионная сила и коэффициенты активности ионов по ур. (4).
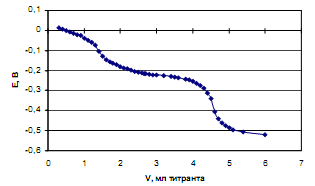
Рис. 1. Кривая потенциометрического титрования 0.073125 н. раствора лимонной кислоты 0.11207 н. раствором гуанидина в ДМФ
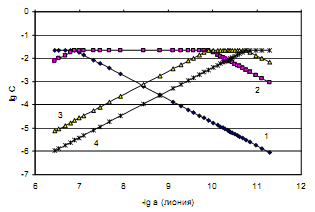
Рис. 2. Логарифмическая диаграмма lg aH+- lg C. 1 - [H3А], 2 - [H2A-], 3 - [HA2-], 4 - [A3-]
Таблица 2. Данные для оценки термодинамических констант диссоциации лимонной кислоты в ДМФ
Продолжение таблицы 2.
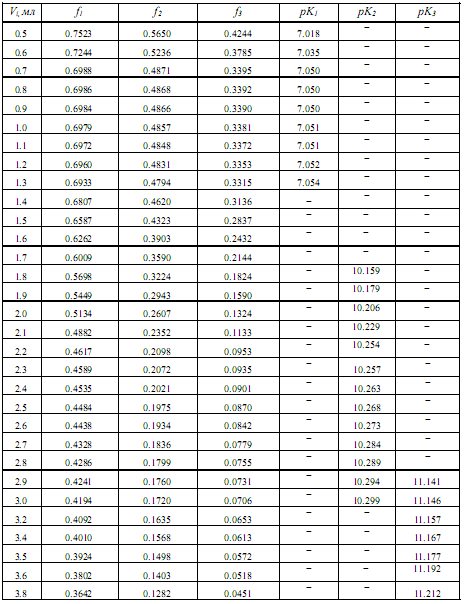
В последних колонках табл. 2 представлены коэффициенты активности по уравнению Дэвиса, показатели последовательных констант диссоциации лимонной кислоты (pK1, pK 2, pK3) с учетом коэффициентов активности ионов по Дэвису в среде ДМФ и их статистически обработанные по авторской программе «Математическая обработка результатов количественных определений» [7] величины: pK1 = 7.04 ± 0.04; pK2 = 10.25 ± 0.09; pK3 = 11.17 ± 0.05.
Таким образом, разработана концепция теоретической оценки и экспериментального определения термодинамических констант диссоциации полиосновных кислот в среде органических растворителей при раздельной нейтрализации первой и второй - третьей кислотных групп трехосновных кислот.
СПИСОК ЛИТЕРАТУРЫ:
- Танганов Б.Б., Алексеева И.А. Кислотно-основные равновесия в растворах поликислот (модель и эксперимент). I. Термодинамические константы диссоциации двухосновных кислот // Журнал общей химии.-2005.-Вып.11.-С.1775-1778.
- Танганов Б.Б., Алексеева И.А. Определение термодинамических констант диссоциации ароматических дикарбоновых кислот в апротонных растворителях // Вестник ВСГТУ.- 2005.-Вып.3.-С.5-10.
- Танганов Б.Б. Кислотно-основные равновесия в растворах поликислот (модель и эксперимент).II. Термодинамические константы диссоциации трехосновных кислот// Журнал общей химии РАН. - 2007.-Т.77.-Вып.8- С.1238-1242.
- Speakman J.C. //J.Chem.Soc.-1940.-P.855-858.
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. -М.,Л.: Химия, 1964. -262с.
- Бейтс Р. Определение рН. Теория и практика. -Л.: Химия, 1972. - 400 с..
- Танганов Б.Б. Основы химии индивидуальных частиц и электролитов. -Улан-Удэ: Изд-во Бурятского госунивер-ситета, 2005.- 223 с.
- Davies C.W. // J. Chem.Soc. 1938. P.2093-2095.
- Александров В.В., Лебедь В.И., Шихова Т.М., Заславский Б.Г. Температурная зависимость термодинамических характеристик сольватации фторида натрия в этиловом спирте // Электрохимия.-1968.-. Т.4.- №6.- С.711-715.
- Танганов Б.Б. Взаимодействия в растворах электролитов: моделирование сольватационных процессов, равновесий в растворах полиэлектролитов и математическое прогнозирование свойств химических систем: монография. - М.: Изд-во РАЕ, 2009. - 140 с.
Библиографическая ссылка
Танганов Б.Б. РАЗРАБОТКА МОДЕЛИ ТЕОРЕТИЧЕСКОЙ ОЦЕНКИ И ЭКСПЕРИМЕНТАЛЬНОГО ОПРЕДЕЛЕНИЯ ТЕРМОДИНАМИЧЕСКИХ КОНСТАНТ ДИССОЦИАЦИИ ТРЕХОСНОВНЫХ КИСЛОТ В ДИПОЛЯРНЫХ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ // Фундаментальные исследования. 2009. № 4. С. 23-28;URL: https://fundamental-research.ru/ru/article/view?id=2706 (дата обращения: 07.01.2026).



