Расслаивающиеся системы без органического растворителя все чаще стали применяться для экстракции макро- и микроколичеств ионов металлов [1-6]. Химическое взаимодействие компонентов такого водного раствора, содержащего органическое основание - диантипирилалканы (ДАА) - и органическую кислоту, приводит к образованию нового соединения, которое и вызывает расслаивание водно-органической смеси на две жидкие фазы. Небольшая по объему (1,4-1,8 мл) «нижняя фаза» (НФ) содержит высокие концентрации основания и кислоты, способных к образованию комплексных соединений с ионами металлов [5-7].
С целью выбора доступных и экологически чистых реагентов, образования достаточного для практических целей объема НФ нами изучена новая расслаивающаяся система диантипирилметан (ДАМ) или его гомолог - салициловая кислота (СК) - хлороводородная кислота - вода для извлечения ионов олова (II). В качестве гомологов ДАМ исследовали пропил-, бутил- и гексилдиантипирилметаны (ПДАМ, БДАМ, ГДАМ). При этом объем НФ не менялся в интервале концентраций HCl 0,5-6 моль/л как для ДАМ, так и для его гомологов. В работе использовали равные концентрации (0,1 моль/л) ДАА и СК при их содержании nДАА = nСК = 0,002 моль в общем объеме водной фазы 20 мл.
Навески ДАМ или его гомологов и СК помещали в градуированные пробирки, приливали 2 мл 0,1 моль/л раствора SnCl2, приготовленного на 2 моль/л HCl, хлороводородную кислоту и дистиллированную воду для создания определенной кислотности среды в объеме 20 мл. Содержимое пробирок нагревали на водяной бане (75-80 ºС) в течение 10 мин, время от времени перемешивая. Для определения 2·10-4 моль олова применяли реэкстракцию. Для этого после расслаивания органическую НФ растворяли в 10 мл хлороформа, переносили в делительную воронку на 50 мл и встряхивали 2-3 мин с 5 мл аммиачного буферного раствора. Водную фазу переносили в коническую колбу на 250 мл, приливали 2 мл концентрированной HCl, избыток (15 мл) 0,02 моль/л раствора ЭДТА и нагревали до кипения. Затем к горячему содержимому колбы прибавляли по каплям 20 %-й раствор уротропина для нейтрализации раствора до pH 5, а после охлаждения к раствору приливали 10 мл уротропинового буферного раствора с pH 4-5 и оттитровывали избыток ЭДТА 0,02 моль/л раствором нитрата висмута в присутствии смеси индикаторов ксиленолового оранжевого и метилтимолового синего (3:1) [8].
Исследована зависимость экстракции макроколичеств олова (II) от концентрации HCl (рис. 1).
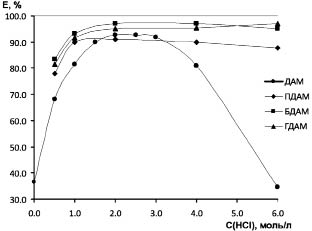
Рис. 1. Зависимость степени извлечения 2·10-4 моль ионов Sn (II) от кислотности по НCl
в системе ДАА - СК - НCl - Н2О (nДАА = nСК = 0,002 моль, СSn = 0,01 моль/л, Vобщ = 20 мл)
Из рис. 1 следует, что извлечение олова (II) ДАМ на 90-93 % наблюдается в интервале концентрации HCl, равном 1,5-3,0 моль/л. При дальнейшем увеличении концентрации HCl экстрагируемость Sn (II) уменьшается, что связано с переходом реагента (R) в нерастворимую двухкислотную соль R 2HCl и, как следствие, не извлекающую ацидокомплексы ионов металлов [9].
В отличие от ДАМ его гомологи БДАМ и ГДАМ обеспечивают экстракцию олова (II) на 95-97 % при СHCl = 2...6 моль/л. Кривая экстракции Sn (II) ПДАМ занимает промежуточное положение, сохраняя максимальное и минимальное извлечение олова на 92 и 87 % соответственно при концентрации HCl 2 и 6 моль/л. Таким образом, гомологи ДАМ являются более эффективными экстрагентами, так как при СHCl > 4 моль/л они образуют растворимую двухкислотную соль. Последняя в результате сдвига химического равновесия R 2HCl ↔ R HCl сохраняет высокую степень извлечения олова (II).
Кривые экстракции олова (II) ДАМ и его гомологами свидетельствуют о том, что при СHCl > 0,5 моль/л олово (II) образует один и тот же тип экстрагируемого комплекса, а именно, комплексный анион высшего порядка [SnCl4]2-.
В дальнейшем графически была определена концентрация реагента, обеспечивающая половинную экстракцию комплексов олова (II). Оказалось, что величина [ДАА]1/2 для [SnCl4]2- равна, моль/л: ПДАМ - 0,017; БДАМ - 0,016; ГДАМ - 0,010. На основе проведенных исследований построена билогарифмическая зависимость lgDSn(II) - lgC(R), с помощью которой определено соотношение Me:R = 1:2 в извлекающемся комплексе (рис. 2).
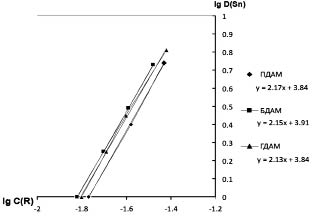
Рис. 2. Билогарифмическая зависимость lgDSn(II) - lgC(R), полученная для гомологов ДАМ
(ССК = 0,1 моль/л, СHCl = 2 моль/л)
Для установления полного состава извлекаемого комплексного соединения олова (II) проводили анализ насыщенного элементом экстракта на все компоненты. Полученные данные показали следующие соотношения компонентов:
R:Н+ :Sn2+ :Cl- = 2:2:1:4,3.
Таким образом, в органическую НФ экстрагируются ацидокомплексы состава (RH)2[SnCl4].
Известно, что в системе R - СК - вода происходит образование химического соединения между реагентом и СК по кислотно-основному механизму. При введении в систему небольших количеств ионов металла не происходит образования третьей фазы, хотя ацидокомплексы металлов с производными ДАМ малорастворимы в воде, следовательно, они растворяются в фазе, образованной химическим соединением реагента с СК - (RH)OOCC6H4OH.
Можно предположить, что при комплексообразовании реагента с ионом металла в системе протекают следующие процессы:
R + HOOCC6H4OH ↔ (RH)OOCC6H4OHo
Ro + HClв ↔ (RH)Clo
2(RH)Clо + [SnCl4]2-в + n(RH)OOCC6H4OHo ↔ (RH)2[SnCl4]о · n(RH)OOCC6H4OHo + 2Cl-в
По мере увеличения концентрации образующегося комплекса олова (RH)2[SnCl4] происходит уменьшение содержания соли (RH)OOСC6H4OH и, как следствие, выделение салицилат-ионов в раствор водной фазы. Если их количество будет превышать растворимость СК в воде, то в водной фазе выделяется осадок свободной СК, а комплекс олова (II) с реагентом будет выделяться в виде твердой фазы (RH)2[SnCl4]. Поэтому n в составе комплекса должно отвечать соотношению n ≥ 1.
Согласно полученным данным и предложенному расчету Бабко [10] были вычислены приближенные значения констант распределения хлоридных ацидокомплексов олова (II) по уравнению:
SnCln-2,в + 2Cl-в ↔ [SnCln]2-o
Константа образования и экстракции данного комплекса имеет вид:
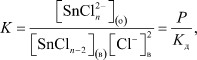
где P - константа распределения комплекса SnCln2‒ между органической и водной фазами, Kд - константа диссоциации комплекса в водной фазе.
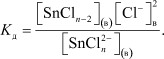
Логарифмируя и преобразовывая выражение для константы экстракции, получаем:
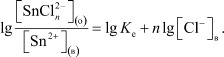
При половинной экстракции (Е = 50%), когда наблюдается равенство концентрации иона металла в водной и органической фазе, будет:
Кэ = 1/ [ДАА]1/2,
где [ДАА]1/2 - концентрация реагента, при которой олово (II) извлекается на 50 %.
Следовательно, величина P может быть определена по уравнению:
P = Kэ·Kд.
Результаты расчета приближенных значений констант распределения ионов олова (II), вычисленных в системах с различными ДАА, приведены в таблице.
Приближенные значения констант распределения хлоридных комплексов олова (II) в системах
ДАА - СК - HCl - вода
|
Реагент |
[ДАА]1/2, моль/л |
Кэ |
lgP |
|
ПДАМ |
0,017 |
3460 |
2,06 |
|
БДАМ |
0,016 |
3906 |
2,11 |
|
ГДАМ |
0,010 |
10000 |
2,52 |
Исходя из таблицы, можно составить следующий ряд реагентов по их экстракционной способности извлекать хлоридный комплекс олова (II): ГДАМ > БДАМ > ПДАМ (в порядке уменьшения констант экстракции и констант распределения комплекса).
Таким образом, найдены оптимальные условия образования двух жидких фаз, установлен состав, химизм и рассчитаны частные константы экстракции и распределения хлоридного ацидокомплекса олова (II) в новой расслаивающейся системе ДАМ (его гомолог) - СК - HCl - H2O.
Список литературы
- Рогожников С.И. Аналитическое использование экстракции элементов в расслаивающихся системах, образованных водой, антипирином и хлоруксусными кислотами: автореф. дис. ... канд. хим. наук. - Рига, 1985. - 16 с.
- Денисова С.А. Изучение межфазных равновесий в системах вода - нафталин-2-сульфокислота - производное антипирина: автореф. дис. ... канд. хим. наук. - Пермь, 2000. - 16 с.
- Порошина Н.В. Изучение закономерностей жидкофазных и экстракционных равновесий в системах вода - производные антипирина - бензойная кислота: автореф. дис. ... канд. хим. наук. - Пермь, 2006. - 19 с.
- Аликина Е.Н. Закономерности экстракции ионов металлов расплавами в расслаивающихся системах диантипирилалкан - бензойная кислота - неорганическая кислота - тиоционат аммония - вода: автореф. дис. ... канд. хим. наук. - Пермь, 2009. - 19 с.
- Дегтев М.И., Аликина Е.Н. Изучение экстракции ионов кобальта (II) и цинка (II) расплавами смесей диантипирилалканов и бензойной кислоты // Журн. неорг. химии. - 2010. - Т. 55, № 1. - С. 136-140.
- Дегтев М.И., Денисова С.А., Порошина Н.В. Экстракционные возможности новой расслаивающейся системы вода - гексилдиантипирилметан - бензойная кислота - неорганическая кислота // Химия, технология и промышленная экология неорганических материалов: сб. науч. трудов. - Пермь: Изд-во Перм. ун-та, 2003. - Вып. 6. - С. 89-95.
- Петров Б.И., Рогожников С.И. Аналитическое использование экстракции элементов в расслаивающейся системе вода - антипирин - монохлоруксусная кислота // Журн. аналит. химии. - 1985. - Т. 40. - С. 247-251.
- Спиваковский В.Б. Аналитическая химия олова. - М.: Наука, 1975. - 252 c.
- Диантипирилметан и его гомологи как аналитические реагенты // Учен. зап. Пермского ун-та. - Пермь: Перм. гос. ун-т, 1974. - № 324. - 280 c.
- Бабко А.К., Шевчук И.А., Дегтяренко Л.И. // Труды комиссии по аналитической химии. - 1963. - Т. 14. - С. 148-153.
Рецензенты:
Бегишев В.П., д.т.н., профессор, зав. лабораторией физико-химических полимеров Естественно-научного института, Пермского государственного университета, г. Пермь;
Онорин С.А., д.х.н., профессор, профессор кафедры химии и биотехнологии Пермского государственного технического университета, г. Пермь;
Полещук О.Х., д.х.н., профессор, зав. кафедрой органической химии, Томский государственный педагогический университет Министерства науки и образования РФ, г. Томск.
Работа поступила в редакцию 21.01.2011.
Библиографическая ссылка
Дегтев М.И., Попова О.Н., Аликина Е.Н. ЭКСТРАКЦИЯ ХЛОРИДНЫХ КОМПЛЕКСОВ ИОНОВ ОЛОВА (II) ДИАНТИПИРИЛАЛКАНАМИ В РАССЛАИВАЮЩЕЙСЯ СИСТЕМЕ С САЛИЦИЛОВОЙ КИСЛОТОЙ // Фундаментальные исследования. 2011. № 8-1. С. 198-201;URL: https://fundamental-research.ru/ru/article/view?id=26813 (дата обращения: 13.12.2025).



