Известно, что для возникновения патологических изменений в суставе необходимым условием является наличие первичного очага воспаления различной природы, в том числе травматической этиологии [3, 8], а возникновение травматического синовита является следствием неспецифического иммунного конфликта в полости сустава, когда в процесс вовлекаются иммунокомпетентные клетки, участвующие в формировании воспалительных и дегенеративно-дистрофических изменений всех компонентов сустава [1, 4]. С этих позиций синовиальная среда сустава рассматривается в качестве одного из периферических звеньев иммунной системы [2]. Вместе с тем анализ современной литературы [9, 10] показывает, что к настоящему времени окончательно на изучены особенности общих иммунных и местных цитологических реакций у больных в ранние сроки после травм крупных суставов, а способы ранней профилактики их последствий в виде посттравматического остеоартроза (ПТОА) представлены лишь в эксперименте [5, 7].
Цель исследования - изучить особенности иммуноцитологических реакций у больных в ранние сроки после механической травмы сустава и научно обосновать возможности использования радонотерапии для профилактики посттравматического остеоартроза.
Материал и методы исследования
Материалом для исследования были:
- 27 пациентов в возрасте 20-40 лет (группа исследования А1) с травматическим синовитом коленного сустава, развившимся в период от 2 до 4 недель с момента травмы (у 6 - после внутрисуставных переломов, у 8 - после гемартроза, у 13 с повреждениями капсульно-связочного аппарата в сочетании с остеохондральными переломами мыщелков бедренной или большеберцовой кости), диагноз посттравматического синовита был верифицирован на основании ультразвуковых обследований;
- 19 здоровых добровольцев в возрасте от 25 до 40 лет (контрольная группа);
- 24 пациента (группа исследования А2) с повреждениями коленного сустава, сопоставимыми по характеру и тяжести с группой исследования А1.
У всех больных изучали показатели Т-клеточного иммунитета с применением моноклональных антител к СD3+, СD4+, СD8+, СD16+, HLA-DR, подсчетом иммунорегуляторного и фагоцитарного индекса, проведением спонтанного и стимулированного зимозаном НСТ-теста, при исследовании В-клеточного иммунитета определяли Ig A, IgM, Ig G, Ig E и циркулирующие иммунные комплексы. Уровень противовоспалительных цитокинов интерлейкина-4 (ИЛ-4) и интерлейкина -10 (ИЛ-10), рекомбинантного гамма-интерферона (INF-γ) человека в сыворотке крови определяли с использованием твердофазного иммуноферментного метода с применением пероксидазы хрена и набора реагентов ProCon (ООО «Протеиновый контур», С-Петербург). Концентрацию С-реактивного белка (СРБ), лактоферрина (ЛФ) и рецепторного антагониста ИЛ-1 (ИЛ-1-AR) в сыворотке крови определяли иммуноферментным методом при помощи набора реагентов «Вектор-Бест» (Новосибирск).
Всем больным проведено цитологическое исследование синовиальной жидкости, которую в объеме 2-4 мл получали путем пункции сустава. Для изучения активности воспалительных изменений синовиальной среды сустава методом световой микроскопии определяли количество клеток крови (нейтрофильных лейкоцитов и лимфоцитов), выраженность внутрисуставных деструктивных процессов оценивали по количеству клеток тканевого происхождения (синовиоцитов) в мазках синовиальной жидкости, окрашенных по Романовскому-Гимза.
Пациентам группы исследования А2 проведена бальнеотерапия в виде общих азотно-кремнистых радосодержащих ванн (С Ra - 0,19 кБк/л, t - 36 °С, экспозиция 15 минут, 14 процедур, проводимых два дня подряд с перерывом на третий, курсовая эквивалентная доза составила 280 мкЗв).
Обработку полученных результатов исследования проводили с использованием программы SPSS.13 for Windows, с помощью которой вычисляли средние значения М, стандартное отклонение δ, стандартные ошибки средних m. Для проверки вида распределения изучаемых показателей использовали одновыборочный тест Колмогорова-Смирнова. Для проверки достоверности различий между исследуемыми группами, в которых данные были распределены по нормальному закону, использовали t-критерий Стьюдента. В случае отличия вида распределения изучаемых переменных от нормального гауссового распределения, достоверность различий проверяли при помощи непараметрических критериев: U-критерия Манна-Уитни. Для всех показателей была отвергнута нулевая гипотеза на уровне значимости 0,05.
Результаты исследования и их обсуждение
Проведенный нами анализ иммунограмм у пациентов групп А1 и контрольной показал патологические изменения в Т- и В-клеточной системах иммунитета у больных с посттравматическим синовитом, которые свидетельствуют об активном участии иммунной системы в возникновении посттравматического воспаления в синовии (табл. 1).
Кроме того, достоверные различия выявлены в системе воспалительных реактантов (СРБ и цитокинов), что указывает на их влияние в формировании воспалительных изменений в полости сустава в раннем периоде после травмы (табл. 2).
Таблица 1
Сравнительная характеристика общего иммунного статуса у больных с посттравматическим синовитом коленного сустава и здоровых лиц (М ± m, n = 46)
|
Исследуемый показатель |
Группа А1 (n = 27) |
Контрольная группа (n = 19) |
|
Фагоцитарный индекс (ФИ), % |
69,4 ± 3,5 |
51,9 ± 2,9* |
|
Относительное количество лимфоцитов (Лотн.), % |
45,1 ± 0,7 |
37,4 ± 2,6* |
|
Общие Т-клетки (CD3), % |
62,1 ± 2,8 |
45,1 ± 2,5* |
|
Т-хелперы/индукторы (CD4), % |
36,2 ± 0,9 |
28,8 ± 1,1* |
|
Цитотоксические супрессорные клетки (CD8), % |
21,9 ± 0,4 |
25,2 ± 0,2* |
|
Натуральные киллеры (CD16), % |
19,8 ± 1,4 |
13,1 ± 1,4* |
|
Иммунорегуляторный индекс (ИРИ) |
2,29 ± 0,1 |
1,31 ± 0,1* |
|
Спонтанный НСТ-тест, усл.ед |
0,3 ± 0,15 |
0,5 ± 0,1* |
|
Стимулированный зимозаном НСТ-тест, усл.ед. |
1,1 ± 0,2 |
1,6 ± 0,1* |
|
Антигенпрезентирующий фактор (HLA-DR), % |
13,2 ± 0,3 |
11,2 ± 0,1 |
|
Иммуноглобулин G, г/л |
16,11 ± 1,9 |
11,3 ± 1,23* |
|
Иммуноглобулин М, г/л |
1,76 ± 0,13 |
1,3 ± 0,17* |
|
Иммуноглобулин А, г/л |
1,19 ± 0,19 |
2,5 ± 0,16* |
|
Иммуноглобулин Е, г/л |
16.4 ± 0,7 |
12,4 ± 0,5* |
|
Циркулирующие иммунные комплексы (ЦИК), усл.ед. |
22,8 ± 1,6 |
13,1 ± 1,45* |
Примечание: * - p < 0,05 между группами А1 и контрольной.
Таблица 2
Сравнительная характеристика реактантов воспаления у больных с посттравматическим синовитом коленного сустава и здоровых лиц (М ± m, n = 46)
|
Исследуемый показатель |
Группа А1 (n = 27) |
Контрольная группа (n = 19) |
|
Рецепторный антагонист ИЛ-1 (ИЛ-1-RA), пг/мл |
496 ± 92 |
564 ± 87 |
|
Лактоферрин (ЛФ), нг/мл |
343 ± 48 |
523 ± 73* |
|
С-реактивный белок (СРБ), мг/мл |
1,01 ± 0,15 |
0,61 ± 0,14* |
|
Интерлейкин-4 (ИЛ-4), пг/мл |
23,5 ± 9,05 |
35,9 ± 11,2 |
|
Интерлейкин-10 (ИЛ-10), пг/мл |
176,4 ± 39,2 |
343,5 ± 55,4* |
|
Интерферон-гамма (INF-γ), пг/мл |
29,3 ± 3,87 |
39,2 ± 4,26* |
Примечание: * - p < 0,05 между группами А1 и контрольной.
Таблица 3
Сравнительная характеристика клеточного состава синовиальной жидкости
у больных с посттравматическим синовитом коленного сустава
и здоровых лиц (М ± m, n = 46)
|
Исследуемый показатель |
Группа А1 (n = 27) |
Контрольная группа |
|
Клетки крови (ЛФ+ЛН), % |
53 ± 3,5 |
37 ± 2,8* |
|
Синовиоциты, % |
9,3 ± 0,6 |
4,3 ± 0,3* |
Примечание: * - p < 0,05 между группами А1 и контрольной.
Специфические изменения были отмечены нами при цитологическом исследовании синовиальной жидкости (табл. 3), в которой у больных с синовитом выявлено повышенное содержание клеточных элементов - лимфоцитов и нейтрофильных лейкоцитов, а также тканевых клеточных элементов - зрелых и распадающихся форм синовиоцитов, являющихся маркерами деструктивного процесса.
Таким образом, в ходе проведенного исследования установлено, что в период 2-4 недель после механической травмы сустава индукторами синовиального воспаления в поврежденном суставе являются общая иммунная ( в виде активизации Т- и В-клеточной систем иммунитета) и местная цитологическая реакция (в виде повышения концентрации в синовии маркеров воспаления). На этом фоне увеличение содержания синовиоцитов, являющихся маркерами хрящевой деструкции, свидетельствует о формировании вторичных дегенеративных изменений в полости сустава вследствие развития травматического синовита.
На основании результатов проведенного исследования мы предположили, что одним из путей профилактики ПТОА на стадии травматического синовита, может стать применение иммунокоррегирующих методов лечения, одним из которых является радонотерапия (РТ) [6,11]. РТ в курсовой ЭД 280 мкЗв использовали у 27 больных группы исследования А1. До и после радонотерапии проводили описанные выше иммунноцитологические исследования. В те же сроки аналогичные исследования выполнены у 24 больных группы исследования А2 с сопоставимыми по тяжести повреждениями, которым радонотерапия не проводилась.
После проведения РТ позитивные изменения произошли в системе Т-клеточного и В-клеточного иммунитета (рис. 1, 2.)
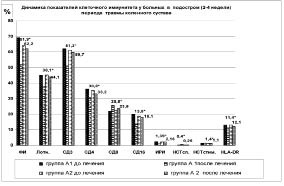
Рис. 1. Динамика показателей Т-клеточного иммунитета
(* - p < 0,05 - достоверность различий между конечными значениями в группах А1 и А2)
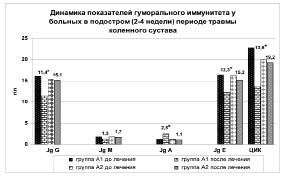
Рис. 2. Динамика показателей В-клеточного иммунитета
(* - p < 0,05 достоверность различий между конечными значениями в группах А1 и А2)
Сравнительный межгрупповой анализ полученных данных (см. рис. 1 и 2) свидетельствует о том, что после проведения РТ снизилась активность клеточного и гуморального иммунитета. В частности, на 16,6 %(p < 0,05) уменьшился фагоцитарный индекс, общее количество Т-лимфоцитов на 13,8 %(p < 0,05), Т-киллеров - на 23,8 % (p < 0,05), на 35,6 % (p < 0,05) снизился иммунорегуляторный индекс, в среднем на 21,3 % (p < 0,05) понизилась концентрация в крови иммуноглобулинов G, М и Е, а количество циркулирующих иммунных комплексов уменьшилось на 29,2 % (p < 0,05).
Кроме того, отмечено снижение концентрации в крови реактантов воспаления: на 29,9 % (p < 0,05) - С-реактивного белка, на 14,6 % (p < 0,05) возросла концентрация рецепторного антагониста провоспалительного цитокина ИЛ-1, а содержание противовоспалительных цитокинов (ЛФ, ИЛ-4, ИЛ-10,ИНФ-γ) увеличилось в среднем на 27,6 % (p < 0,05) (рис. 3).

Рис. 3. Динамика изменений реактантов воспаления
(* - p < 0,05 - достоверность различий между конечными значениями в группах А1 и А2)
Наряду с положительной динамикой в иммунном статусе позитивные изменения зафиксированы при цитологическом исследовании синовиальной жидкости, при этом на фоне уменьшения на 18,6 % (p < 0,05) количества нейтрофильных лейкоцитов и лимфоцитов, свидетельствующего о регрессе воспалительных изменений в суставе, произошло снижение на 36,7 % (p < 0,05) количества тканевых клеточных элементов - синовиоцитов, являющихся маркерами дегенеративно-дистрофических изменений (рис. 4).

Рис. 4. Динамика изменений синовиоцитограммы
(* - p < 0,05 достоверность различий между конечными значениями в группах А1 и А2)
Выводы
Проведенные исследования механизмов травматического синовиального воспаления позволили получить данные об активном участии иммунной системы в возникновении травматического синовиального воспаления, о чем свидетельствовали повышение на 17,8 % активности Т-клеточного и на 30,4 % - В-клеточного иммунитета, увеличение на 29,1 % концентрации в крови уровня реактантов воспаления, а в синовии поврежденного сустава на 30,2 % возросло содержание маркеров воспаления и на 53,8 %- маркеров хрящевой деструкции.
Применение радонотерапии в эквивалентной дозе 280 мкЗв в качестве метода иммуннокоррекции у пациентов с посттравматическим синовитом ведет к снижению активности клеточного и гуморального иммунитета в среднем на 22,2 %, синовиального воспаления - на 18,6 %, процессов хрящевой деструкции на - 36,7 %, что позволяет считать предложенный метод профилактики посттравматического остеоартроза патогенетически обоснованным.
Список литературы
- Базарный В.В. Лабораторное исследование синовиальной жидкости: учебно-методическое пособие. - Екатеринбург: УГМА,2003. - 20 с.
- Бененсон Е.В., Цай Е.Г., Табышалиева А.С. Иммунорегуляторные нарушения и пролиферативная активность Т- и В-лимфоцитов при остеоартрозе // Ревматология. - 1989. - №2. - С. 45-49.
- Бушуев Ю.И., Ежов Ю.И., Ежов И.Ю. Гистоморфологическая характеристика тканей тазобедренного сустава при механической травме // Вестник травматол. ортопед. - 1997. - № 3. - С. 56-60.
- Виноградова Е.В. Механизмы деструкции и регенерации хряща коленного сустава при остеоатрозе // Ортопедия, травматология и протезирование. - 2000. - № 2. - С. 97-98.
- Обоснование применения миелопида для профилактики посттравматического остеоартроза / Г.М. Дубровин, Ю.А. Блинков, С.В. Нетяга, А.А. Нетяга // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2005. - №2. - С. 60-64.
- Колесников А.П., Эфендиев Б.А. Иммуномодулирующее действие радонотерапии на курорте Белокуриха // Вопр.курортол. - 1993. - №3. - С. 35-39.
- Редько К.Г. Профилактика развития деформирующего артроза коленного сустава природными полисахаридами: Экспериментальное исследование: автореф. дис. ... канд. мед. наук. - СПб., 1996. - 17 с.
- Трофименко Н.А. Провоспалительные цитокины и реактанты острой фазы воспаления при заболеваниях суставов: автореф. дис. ... канд. мед. наук. - Барнаул, 2007. - 24 с.
- Cavaillon J.M. Les cytokines de l´inflammation // C R Seanses Soc.Biol.Fil. - 1995. - T. 189, №4. - P. 531-544.
- Shmerling R.H. Synovial fluid analysis. A critical reappraisal // Rheum. Dis. Clin.North Am. - 1994. - Vol. 20. - P. 503-512.
- Study on biologic effects of radon and thermal therapy on osteoarthritis / K. Yamaoka, F. Mitsunobu, K. Hanamoto, S. Mori, Y. Tanizaki, K. Sugita // J Pain. - 2004. - №5(1). - Р. 20-25.
Рецензент ‒
Кулишова Т.В., д.м.н., профессор, зав. кафедрой восстановительной медицины ФПК и ППС ГОУ ВПО «Алтайский государственный медицинский университет Росздрава РФ», г. Барнаул.
Библиографическая ссылка
Ударцев Е.Ю. ИММУНОЦИТОЛОГИЧЕСКИЕ МЕХАНИЗМЫ ПОСТТРАВМАТИЧЕСКОГО СИНОВИАЛЬНОГО ВОСПАЛЕНИЯ И ОБОСНОВАНИЕ ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ РАДОНОТЕРАПИИ ДЛЯ ПРОФИЛАКТИКИ ОСТЕОАРТРОЗА // Фундаментальные исследования. 2011. № 7. С. 147-151;URL: https://fundamental-research.ru/ru/article/view?id=26747 (дата обращения: 07.03.2026).



