Причинами повреждений мозга являются бытовая травма - 60 %, автомобильные аварии - 30 % и производственная или спортивная травма - 10 % [1]. Опухоли головного мозга являются второй серьезной проблемой, требующей после оперативного вмешательства восстановления строения костей черепа [10]. Серьезную проблему составляет по-прежнему развитие сосудистой патологии. В последнее время все большее значение приобретает оперативное лечение геморрагических инсультов [9]. Особое значение приобретают эти вопросы у пожилых пациентов. Литературные данные свидетельствуют о нерешенности многих вопросов, связанных с закрытием дефектов черепа, к основным из которых относятся выбор пластического материала и метода оперативного вмешательства, сроки проведения краниопластики и показания к ней [8].
Было проведено изучение статистически закономерной черепно-мозговой травмы у лиц пожилого возраста (60-86 лет) на базе «Муниципальной городской клинической больници №1» г. Белгорода в количестве 297 случаев. Количество пациентов в возрасте 60-86 лет составили 41 (13,8 %). Из них 8 женщин (19,5 %) и 33 мужчины (90,5 %). Помимо этого, проведен эксперимент на 25 крысах-самцах линии «Вистар» массой 200-250 грамм в возрасте 14-16 месяцев из питомника РАМН «Столбовая» Московской области. Все процедуры содержания животных, проведения манипуляций и тестирования полученных данных проводились в соответствии со стандартами ISO 10993-1-2003 и ГОСТ Р ИСО 10993.2-2006.
При аутопсии было проведено макроскопическое описание и фотографирование. Для исследования методом световой микроскопии срезы с парафиновых блоков окрашивали гематоксолином и эозином, исследовались и фотографировались в световом микроскопе «Topic-T» Ceti.Для растровой электронной микроскопии пробы фиксировали в стандартном глутаральдегидовом буфере. Затем просматривали в растровом микроскопе «FE1 Quanta 200 3D». Элементный анализ макро- и микроэлементов (углерода, кислорода, фосфора, кальция, азота, натрия, магния, железа, алюминия и серы) был сделан с использованием детектора для регистрации спектров характеристического рентгеновского излучения фирмы EPAX. Детекторы интегрированы с растровым электронным микроскопом «Quanta 600 FEG». Зондовая сканирующая микроскопия проведена на сканирующем зондовом микроскопе на приборе «Ntegra-Aura». Для изучения регенераторных особенностей костной ткани выбраны флюоресцентный краситель - родамин. Обработка препаратов производилась на микроскопе «Микмед-6», вариант 11.
Результаты исследования и их обсуждение
При изучении регенерации костной ткани в опытной группе показано, что ширина ободка демаркационной зоны воспаления составляла через неделю 1,4 ± 0,4, а через 2 недели - 1,8 ± 0,29 (мм). Демаркационная зона воспаления на следующих сроках экспозиции не наблюдалась. К четвертой неделе гиперемия и отек были выражены в меньшей степени, чем при недельной экспозиции. На следующих сроках экспозиции воспалительная реакция не отмечалась. В матриксной кости было отмечено, что Гаверсовы каналы остеонов расширены вследствие остеокластической резорбции и содержат большое количество клеточных элементов и заполненных кровью сосудов. Выявлялись остатки гематомы с волокнами фибрина, которые были подвержены организации за счет прорастания в них фибробластических элементов. Через 6 недель экспозиции матриксная кость не изменена. Гаверсовы каналы умеренно полнокровны вплоть до сроков 12 недель. Происходит дальнейшее разрастание хрящевой ткани и сосудов.
При 7-дневной экспозиции у всех животных граница между волокнистым и клеточным слоями не определялась. Наблюдались фрагменты с диапедезными кровоизлияниями. Здесь же были выявлены клетки лимфоидного ряда. Ткань была преимущественно рыхловолокнистая соединительная (рис. 1).
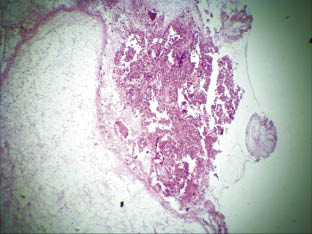
Рис. 1. Фрагмент костной ткани черепа крысы (теменная область). 1 неделя экспозиции. Фрагментарные дефекты костной ткани. В дне раны участки некротизированной ткани, форменные элементы, фрагменты грануляционной ткани (указаны стрелкой).
Окраска гематоксилином и эозином. Ув. Х120
Через 2 недели просматривалась сформированная соединительная ткань, богатая полнокровными сосудами. К 30 суткам формируется сложный симбиоз из нескольких видов тканей: это фиброзная ткань, которая как бы является основой для располагающейся среди нее островков хрящевой ткани, а также жировая ткань. Здесь определяются уже и вновь образованные сосуды. Наблюдались фрагменты с диапедезными кровоизлияниями. Через 9-12 недель наблюдается формирование костной ткани с развитием Гаверсовых каналов, которые на этой стадии меньшего размера и полнокровны. Остеобласты располагаются в полостях и хорошо выражены (рис. 2).
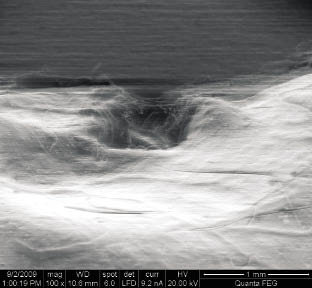
Рис. 2. Оперированные животные (контрольная группа). Экспозиция 9-й недели с момента операции. Ткань имеет неровную поверхность. На поверхности вновь образованной ткани определяются дефекты размерами 0,5-1 mm, глубиной 0,2-0,4 mm (указаны стрелкой).
РЭМ. Ув. х 100
При изучении ткани над имплантом с помощью атомносиловой микроскопии было показано, что при использовании биокомпозитов формировалась ровная зона мезенхимальной ткани, заполняющей дефект между костной тканью и композитом и равномерно прикрывающей последний, формирующая своеобразный купол над ним толщиной до 11,0 ± 0,5 µм. При использовании же композитов без покрытия слой вновь образованной ткани был неравномерным, 5,0 ± 1,5 µм, и наблюдались лишь отдельные фрагменты формирования ткани над имплантом.
Ободок соединительной ткани составил через неделю 160,0 ± 35,0 µm, а через 2 недели - 180,0 ± 30,0. Размер вновь образованной ткани: 56 ± 20,0, а через 2 недели - 90 ± 15,0. К 30 дням вновь сформированная фиброзная и хрящевая ткань начинала распределяться более равномерным слоем.
К 30 дням фиброзная ткань наблюдалась в виде ободка. Постепенно в ней обнаруживались неравномерной величины поля хрящевой ткани, которые переходят в сеть костных трабекул. Пролиферация хондробластов продолжается до 30 суток. Остеобласты располагались как поодиночке, так и попарно. К 30 суткам после операции хрящ достигал определенной степени зрелости, в нем происходили процессы дегенерации, образовывались полости разрушения, то есть наблюдался типичный процесс эндохондрального окостенения. К 6-й неделе начинала формироваться зрелая костная ткань в виде островков.
Слои костной ткани, образовавшиеся на этом этапе экспозиции, имели свои канальцы, соединенные с лежащими ниже слоями. Их толщина составляла 56 ± 19,71. Со стороны твердой мозговой оболочки слой ткани имел более неровную поверхность. Граница между старой и новообразованной костью визуализировалась под микроскопом. Выявлена компактная кость с грубоволокнистыми костными трабекулами, фрагменты пластинчатой кости. Отмечено формирование зрелой пластинчатой из губчатой кости. Наблюдалась инвазия сосудов с формированием сосудистой сети, наличием эритроцитов. Фиброзная ткань не выражена. Наблюдался плотный ободок соединительной ткани по периферии. Выявлены новообразованные остеоны.
При экспозиции 9 недель при ультрамикроскопическом изучении определено формирование Гаверсовых каналов. Был выявлен активный остеогенез, наличие остеогенных клеток - остеобластов. Намечена сосудистая сеть. Центры кальцификации новообразованных костных трабекул в эндостальной части появлялись через 7 суток с момента операции. С помощью люминесцентной микроскопии было показано, что окраска родаминовым красным, хорошо отображающая клетки с высокой метаболической активностью, наиболее выражена в зоне по периферии костной ткани и во вновь образованной волокнистой ткани.
При изучении микроэлементного состава было показано, что к 14 дням прогрессивно увеличивается содержание натрия (1,01 ± 0,01), магния (9,69 ± 0,02). Помимо этого, отмечено наличие фосфора (36,97 ± 0,09), кальция (30,35 ± 0,08). Появляется железо (4,07 ± 0,01). Содержание натрия прогрессивно возрастало. То же самое можно сказать о магнии: 24,81 ± 0,06. Следует отметить увеличение количества кальция: 966,46 ± 2,42.
Таким образом, при помощи инновационных методов исследования нами были показаны этапы регенерации костной ткани у возрастных животных.
Статья подготовлена в рамках реализации программы развития научного потенциала высшей школы (имплант).
Список литературы
- Ермаков С. П. Современные возможности интегральной оценки медико-демографических процессов. - М., 1996. - С. 58-61.
- Анализ структуры тяжелой черепно-мозговой травмы, тактики оперативного вмешательства и вариантов выполнения краниопластики / Л.А. Павлова, А.В. Нестеров, Е.Н. Бокова, О.Н. Немыкин, Т.В. Павлова // Фундаментальные исследования. - 2009. - № 10. - С. 25-27.
- Характеристика репаративных процессов при применении биокомпозитов, содержащих BMP-2 на основе имплантов из наноструктурированного титана на ранних стадиях регенерации / Л.А. Павлова, В.В. Кривецкий, А.В. Нестеров, Т.В. Павлова // Системный анализ и управление в биомедицинских системах. - 2010. - Т. 9, № 1.- С. 200-203.
- Морфологический анализ костного дефекта при использовании импланта титана, обработанного пескоструйным методом с различными композитными покрытиями в динамике первого месяца регенерации / Л.А. Павлова, Т.В. Павлова, А.В. Нестеров, Д.А. Колесников, И.Ю. Гончаров, М.Г. Жерновой // Научные ведомости БелГУ. - 2010. - № 4 (75), Вып. 9. - С. 58-63.
- Особенности регенерации костной ткани при введении коллагеново-гидроксиаппатиных нанокомпозитов / Т.В. Павлова, Ю.А. Мезенцев, Л.А. Павлова, А.В. Нестеров, Д.А. Колесников // Фундаментальные исследования. - 2009. - №8. - С. 25-28.
- Павлова Т.В. Особенности черепно-мозговой травмы у пациентов пожилого возраста и способы ее коррекции (клинико-экспериментальное исследование) / Т.В. Павлова, А.В. Нестеров, Л.А. Павлова, М.Г. Жерновой // Геронтологический журнал им. В.Ф. Купревича. - 2010. - № 2. - С. 51-52.
- Павлова Т.В. Черепно-мозговая травма у пациентов пожилого возраста и способы ее коррекции (клинико-экспериментальное исследование) / Т.В. Павлова, А.В. Нестеров, Л.А. Павлова, М.Г. Жерновой // Научные ведомости БелГУ. - 2010. - Вып. 12/1, № 22 (93). - С. 78-82.
- Сухих Г.Т. Мезснхимальные стволовые клетки / Г.Т. Сухих, Малайцев Г.В., Богданова И.М., Дубровина И.В. // Бюл. эксперим. биол. - 2002. - Т. 133, № 2. - С. 124-131.
- Чехонацкий А.А. Современные вопросы консервативного и хирургического лечения нарушений мозгового кровообращения / З.А. Суслина, С.Л. Тимербаева, А.А. Чехонацкий // Ремедиум Приволжье. - 2009. - № 9.
- Cairncross J.G. Understanding low-grade glioma. Neurology. - 2000. -№54. - Р. 1402-3.
Рецензенты:
Луценко В.Д., д.м.н., профессор, главный врач МУЗ «Городская больница №2», г. Белгород;
Парфенов И.П., д.м.н., профессор, зав. хирургическим отделением №1 БОКБ Св. Иоасафа, г. Белгород.
Библиографическая ссылка
Нестеров А.В., Павлова Т.В., Павлова Л.А., Башук В.В., Меднев Д.С., Савенко Т.Н., Жерновой М.Г. ВОЗРАСТНЫЕ АСПЕКТЫ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ // Фундаментальные исследования. 2011. № 7. С. 120-123;URL: https://fundamental-research.ru/ru/article/view?id=26739 (дата обращения: 29.01.2026).



