В последние десятилетия активно изучаются летучие продукты микробного метаболизма для выяснения их роли в аллелопатических взаимодействиях микро- и макроорганизмов. Прикладной аспект проблемы биосинтеза и накопления летучих метаболитов позволяет рассматривать микроорганизмы в качестве нетрадиционных источников получения натуральных душистых веществ, применяемых в медицине, фармацевтической, парфюмерно-косметической и пищевой промышленности.
Скрининг биосинтетической способности более 50 культур мицелиальных грибов, относящихся к видам Ceratocystis paradoxa, C.pilifera, Eremothecium ashbyi, Ashbyi gossypii, Aspergillus awamori, Asp. foetidus, Penicillium canescens, Trichoderma viride и ряду других, показал, что они могут продуцировать эфирные масла, содержащие ценные компоненты [4, 5, 7, 9]. Качественный состав и количественное содержание (22,3...424,1 мг/л культуральной жидкости) синтезируемых летучих соединений весьма разнообразны и обусловлены как генетическими факторами, так и условиями культивирования.
Наибольшее количество эфирного масла синтезировали коллекционные штаммы рода Eremothecium - до 180 мг/л культуральной жидкости в течение первых двух суток роста на ферментационной среде, что сопоставимо с содержанием эфирного масла в 500...600 г цветков розы. Основными компонентами являются гераниол (69,5...84,9 %) и β-фенилэтанол (12,7...27,7 %), а также идентифицированы нерол, цитронеллол, нераль и гераниаль, что свидетельствует о сходстве изучаемого масла с эфирным маслом из свежих цветков розы. Наряду с ароматообразующими соединениями штаммы продуцируют витамин В2 (рибофлавин) - до 137 мг/л культуральной жидкости и при этом различаются уровнем флавиногенеза [1-3, 8].
Целью данного исследования является изучение культурально-морфологических и физиолого-биохимических особенностей видов рода Eremothecium в связи с динамикой накопления рибофлавина и эфирного масла.
Материал и методы исследования
Объектами исследования служили штаммы Eremothecium ashbyi Guilliermond 1935 BKM F-124, ВКМ F-3009 (мутант, получен селекционным путем из штамма BKM F-124) и Eremothecium gossypii (S.F. Ashby et W. Nowell 1926) Kurtzman 1995 (синоним Ashbya gossypii (S.F. Ashby et W. Nowell 1926) Guilliermond 1928) BKM F-1398, BKM F-3276 (мутант, получен путем отбора из штамма BKM F-1398), BKM F-3296. Данные микроорганизмы относятся к царству Fungi, типу Ascomycota, классу Endomycetes, порядку Saccharomycetales, семейству Spermophthoraceae (Nematosporaceae). Изучаемые штаммы не являются патогенными для человека, так как не относятся к 1-4-й группе патогенности согласно Санитарно-эпидемиологическим правилам СП 1.3.2322‒08. Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней. М.: Госкомсанэпиднадзор РФ, 2008.
Культуры поддерживали при 4 ºС на скошенной агаризованной среде, содержащей соевую муку (4 %) и сахарозу (1 %) [10], сусло-агаре, агаре Сабуро, картофельно-глюкозном агаре, мясо-пептонном агаре, среде Чапека, питательном агаре [7]. Ферментацию осуществляли в течение 18...84 часов в жидкой питательной среде (10 мл) в микробиологических пробирках на качалках (150 об./мин). Культуральную жидкость (КЖ) в трехкратной повторности отбирали каждые 12 ч, начиная с 24 ч культивирования. Мицелий отфильтровывали, биомассу определяли после высушивания при 100 ºС до постоянной массы, фильтрат культуральной жидкости экстрагировали диэтиловым эфиром или липиды извлекали трехкратной экстракцией гексаном. Растворитель удаляли на роторном испарителе под вакуумом, остаток липидов взвешивали. Навеску липидов растворяли в гексановом растворе внутреннего стандарта (2 мг ментола в 1 мл гексана) и анализировали содержание ароматобразующих соединений (АОС) методом газожидкостной хроматографии (ГЖХ). Содержание рибофлавина определяли спектрофотометрически при 445 нм после предварительного гидролиза культуральной жидкости при 100 ºС в течение 30 мин в присутствии 6 н раствора соляной кислоты. Морфологию культур исследовали под микроскопом БИОМЕД-3 (кратность увеличения 10, 40) в нативных и окрашенных метиленовым синим микропрепаратах. Фотографирование осуществляли аппаратом Panasonic DMC-FX100 c объективом Lumix 12 mega pixels.
Результаты исследования и их обсуждение
Макроморфология
E. ashbyi на твердой агаризованной среде образует плоские матовые (позднее глянцевые) колонии желтого цвета, легко снимающиеся с агара. Форма колоний округлая, диаметром 8...12 мм (на сусло-агаре через 3 сут. роста при 28 ºС). На мясо-пептонном, питательном агарах и агаре Сабуро пигментация изучаемых штаммов менее выражена по сравнению с глюкозо-картофельным агаром, сусло-агаром, средой Чапека.
Следует отметить, что популяция штамма E. аshbyi ВКМ F-124 была наиболее гетерогенна, по сравнению с другими изучаемыми штаммами, по некоторым количественным характеристикам отдельных колоний (диаметру, пигментации и др.).
E. gossypii образует колонии, которые на сусло-агаре, картофельно-глюкозном агаре, среде Чапека с кукурузным экстрактом через 3 суток роста при температуре 27 ± 1 ºС достигают 6 мм, пигментированы, желтого цвета с четким краем. Форма колоний округлая, они плоские, матовые, плотные, с агара легко снимаются петлей в виде пленки. Спустя 10 суток светло-желтые, слегка выпуклые в середине, с поверхностно-разбросанным бесцветным краем. Пигмент (рибофлавин) окрашивает среды в желто-коричневые тона. Рост по штриху на среде Чапека - скудный, сусло-агаре, картофельно-глюкозном агаре - умеренный, на среде Чапека с кукурузным экстрактом, питательном агаре - хороший.
Микроморфология
E. ashbyi имеет дихотомически ветвящийся мицелий, состоящий из многоядерных клеток. Диаметр гиф варьирует в пределах 2,5...16,5 мкм. Спорангии продолговатые многоспоровые, конидии веретеновидные. Размеры аскоспор составляют: длина - 20,2...26,7 мкм, диаметр - 2,5...2,8 мкм.
При культивировании штаммов E. gossypii на твердых питательных средах и в аналогичных жидких средах существенных отличий микроморфологических показателей (форма, размеры клеток и т.п.) не наблюдалось. Спорогенез начинается при старении культуры, не ранее стационарной фазы: аски с аскоспорами образуются интеркалярно, а почкующиеся клетки (конидии) - терминально или латерально на гифах мицелия.
Физиолого-биохимическая характеристика
Особенности физиологии видов Eremothecium (табл. 1) исследовали в различных условиях культивирования: варьировали температурные показатели, значения исходного рН и режимы аэрации. Изучаемые микроорганизмы растут в диапазоне температур 20...35 ºС, оптимальная область - 26...28 ºС (при 37 ºС не растут). Область рН для роста 3,2...7,5, оптимум рН 5,5...6,5. По отношению к кислороду являются аэробами в условиях поверхностного и глубинного культивирования.
Использование (утилизация) источников углерода и азота видами рода Eremothecium изучалось в основном на модификациях среды Чапека.
При этом потребление изучаемыми штаммами единственных источников углерода и энергии, а также азота происходит с различной интенсивностью.
Как отмечалось ранее, микромицеты E. ashbyi и E. gossypii являются продуцентами рибофлавина и эфирного масла, основными ароматобразующими соединениями которого являются гераниол, нерол, цитронеллол, β-фенилэтанол. Однако доля этих веществ в составе синтезированных мицелием E. gossypii липидов существенно выше, по сравнению с E. ashbyi, причем соотношение монотерпеновых спиртов более приближено к содержанию их в розовом эфирном масле. Основные компоненты и их процентное соотношение в смесях ароматобразующих соединений, синтезированных E. ashbyi и E. gossypii, представлены в табл. 2.
Минорными составляющими смеси душистых веществ являются нераль, гераниаль, эфиры монотерпеновых спиртов, линалоол, свойственные маслам розового направления. Следует отметить, что определенное варьирование приведенных показателей обусловлено различным составом питательных сред.
Таблица 1
Физиолого-биохимические свойства видов рода Eremothecium
|
Свойство |
E. ashbyi |
E. gossypii |
|
Источники углерода для роста - глюкоза - фруктоза - галактоза - ксилоза - арабиноза - рамноза - мальтоза - сахароза - рафиноза - инозит - дульцит - маннит - сорбит - глицерин - этанол - глюкозамин - ацетат - цитрат - крахмал - целлюлоза |
Утилизирует Утилизирует Не определяли Не определяли Не определяли Не определяли Не определяли Не определяли Не определяли Не утилизирует Не определяли Не определяли Не определяли Утилизирует Не определяли Не определяли Утилизирует Утилизирует Не утилизирует Не утилизирует |
Утилизирует Не определяли Не утилизирует Не утилизирует Не утилизирует Не утилизирует Утилизирует Утилизирует Утилизирует Не утилизирует Не утилизирует Не утилизирует Не утилизирует Не определяли Утилизирует Не утилизирует Не определяли Не утилизирует Не определяли Утилизирует |
|
Гидролиз казеина |
Наблюдается коагуляция |
Наблюдается коагуляция |
|
Гидролиз пептона |
Положительный |
Положительный |
|
Гидролиз желатина |
Слабый |
Не определяли |
|
Восстановление нитратов |
Положительное |
Отрицательное |
|
Ассимиляция аммонийного азота |
Не определяли |
Положительная |
Таблица 2
Состав эфирного масла штаммов Eremothecium
|
Компонент |
Штаммы E. ashbyi |
Штаммы E. gossypii |
|
|
BKM F-3276 |
BKM F-1398 |
||
|
Гераниол |
65,5...80,9 % |
31,5...58,8 % |
55,7...69,7 % |
|
Цитронеллол |
6,0...11,4 % |
2,5...4,6 % |
0,3...3,0 % |
|
Нерол |
1,8...3,4 % |
1,9...6,8 % |
0,1..1,1 % |
|
β-фенилэтанол |
9,1...20,1 % |
44,0...57,4 % |
25,1...38,6 % |
Динамика роста и развития в процессе культивирования
Динамика накопления биомассы E. ashbyi при культивировании в жидкой питательной среде подчиняется известным закономерностям для простых периодических культур: до 36 ч рост идет экспоненциально и достигает 2,0 г сухой биомассы на 1 л культуральной жидкости, затем наблюдается замедление скорости роста, характерное при переходе к стационарной фазе, и к концу ферментации - началу автолиза культуры. При этом происходит сдвиг рН: закисление культуральной жидкости в период активного роста до 5,5 и увеличение рН до 6,2 в стационарную фазу и фазу лизиса. Синтез и накопление рибофлавина начинался в фазе стационарного роста и увеличивался по мере лизирования культуры до 30 мг/г сухой биомассы. Максимум накопления основного монотерпенового спирта в составе эфирного масла гриба - гераниола - наступал в период между 36 и 48 ч культивирования и составил 25 мг/г сухой биомассы (рисунок). Аналогичным закономерностям подчиняется динамика роста и развития штаммов E. gossypii. Продуктивность E. ashbyi в отношении синтеза эфирного масла при глубинном культивировании на соевой ферментационной среде составляет 99,8...141,1 мг/л, в то время как продуктивность E. gossypii - 565,5 мг/л ароматического продукта.
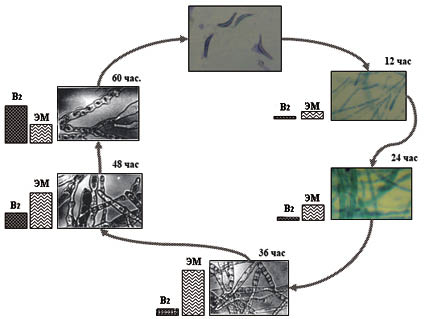
Динамика накопления эфирного масла и рибофлавина в онтогенезе E. ashbyi (периоды культивирования от момента прорастания аскоспор, час.; ЭМ - эфирное масло; В2 - рибофлавин)
С особенностями биосинтетической активности коррелирует формирование и развитие некоторых клеточных структур. В вегетативных гифах суточной глубинной культуры присутствовали липидные тела. Количество их в динамике изменялось параллельно с уровнем накопления компонентов эфирного масла в культуральной жидкости. Выраженная вакуолизация мицелия отмечалась в период 36...48 часов культивирования. Активное спорообразование происходило в стационарной фазе изучаемых продуцентов (48...60 часов роста).
Наиболее продуктивным штаммом вида E. ashbyi является ВКМ F-3009, превосходящий по биосинтетической активности ВКМ F-124 в 1,4 раза, а рода Eremothecium - ВКМ F-3276, активность которого на 29...32 % выше, чем ВКМ F-3009. Поэтому можно рекомендовать E. gossypii ВКМ F-3276 в качестве продуцента для биотехнологического получения натурального ароматического продукта, идентичного розовому эфирному маслу.
Выводы. Для видов E. gossypii и E. ashbyi не выявлено существенных отличий в микроморфологических показателях (форма, размеры клеток и т.п.) и в физиологических оптимумах (рН, температура, аэрация), а также в характере роста на различных питательных средах.
Определены культурально-морфологические и физиолого-биохимические особенности вида E. gossypii: имеет более мелкие по сравнению с E. ashbyi колонии, которые не становятся глянцевыми при культивировании свыше 3 суток, утилизирует в качестве единственного источника углерода и энергии целлюлозу и не усваивает цитраты.
Уровень накопления ароматобразующих веществ E. gossypii существенно выше, по сравнению с E. ashbyi, причем соотношение монотерпеновых спиртов более приближено к содержанию их в розовом эфирном масле.
Список литературы:
- А.с. 1454845 СССР. Штамм гриба Eremothecium ashbyi BKMF-3009Д - продуцент эфирного масла / Семенова Е.Ф., Родов В.С., Бугорский П.С. (СССР) Заявл. 28.07.87. Опубл. 30.01.89, БИ № 4.
- А.с. 1794948 СССР. Штамм гриба Ashbya gossypii BKMF - 3276Д - продуцент эфирного масла / Семенова Е.Ф., Бугорский П.С., Радзимовская С.Б. (СССР). Заявл. 23.08.90. Опубл. 15.02.93, БИ № 6.
- Бугорский П.С., Семенова Е.Ф, Родов В.С. Влияние ионов водорода, калия и натрия на продуктивность гриба Eremothecium ashbyi // Микробиологический журнал, 1990. - Т. 52. - № 3. - С. 44-47.
- О биосинтезе компонентов эфирного масла грибом Eremothecium ashbyi (структурно-функциональные особенности) / А.Н. Погорельская, П.С. Бугорский, Е.Ф. Семенова, Н.П. Бузулукова, Е.И. Горнунг // Вестник Российской академии с.-х. наук. - 2003. - № 1. - С. 83-85.
- Получение и анализ эфирных масел при культивировании некоторых мицелиальных грибов / П.С. Бугорский, Е.Ф. Семенова, В.С. Родов и [др] // Основные направления исследований по интенсификации эфиромасличного производства: тезисы докладов Всесоюзного совещания. - Симферополь, 1985. - Ч. 2. - С. 51-52.
- Практикум по микробиологии / под ред. А.И. Нетрусова. - М.: Академия, 2005. - 608 с.
- Семенова Е.Ф., Бугорский П.С. Некоторые итоги поиска биотехнологически перспективных ароматобразующих культур // Труды ВНИИ эфиромасличных культур. - Симферополь, 1989. - Т.20. - С. 14-16.
- Семенова Е.Ф. Eremothecium ashbyi - перспективный продуцент для биотехнологии эфирных масел // VII съезд Украинского микробиологического общества (тезисы докладов). - Черновцы, 1989. - Ч. 1. - С. 126
- Семенова Е.Ф., Бугорский П.С. Мицелиальные грибы - перспективные культуры для биотехнологического получения ароматических продуктов// V симпозиум «Основные направления научных исследований по интенсификации эфиромасличного производства»: тезисы докладов. - Кишинев, 1990. - С. 88-89.
- Семенова Е.Ф. Биосинтетическая активность и антимикробные свойства Eremothecium ashbyi Guill // Известия вузов. Поволжский регион. - 2007. - Серия «Медицинские науки», № 4. - С. 44-50.
Рецензенты:
Иванов А.И., д.б.н., профессор, зав. кафедрой биологии и экологии ФГОУ ВПО «Пензенская государственная сельскохозяйственная академия», Министерство сельского хозяйства РФ, г. Пенза;
Генгин М.Т., д.б.н., профессор, зав. кафедрой биохимии ГОУ ВПО «Пензенского государственного педагогического университета им. В.Г. Белинского» Министерство образования и науки РФ, г. Пенза.
Библиографическая ссылка
Семенова Е.Ф., Шпичка А.И., Моисеева И.Я. КУЛЬТУРАЛЬНО-МОРФОЛОГИЧЕСКИЕ И ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ ВИДОВ РОДА EREMOTHECIUM S.F.ASHBY ET W.NOWELL // Фундаментальные исследования. 2011. № 6. С. 210-214;URL: https://fundamental-research.ru/ru/article/view?id=21365 (дата обращения: 01.03.2026).



