Характерной особенностью неокостеневших рогов (пантов) оленей является их способность к быстрому росту. Последнее позволяет предположить наличие в пантах специфических ростовых факторов, обеспечивающих не только интенсивную пролиферацию клеток костной, хрящевой и соединительной ткани, но также оказывающих стимулирующее влияние на процессы ангиогенеза, что является необходимым условием адекватного притока кислорода и пластических материалов к растущей ткани. Применяемый в течение длительного времени в медицинской практике пантовый препарат пантокрин является водно-спиртовым экстрактом, приготавливаемым из пантов. Однако при спиртовой обработке экстрагируемые белково-пептидные компоненты могут подвергаться частичной денатурации или конформационным перестройкам, что приведет к изменению их свойств и даже к потере биологической активности. В ООО «Корпорация «СпектрАкустика» разработан препарат пантолен, разрешенный к использованию в качестве биологически активной пищевой добавки (свидетельство о государственной регистрации №77.99.23.3.У.12909.11.06 от 29.11.2006 г. ТУ 9358-001-7596883-2006), содержащий в качестве действующего начала водный пантовый экстракт. Тонкие механизмы биологического действия этого нативного комплекса биологически активных продуктов пока исследованы недостаточно. В связи с этим в настоящей работе поставлена цель изучить влияние водных экстрактов пантов на процессы ангиогенеза.
Методика исследований
Панты оленей, полученные на Алтае, перед транспортировкой в среднюю полосу России подвергались либо заморозке при -18оС либо консервации путем кратковременного погружения в кипящую воду с последующей сушкой в горячем воздушном потоке при температуре 80оС. Водные экстракты получались с использованием оригинальной технологии, обеспечивающей максимальное извлечение и сохранение активных компонентов, содержащихся в исходном сырье. Экстракт, полученный из замороженных пантов, обозначался как ЭЗ, а полученный из пантов, подвергавшихся термической обработке, - как ЭТ. Для изучения процесса ангиогенеза использовались кольцевые препараты аорты мыши [5]. У 8 беспородных белых мышей вырезалась грудная аорта и помещалась в теплую среду Bio-MPM. Фиброзно-жировая ткань вокруг сосуда аккуратно удалялась. Под бинокулярной лупой аорта нарезалась на кольца шириной 0,6 мм. Кольца трижды отмывались в теплой стерильной среде Bio-MPM и помещались в коллагеновый гель, полученный из сухожилий крысиных хвостов по методу [4]. В гель добавлялась среда Bio-MPM (500 мкл) с 1% глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина. Пантовые экстракты, предварительно пропущенные через бактериальный фильтр (0,22 мкм), добавлялись в среду в количестве 1% по объему. В отдельных пробах в качестве стимулятора ангиогенеза использовали ростовой фактор фибробластов (fibroblast growth factor b, bFGF) в концентрации 50 нг/мл. Препараты выдерживались в течение
1 недели при 37оС, 8% СО2 во влажной атмосфере. Смена среды, добавление экстрактов и bFGF производились каждые 2 дня. После указанного периода препараты фиксировались 4% формалином 24 часа и окрашивались 0,02% раствором кристал-виолета в этаноле. Окрашенные препараты фотографировались цифровой камерой, соединенной с микроскопом (увеличение х20). Измерение площади, покрытой новообразованными сосудами (в мм2), проводилось с использованием имидж-анализатора. Содержание латентной и активной форм матриксных металлопротеиназ (ММП-2 и ММП-9) в пантовых экстрактах исследовали методом прямой желатиновой зимографии с предварительным вертикальным электрофорезом [3]. Статистическая обработка полученных цифровых данных проводилась с использованием t-критерия Стьюдента. Межгрупповые различия средних значений показателей считались достоверными при р<0,05.
Результаты исследований
Опыты показали, что в контрольных кольцевых препаратах аорты, не подвергавшихся воздействию пантового экстракта и находящихся в питательной среде в течение недели, отмечался очень слабый рост сосудов, по-видимому, за счет фонового образования ростовых факторов клеточными элементами ткани аорты. Площадь новообразованных сосудов составляла в среднем 0,32±0,08 мм2 (таблица 1). После регулярного добавления в культуральную среду ЭЗ отмечалась заметная интенсификация процесса ангиогенеза и трехкратное увеличение площади новообразованных сосудов (p<0,001) (рис.1). Менее отчетливым стимулирующим эффектом обладал ЭТ. Однако и в этом случае имелось отчетливое (двукратное) увеличение площади новообразованных сосудов по сравнению с контролем (p<0,02). Статистически достоверных различий между выраженностью ангиогенного эффекта ЭЗ и ЭТ выявлено не было (p>0,2), что свидетельствует о наличии сходного стимулирующего влияния на ангиогенез у обоих пантовых экстрактов.
Добавление в питательную среду только ростового фактора (bFGF) без пантового экстракта не вызывало заметной стимуляции ангиогенеза, поскольку bFGF подключается к участию в образовании структур сосудистой стенки на поздних этапах ангиогенеза, когда уже сформирован контур сосуда за счет пролиферации эндотелиальных клеток, первично стимулированной другими ростовыми фактора (в частности, VEGF) [2]. В этой ситуации bFGF повышает митотическую активность и стимулирует функцию фибробластов и тучных клеток, обеспечивающих синтез компонентов экстраклеточного матрикса [1].
Таблица 1. Влияние пантовых экстрактов и bFGF на ангиогенез в опытах на кольцевых препаратах аорты мыши (M ± m)
|
Серия опытов |
Площадь новообразованных сосудов (мм2) |
р |
р1 |
р2 |
р3 |
Контроль |
0,32 ± 0,08 |
- |
- |
- |
- |
|
ЭЗ |
0,96 ± 0,18 |
<0,001 |
|
>0,2 |
|
|
ЭТ |
0,67 ± 0,12 |
<0,02 |
|
|
|
|
bFGF |
0,28 ± 0,09 |
>0,5 |
|
|
|
|
bFGF+ЭЗ |
2,16 ± 0,18 |
<0,001 |
<0,001 |
|
|
|
bFGF+ЭТ |
1,03 ± 0,24 |
<0,001 |
<0,01 |
|
<0,001 |
Примечание: р - достоверность различий с контролем;
р1 - достоверность различий с bFGF;
p2 - достоверность различий между ЭЗ и ЭТ;
p3 - достоверность различий между bFGF+ЭЗ и bFGF+ЭТ.
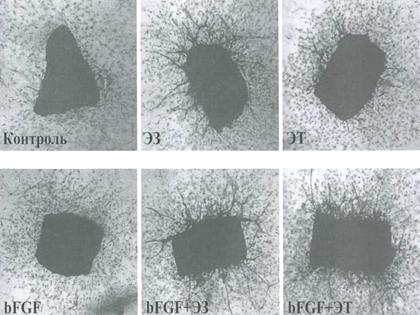
Рис. 1. Стимуляция ангиогенеза в кольцевых препаратах аорты мыши под влиянием пантовых экстрактов
ЭЗ - экстракт, полученный из замороженных пантов;
ЭТ - экстракт, полученный из пантов, подвергнутых тепловой обработке;
bFGF - ростовой фактор фибробластов b.

Рис. 2. Желатиназная активность матриксных металлопротеиназ пантовых экстрактов
Добавление в культуральную среду bFGF вместе с пантовым экстрактом (ЭЗ) вызывало весьма значительное увеличение площади новообразованных сосудов, как по сравнению с контролем, так и по сравнению с влиянием только bFGF (p<0,001). При этом площадь сосудов, по сравнению с контролем, возрастала в 6,5 раз. Ангиогенный эффект при комбинированном использовании bFGF и экстракта ЭТ также был весьма отчетливым: площадь сосудистого русла возрастала в 3 раза по сравнению с контролем (p<0,001). Следовательно, наиболее выраженный ангиогенный эффект наблюдается при совместном действии ЭЗ и bFGF. В данном сочетании ангиогенный эффект ЭТ выражен значительно слабее (p<0,001).
Важными факторами, участвующими в неоангиогенезе, являются протеолитические ферменты, разрушающие компоненты матрикса, облегчающие миграцию клеток и формирование необходимой архитектоники сосудистой сети [6]. В связи с этим далее мы изучили содержание металлопротеиназ в водных пантовых экстрактах (рис.2). Как можно видеть, зимографическая картина в зоне позитивного контроля позволяет четко дифференцировать два типа металлопротеиназ, их латентные (ММП-2 и ММП-9) и активные (ММП-2а и ММП-9а) формы. В пантовом экстракте, полученном из замороженных пантов (ЭЗ), отмечается ярко выраженная активность обоих типов металлопротеиназ. Ферментативная деструкция субстрата выявляется даже в зонах, содержащих неидентифицируемые в данном исследовании белки с большей и меньшей, чем ММП, молекулярной массой. ЭТ обладает очень слабой металлопротеиназной активностью, связанной с наличием только ММП-2 формы, чем, по-видимому, объясняется его менее выраженный ангиогенный эффект.
Следовательно, водные экстракты, полученные из пантов оленей, содержат в своем составе компоненты, обладающие отчетливым ангиостимулирующим эффектом, а также металлопротеиназы, облегчающие ангиогенез. Ангиогенный эффект заметно усиливается при комбинированном использовании экстрактов с bFGF. Обнаружение способности пантовых экстрактов стимулировать процессы новообразования сосудов является основанием для их апробации в качестве стимуляторов репаративной регенерации при различных формах повреждения тканей (травма, рана, язва, ишемия, некроз).
СПИСОК ЛИТЕРАТУРЫ:
- Пальцев М.А., Иванов А.А. Межклеточные взаимодействия. - М.: Медицина, 1995.
- Ferrara N. // Seminars in Oncology. - 2002. - Vol.29, N 6. - P.10-14.
- Liota, L.A., Stetler-Stevenson W.G. // Cancer Biology. - 1990. - №1. - Р.96-106.
- Montesano R., Orci L., Vassalli P. // J. Cell Biol. - 1993. - Vol.97. - P.1648-1652.
- Nicosia R.F., Ottinetti A. // Lab. Invest. - 1990. - Vol.63. - P.115-122.
- Senger D. R. // Amer. J. Path. - 1996. - Vol. 149. - P.1-7.
Библиографическая ссылка
Г.Е. Брилль, В.В. Петров ВЛИЯНИЕ ВОДНЫХ ПАНТОВЫХ ЭКСТРАКТОВ НА ПРОЦЕССЫ АНГИОГЕНЕЗА // Фундаментальные исследования. 2009. № 4. С. 22-25;URL: https://fundamental-research.ru/ru/article/view?id=1890 (дата обращения: 21.02.2026).



