Посттравматические и деструктивные костно-хрящевые дефекты являются наиболее распространенными среди повреждений крупных суставов [3, 4]. Известно, что нелеченое повреждение суставного хряща не способно к самостоятельной регенерации, что приводит к прогрессированию вторичных деструктивных изменений в суставе [1, 2]. Часто заболевают лица наиболее трудоспособного возраста, среди которых высок удельный вес инвалидизации [4]. Существует большое количество различных способов лечения посттравматических и дегенеративных поражений хряща крупных суставов. Важное место среди них занимают операции хондропластики. Однако многими исследовательскими работами доказано, что ткань, образующаяся на месте пластики суставного дефекта, по своим свойствам значительно отличается от нормального гиалинового хряща [3].
В настоящее время для замещения дефектов суставного хряща используется клеточная терапия - трансплантация клеток в зону дефекта с последующим образованием ткани, идентичной по своим цитологическим, цитохимическим и биомеханическим характеристикам истинному суставному хрящу. Однако существуют проблемы выбора источника для получения клеточного материала [1, 4, 6]. Для фиксации культуры хондроцитов в очаге поражения применяют различные биоматериалы, которые должны выполнять, с одной стороны, функцию носителя клеток, а с другой стороны ‒ оказывать влияние на необходимую дифференцировку хондроцитов. Матрицы-носителя, обладающей оптимальными хондроиндуктивными и хондрокондуктивными свойствами, пока не разработано [1, 4, 6]. Таким образом, идеального способа пластики суставных костно-хрящевых дефектов и материала для неё, сочетающего в себе необходимые для регенерации хрящевой ткани свойства до сих пор не найдено. В литературе мало данных, подтверждающих эффективность применяемых методик на основании клинических, морфологических и функциональных методов исследования.
Цель исследования: дать сравнительную морфофункциональную характеристику регенераторного процесса в суставе при пластике костно-хрящевых дефектов комбинированными клеточно-тканевыми трансплантатами, одним бионосителем и без замещения костно-хрящевых дефектов пластическими материалами.
Материалы и методы исследования
Для оценки безопасности и эффективности новой медицинской технологии проводили доклинические исследования in vitro. Эксперименты были выполнены на базе ИЭМБ СамГМУ. Объектом исследования стали кролики породы шиншилла массой 3,5‒4 кг, возрастом 2,5‒3 года. Все исследования осуществлялись в рамках международных рекомендаций по проведению медико-биологических исследований с использованием животных [7]. Эксперимент проводили на 45 животных. Всем кроликам интраоперационно создавали модель двух костно-хрящевых дефектов в области мыщелков бедренной кости на обеих задних конечностях. Под гексеналовым наркозом с помощью зубоврачебного бора при малых оборотах формировали 2 цилиндрических костно-хрящевых дефекта в области внутреннего и наружного мыщелков бедренной кости (рис. 1). Диаметр дефектов был 2,5 мм, глубина - 5 мм.
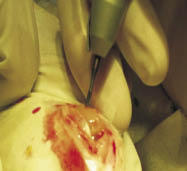
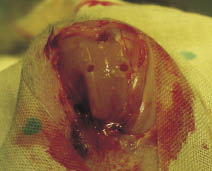
Рис. 1. Создание модели костно-хрящевых дефектов мыщелков бедренной кости
В качестве источника для получения культур хрящевых клеток мы использовали реберную гиалиновую хрящевую ткань. У 15 животных осуществляли забор реберной хрящевой ткани для получения аутологичного клеточного материала. Под гексеналовым наркозом выполняли линейный разрез вдоль нижнего пальпируемого ребра вблизи грудино-реберного сочленения. С помощью острого скальпеля выполняли забор фрагмента реберного хряща размером 0,2×0,1 см.
Для получения комбинированного клеточно-тканевого трансплантата использовали трехмерный резорбируемый наноструктурированный бионоситель - аллогенную деминерализованную спонгиозу, полученную по технологии «Лиопласт»® и культуры клеток из реберного хряща. После совместного культивирования клеток и бионосителя полученный комбинированный транплантат оценивали с помощью общеморфологических методов исследования и растровой электронной микроскопии.
Экспериментальные животные были разделены на три группы. У 14 кроликов сформированные костно-хрящевые дефекты не замещали. У 16 животных дефекты заполняли только бионосителем ‒ аллогенной деминерализованной лиофилизированной спонгиозой, изготовленной по методике «Лиопласт»®. 15 животным проводили пластику дефектов комбинированными клеточно-тканевыми трансплантатами с аутологичными клетками реберного хряща (Патент на изобретение №2383310 от 10.03.2010) [5].
Морфологически исследовали образцы тканей коленного сустава животных в течение 6 месяцев после формирования дефектов суставного хряща. Контролем служили коленные суставы трех интактных животных. В динамике у животных после операции осуществляли оценку клинического состояния, выполняли функционально-диагностические методы обследования, такие как реовазография, термография, рентгенография, компьютерная томография.
С целью объективизации результатов клинического осмотра животных нами была составлена собственная таблица клинических симптомов (таблица).
Схема оценки клинического состояния кролика
|
Клинический симптом |
Степень выраженности |
Оценка |
|
1. Опороспособность нижней конечности |
Полная |
3 балла |
|
Частичная |
2 балла |
|
|
Отсутствует |
1 балл |
|
|
2. Болезненность при пальпации коленного сустава |
Отсутствует |
3 балла |
|
Незначительная |
2 балла |
|
|
Значительная (двигательная и голосовая реакция) |
1 балл |
|
|
3. Отек мягких тканей коленного сустава |
Отсутствует |
3 балла |
|
Периодический |
2 балла |
|
|
Постоянный |
1 балл |
|
|
4. Окружность коленного сустава |
5-7 см |
3 балла |
|
8-10 см |
2 балла |
|
|
11-13 см |
1 балл |
|
|
5. Местное повышение температуры |
Не определяется |
3 балла |
|
Определяется при термографии |
2 балла |
|
|
Определяется пальпаторно |
1 балл |
|
|
6. Ограничение объема движений в коленном суставе |
Отсутствует |
3 балла |
|
Ограничено до 50 % от нормы |
2 балла |
|
|
Ограничено свыше 50 % от нормы |
1 балл |
|
|
7. Сила мышц |
Полная |
3 балла |
|
Снижена до 50 % от нормы |
2 балла |
|
|
Снижена свыше 50 % от нормы |
1 балл |
|
|
8. Гипотрофия мыщц |
Отсутствует |
3 балла |
|
Разница окружности на симметричных участках конечностей до 2 см |
2 балла |
|
|
Разница более 2 см |
1 балл |
|
|
9. Состояние послеоперационной раны |
Рана сухая, швы состоятельны, признаки воспаления раны отсутствуют |
3 балла |
|
Рана сухая, швы состоятельны, имеются признаки воспаления раны |
2 балла |
|
|
Швы несостоятельны, имеется отделяемое из раны |
1 балл |
Мы выбрали несколько признаков, наиболее характеризующих структурно-функциональное состояние нижней конечности кролика. Выраженность симптомов оценивали по трехбалльной шкале 3 балла - функция не нарушена при отсутствии патологических изменений; 2 балла - частичное отклонение показателей от нормы; 1 балл - полное нарушение функции, значительно выраженные патологические изменения. Для формирования контрольной группы проводился осмотр здоровых животных. Средние значения исследуемых показателей принимали за норму функционального состояния нижней конечности (27 ± 0,7 баллов).
Исследование регионарной гемодинамики нижних конечностей животных осуществляли с помощью продольной тетраполярной реовазографии аппаратом «Реоспектр» (рис. 2). Регистрацию вели с симметричных сегментов конечности (нижняя треть бедра и верхняя треть голени). Вычисляли основные реографические параметры: реографический индекс (РИ), амплитудно-частотный показатель (АЧП). За норму принимали показатели РИ = 0,84 ± 0,05, АЧП = 1,11 ± 0,06 [2].

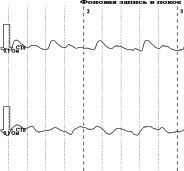
Рис. 2. Запись и пример реовазограммы
Термографию животным выполняли на портативном компьютерном термографе ИРТИС 2000 М, позволяющем визуализировать и регистрировать инфракрасное излучение от поверхности тела с температурным разрешением до 0,01 ºС (рис. 3).
Также в ряде случаев проводили рентгенографию коленных суставов кроликов в рентгенологическом кабинете с помощью аппарата PHILIPS med 10 50 cp (Германия) в прямой и боковой проекциях. Некоторым животным выполняли компьютерную томографию коленных суставов на мультиспиральном компьютерном томографе TOSHIBA Aquilion 32 во фронтальной и сагиттальной плоскостях с толщиной среза 3 мм.
Результаты исследования
Клиническое обследование животных в динамике показало постепенное уменьшение интенсивности болевого синдрома, улучшение опороспособности конечности, увеличение силы мышц, уменьшение гипотрофии, увеличение объема движений в суставах. Однако положительная динамика к 4-й неделе выявлялась ранее в группах с выполнением пластики дефектов бионосителями (19 ± 0,2) и комбинированными трансплантатами (22 ± 0,4). В группе кроликов без замещения дефектов сохранялись гипотрофия конечности, снижение силы мышц, ограничение движений в суставе (14 ± 0,3). Эти показатели немного улучшались к 3-му месяцу (17 ± 0,2). Однако затем наблюдалось ухудшение клинической картины вследствие развития в суставе деструктивных изменений.

Рис. 3. Термограмма кролика (воспалительный процесс в левом коленном суставе)
Тенденция к отрицательной динамике в клинической оценке состояния нижней конечности к завершению эксперимента наблюдалась и в группе животных с пластикой дефектов бионосителем - прогрессировали гипотрофия конечности и ограничение объема движений в суставах - следствие развивающегося остеоартроза.
В группе животных с замещением дефектов комбинированными клеточно-тканевыми трансплантатами на протяжении всего срока наблюдения сохранялась положительная динамика в клинической оценке состояния конечности с приближением к контрольным показателям к концу наблюдения (25 ± 0,3).
У всех животных после выполнения оперативного вмешательства наблюдался местный воспалительный процесс, проявляющийся в локальном повышении температуры тела, регистрируемом при термографии (37,6 ± 0,02 ºС). Длительность воспалительного процесса не имела значительных отличий в исследуемых группах животных. Также на ранних сроках во всех экспериментальных группах после операции наблюдалось повышение реографического индекса (0,94 ± 0,02) и амплитудно-частотного показателя(1,3 ± 0,05), что отражало увеличение величины и скорости притока крови к области оперативного вмешательства, а также увеличение объемного кровотока.
Макроскопическое исследование коленных суставов животных без хондропластики в течение всего динамического наблюдения показало деформацию суставной поверхности обоих мыщелков бедра, что фиксировалось и при выполнении компьютерной томографии области дефектов. Сформированные регенераты не достигали уровня окружающего гиалинового хряща, были тусклыми, серыми. Дефекты заполнялись тканью значительно менее плотной, чем интактный хрящ (рис. 4).
После пластики бионосителем, аллогенной деминерализованной лиофилизированной спонгиозой «Лиопласт»®, макроскопически наблюдали восполнение дефектов, что подтверждалось и при выполнении серийных срезов при компьютерной томографии. Однако регенераты этих зон визуально резко отличались от окружающей интактной суставной поверхности - были шероховатыми и имели серо-бурый цвет.
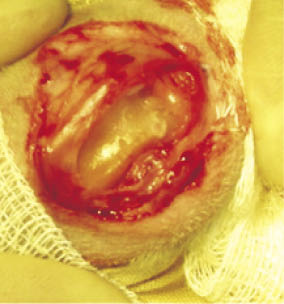
Рис. 4. Дефекты без выполнения пластики спустя 6 месяцев
При исследовании регионарной гемодинамики в группах животных без замещения дефектов и с выполнением пластики одним бионосителем без клеток на поздних сроках отмечалось снижение величины и скорости притока крови, а также объемного кровотока в области коленных суставов. При этом в группе без выполнения пластики дефектов показатели регионарной гемодинамики были особенно низкими (РИ = 0,75 ± 0,07, АЧП = 0,8 ± 0,04). На контрольных рентгенограммах и компьютерных томограммах животных этих групп отмечались признаки прогрессирующего остеоартроза ‒ сужение суставной щели, образование остеофитов.
При применении комбинированных клеточно-тканевых трансплантатов с аутологичными клетками реберного хряща область операции, начиная с 3-го месяца, не отличалась от окружающей суставной поверхности и гиалинового хряща здоровых животных. Ткань регенерата полностью восполняла дефекты, была блестящей, бело-голубого цвета, без визуальных признаков дегенерации. Спустя 6 месяцев в области операции имелась ровная поверхностная зона без видимых изъянов (рис. 5).
Показатели регионарной гемодинамики в этой группе животных после увеличения на ранних сроках наблюдения имели тенденцию к снижению к 1-му месяцу с момента операции. Однако позже наблюдалась положительная динамика с увеличением реографического индекса (0,82 ± 0,02) и амплитудно-частотного показателя(0,96 ± 0,05) и приближением их к нормальным показателям к концу наблюдения. На рентгенограммах и компьютерных томограммах коленных суставов в группе животных с пластикой дефектов комбинированными трансплантатами признаков прогрессирующего остеоартроза не наблюдалось.
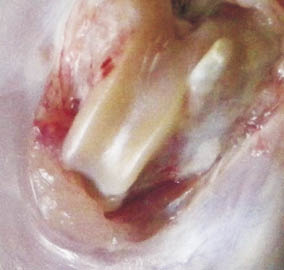
Рис. 5. Область операции спустя 6 месяцев после пластики дефектов
клеточно-тканевыми трансплантатами
Выводы
1. Макроскопическое исследование области костно-хрящевых дефектов без выполнения пластики и с замещением дефектов одним бионосителем показало несостоятельность формирующихся регенератов, приводящую к прогрессированию деструктивных процессов в суставе, развитию остеоартроза, что подтверждается функционально-диагностическими исследованиями.
2. Пластика костно-хрящевых дефектов комбинированными клеточно-тканевыми трансплантатами способствовала восстановлению хрящевой ткани, визуально неотличимой от окружающего гиалинового хряща. Функционально-диагностические методы исследования свидетельствуют об эффективности разработанного способа замещения костно-хрящевых дефектов сустава.
Список литературы
- Деев Р.В. Клеточные технологии в травматологии и ортопедии: пути развития / Р.В. Деев, А.А. Исаев, А.Ю. Кочиш, Р.М. Тихилов // Клеточная трансплантология и тканевая инженерия. - 2007. - Т. II, №4. - С. 18-30.
- Ларцев Ю.В. Новый лечебно-диагностический комплекс для больных гонартрозом: дис. ... д-ра мед. наук. - Самара, 2007. - 349 с.
- Маланин Д.А. Пластика полнослойных дефектов гиалинового хряща в коленном суставе: экспериментальные и клинические аспекты репаративного хондрогенеза: дис. ... д-ра. мед. наук. - Волгоград, 2002. - 513 с.
- Миронов С.П. Использование аутологичных хондроцитов для восстановления поврежденного суставного хряща / С.П. Миронов, Н.П. Омельяненко, Е. Кон, А.К. Орлецкий, И.Н. Карпов, А.П. Курпяков // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2008. - №4. - С. 84-91.
- Способ восполнения дефектов суставного хряща: патент РФ на изобретение №2383310 от 10.03.10 по заявке № 2008149207; Приоритет от 12.12.2008 г. (Россия) / Г.П. Котельников, Л.Т. Волова, Ю.В. Ларцев, В.В. Россинская, Д.А. Долгушкин. Опубликовано 10.03.2010 г. Бюллетень № 7.
- Wakitani S. Human autologous culture expanded bone marrow mesenchymal cells transplantation for repair of cartilage defects in osteoarthritic knee / S. Wakitani, K. Imoto, T. Yamamoto et al. // Osteoarthritis cartilage. - 2002. - Vol. 10, №3. - Р. 199-206.
- Международные рекомендации по проведению медико-биологических исследований с использованием животных, 1985.
Рецензенты:
Чернов Алексей Петрович, д.м.н., лауреат государственной премии РФ, заслуженный врач РФ, профессор кафедры травматологии, ортопедии и экстремальной хирургии. ГОУ ВПО «Самарский государственный медицинский университет», институт экспериментальной медицины и биотехнологий;
Махова Алла Николаевна, д.м.н., старший научный сотрудник, профессор ИЭМБ. ГОУ ВПО «Самарский государственный медицинский университет», институт экспериментальной медицины и биотехнологий.
Библиографическая ссылка
Долгушкин Д.А. МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА РЕГЕНЕРАТОРНОГО ПРОЦЕССА ПРИ ПЛАСТИКЕ СУСТАВНЫХ КОСТНО-ХРЯЩЕВЫХ ДЕФЕКТОВ КОМБИНИРОВАННЫМИ КЛЕТОЧНО-ТКАНЕВЫМИ ТРАНСПЛАНТАТАМИ // Фундаментальные исследования. 2011. № 2. С. 60-67;URL: https://fundamental-research.ru/ru/article/view?id=18538 (дата обращения: 05.01.2026).



