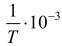Конечной целью любого исследования является реализация в металле опытного образца (изделия), которое дало бы ожидаемый конечный результат, то есть получение качественного продукта. А для разработки опытного образца необходимы исходные данные, которые бы послужили основой для проектирования химического производства. Как показывает практика, основные сложности возникают при анализе физико-химических основ химических процессов. Для этого необходимо определить из множества химических реакций действительно независимые и для них произвести термодинамические расчеты: рассчитать их ΔН (энтальпия), ΔG (энергия Гипса), lgKp (логарифм константы равновесия) в зависимости от температуры [1-3].
Нередко вычисление термодинамических параметров связано со сложными вспомогательными расчетами, занимающими много времени и труда. Расчет термодинамических параметров можно ускорить при использовании приложения Ехсеl. Программа «Расчет равновесия химических реакций в широком интервале температур энтальпийным методом» (на программу расчета получено Свидетельство о государственной регистрации программы для ЭВМ № 2009611006) предназначена для расчета термодинамических параметров химических процессов при постоянном давлении и может применяться при определении возможности протекания процесса, моделировании химического процесса с последующей постановкой эксперимента для определения исходных данных при проектировании аппаратов.
В статье рассмотрен расчет физико-химических параметров процесса удаления солей жесткости с использованием щелочного раствора при использовании энтальпийного метода расчета в редакторе Ехсеl. Процесс удаления солей жесткости необходим как в промышленности, так и в быту, поскольку высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус, и отрицательно сказывается на здоровье человека, а также на теплообменном и массообменном оборудовании. В России, согласно СанПиН, норматив жесткости воды ‒ 7,0 мг-экв/л. По американской классификации (для питьевой воды) при содержании солей жесткости менее 2 мг-экв/л вода считается мягкой, от 2 до 4 мг-экв/л ‒ нормальной (для пищевых целей), от 4 до 6 мг-экв/л ‒ жесткой, а свыше 6 мг-экв/л ‒ очень жесткой.
Таким образом, прежде чем заняться решением проблемы, необходимо рассчитать теоретически, будет ли равновесие реакций удаления солей жесткости с применением щелочной загрузки сдвинуто в сторону образования нерастворимого осадка.
При расчетах термодинамических параметров необходимо знать термодинамические свойства простых веществ каждого участвующего во взаимодействии вещества.
В процессе удаления солей жесткости рассмотрены возможные реакции взаимодействия, и с помощью определителя Грамма установлены независимые реакции:
2НСО3- ↔ СО32- + СО2 + Н2О;
R-CO3 ↔ R-HCО3 + NH3;
2НСO3- + R+ +2Ca+2 + 2OH- ↔ 2СаCO3 + 2H2O + R.
Методика расчета
Остановимся подробнее на методе расчета равновесия, учитывающем зависимость ΔН = f(Т), с помощью которого были введены уравнения lgКр = f(Т), и сосчитаны ΔН, lgКр в интервале температур.
Влияние температуры на константу равновесия описывается уравнением Вант-Гоффа [1].
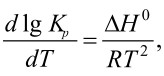 (1)
(1)
где ΔН0 ‒ стандартный тепловой эффект реакции; R ‒ универсальная газовая постоянная; T ‒ температура в 0К; Кр ‒ константа равновесия.
В случае точного расчета учитывается зависимость теплового эффекта реакции от температуры. Для этого используется уравнение Кирхгофа [1]:
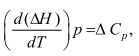 (2)
(2)
где 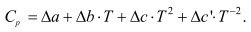 (3)
(3)
Таким образом, получим ΔН = f(Т) в конечной формуле:
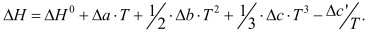 (4)
(4)
Сочетая уравнение (1) с уравнением (4), получим:
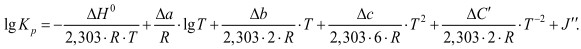
В соответствии с уравнением изобары химической реакции:
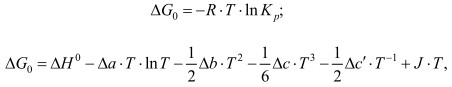 (5)
(5)
где J=4,575 • J´´ в уравнениях 3-5 неизвестными величинами являются Δа, Δb, Δс, Δс´, ΔН298, Δ G298, ΔН0, J, которые находятся в соответствии с уравнениями (2):
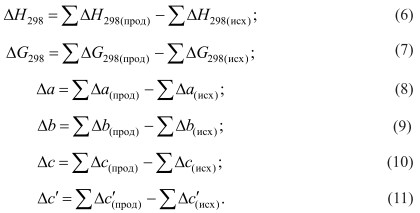
Для нахождения ΔН0, которые являются экстрополяционной константой, подставим в уравнение (4) значения Δа, Δb, Δс, Δс´ при Т = 298 0К и ΔН298 получим в случае высоких температур:
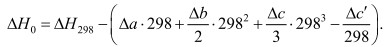 (12)
(12)
Для нахождения J подставим значения ΔН0, ΔG298 и Т = 298 0К в уравнение (5), получим:
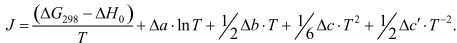 (13)
(13)
На основе проведенных преобразований определяем логарифм константы равновесия:
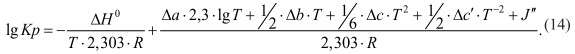 (14)
(14)
В результате расчетов определены термодинамические параметры, характеризующие направление процесса, т.е. ΔН (энтальпия), ΔG (энергия Гиббса), lgKp (логарифм константы равновесия) в зависимости от температуры.
Результаты расчета представлены в табл. 1.
Таблица 1
Результаты термодинамических расчетов для реакций процесса удаления солей временной жесткости
|
Реакция |
ΔН288 кДж/моль |
ΔG288 |
ℓgКр288 |
ΔН298 кДж/моль |
ΔG298 кДж/моль |
ℓgКр298 |
|
1) 2НСО3- ↔СО32- + СО2 + Н2О |
-664,7 |
-703,6 |
127,59 |
-664,8 |
-705,0 |
123,55 |
|
2) (NH4)2CO3 ↔ NH4HCО3 + NH3 |
72,2 |
61,8 |
-11,21 |
72,2 |
61,5 |
-10,77 |
|
3) 2НСO3- +NH4+ + 2Ca+2 +2OH- ↔ 2СаCO3+2H2O+NH3 |
29,5 |
-71,2 |
12,90 |
29,5 |
-74,6 |
13,08 |
При комнатной температуре процесса для реакций (1), (3) значения ΔG имеют отрицательные значения, что свидетельствует о возможности протекания процесса. Осуществление процесса, протекающего по реакции (2), невозможно. Значения lgKp в этом же температурном интервале для реакции 1 и 3 указывают на то, что равновесие химических реакций сдвинуто в сторону образования продуктов реакции (солей жесткости).
Термодинамика указывает на возможность протекания химической реакции, а кинетика ‒ их реальное олицетворение.
Исследование кинетики процесса удаления солей жесткости с применением щелочного раствора при интенсивном перемешивании проводилось с помощью уравнения Казеева-Ерофеева с поправкой Саковича и полученных экспериментальных данных (табл. 2):
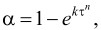 (15)
(15)
где α ‒ степень превращения вещества; k ‒ постоянная, определяющая константу скорости реакции, константа скорости реакции, cогласно поправке Саковича K = n • k1/n ; n ‒ порядок реакции; τ ‒ время контакта.
Таблица 2
Результаты обработки опытных данных по уравнению Казеева ‒ Ерофеева
|
t 0C |
T 0K |
τ |
α |
(1- α) |
lg(1- α) |
lg[-lg(1-α)] |
|
lg τ |
|
15 |
288 |
15 |
0,65 |
0,35 |
-0,4559 |
-0,341 |
3,472 |
1,18 |
|
20 |
0,61 |
0,28 |
-0,5528 |
-0,2574 |
1,30 |
|||
|
45 |
0,72 |
0,39 |
-0,4089 |
-0,3883 |
1,65 |
|||
|
60 |
0,63 |
0,37 |
-0,4318 |
-0,3647 |
1,78 |
|||
|
40 |
313 |
15 |
0,72 |
0,28 |
-0,5528 |
-0,2574 |
3,195 |
|
|
20 |
0,69 |
0,31 |
-0,5086 |
-0,2936 |
||||
|
45 |
0,76 |
0,24 |
-0,6198 |
-0,2077 |
||||
|
60 |
0,69 |
0,31 |
-0,5086 |
-0,2936 |
Учитывая максимальную степень умягчения воды 72 % (полученную опытным путем), определен порядок реакции, что говорит о протекании процесса в диффузионной области.
Согласно уравнению Аррениуса (16) проведен расчет энергии активации процесса удаления солей жесткости для процессов интенсивного перемешивания с добавлением щелочного раствора:
K = K0 • e-E/RT , (16)
где Е ‒ энергия активации; R ‒ универсальная газовая постоянная; Е = 29,5 кДж/моль.
На основе полученных данных предложена методика расчета аппарата в зависимости от интенсивности перемешивания. Схема установки по очистке воды от солей жесткости с применением щелочного раствора и интенсивного перемешивания представлена на рисунке.
В камеру смешения (1) поступает раствор водопроводной воды и из дозатора (2) подается необходимое количество щелочного раствора. Полученный раствор поступает в аппарат интенсивного перемешивания (3), где происходит обработка воды в течение 45 секунд. Затем раствор поступает в камеру отстаивания обработанной воды (4), после чего для удаления образовавшегося осадка раствор проходит через волокнистый полимерный фильтр из полипропилена (5) (ТУ 9081-001-46632946-00), который является хорошим сорбентом для углеводородов, взвешенных веществ, применяется для обезжелезивания, имеет плотность, в 3 раза меньшую, чем песчано-гравийные загрузки, и высокую химическую стойкость. Завершающей стадией является снижение концентрации щелочной загрузки при прохождении раствора через цеолит.
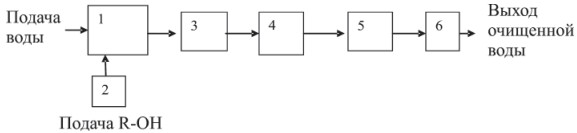
Схема очистки воды от солей жесткости
При реализации в металле опытного образца применим метод геометрического подобия. Для этого используют ряд геометрически комплексов. В случае механического перемешивания в жидкой среде применяется критерий Рейнольдса. В рассматриваемом варианте критерий Рейнольдса находится в диапазоне чисел от 57976 до 597323.
В табл. 3 представлена характеристика аппарата интенсивного перемешивания с лопастной мешалкой для аппаратов по удалению солей жесткости с использованием щелочной загрузки.
Таблица 3
Характеристика аппарата интенсивного перемешивания
|
Тип мешалки |
Характеристика мешалки |
|||
|
D/d |
H/D |
b/d |
S/d |
|
|
Шестилопастная |
2,02 |
0,3 |
0,12 |
0,4 |
Примечание: D ‒ диаметр сосуда; d ‒ диаметр мешалки; H ‒ высота слоя жидкости в мешалки; b ‒ ширина лопасти мешалки; S ‒ шаг винта
В результате проведенных исследований снижение жесткости водопроводной воды происходит на 56-72 % с остаточным содержанием солей жесткости в пределах 1,5-2 мг-экв/л (мягкая вода) при исходной жесткости водопроводной воды 6,27-6,32 мг-экв/л.
Выводы
В результате проведенных вычислений определены независимые реакции и установлена возможность протекания процесса при заданной температуре. Вследствие проведенных вычислений установлены характеристики аппарата интенсивного перемешивания для удаления солей жесткости с применением щелочной загрузки. Установлены критерии, необходимые для снижения солей жесткости на 72 % и соответствующие параметрам мягкой воды.
Список литературы:
- Карапетьянц М.Х. Химическая термодинамика. ‒ М.: Госхимиздат, 1953. ‒ 611 с.
- Мухленов И.П. Расчеты химико-технологических процессов. ‒ М.: Химия, 1982. ‒ 248 с.
Рецензент:
Федорчук Ю.М., д.т.н., профессор кафедры ЭБЖ Института неразрушающегося контроля Томского политехнического университета.
Библиографическая ссылка
Куликова М.В., Прокудин И.А., Буллер А.И., Косинцев В.И., Сечин А.И., Бордунов С.В. АНАЛИЗ ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ УДАЛЕНИЯ СОЛЕЙ ЖЕСТКОСТИ ЭНТАЛЬПИЙНЫМ МЕТОДОМ РАСЧЕТА С ПРИМЕНЕНИЕМ ПРИЛОЖЕНИЯ EXCEL // Фундаментальные исследования. 2010. № 12. С. 105-110;URL: https://fundamental-research.ru/ru/article/view?id=17441 (дата обращения: 13.02.2026).