За последние 20 лет исследователи достигли больших успехов в изучении этиологии и патогенеза вирусного гепатита С. Особенно глубоко и достаточно успешно изучали эпидемиологию этой нозологической формы. Клиника острого, а часто и хронического гепатита С (ХГС) не выражена и весьма детально описана многими клиницистами. Широко используются различные схемы противовирусной терапии, но эффективность их остается не вполне удовлетворительной. До сегодняшнего дня самым малоизученным и недостаточно освещенным аспектом гепатита С остается вопрос прогнозирования: прогноз дальнейшего развития острого гепатита С у конкретных больных, симптоматология и органопатология ХГС в случае его развития, своевременное выявление процессов цирротизации, определение темпов и сроков формирования цирроза печени и варианты его манифестации.
Проблема прогноза была и остается важнейшей при хроническом гепатите, ибо смысл своевременной диагностики фиброза и цирроза печени - повышение вероятности стойкой ремиссии в результате правильно составленной индивидуальной программы терапии (этиологической и патогенетической), в т.ч. достижение необходимой иммуносупрессии.
В последние годы появилось достаточно много исследований, направленных на поиск информативных прогностических критериев, свидетельствующих о возможности и темпах хронизации, фиброзирования и цирротизации печени вирусной этиологии, как инвазивных, так и неинвазивных. Среди них появились и работы, в которых рассматриваются количественные и качественные характеристики тканевых макрофагов. Но они носят пока несистематизированный, больше описательный характер. Между тем, на наш взгляд, это весьма перспективное направление в прогнозировании патологических процессов в печени, особенно если учесть важные, многообразные функции макрофагов, занимающие, возможно, центральное место в печеночном патоморфозе в ходе инфекционного процесса.
О том, что в процессе фиброзирования принимают участие клетки печеночного синусоида известно достаточно давно. Их количественный и качественный состав меняется по мере прогрессирования патологического процесса, в основе которого лежат репаративные механизмы защиты организма. Характеристике, динамике резидентных макрофагов и их участию в формировании фиброза печени на фоне ХГС и посвящена наша работа.
По данным Всемирной организации здравоохранения, вирусом гепатита С инфицировано в мире примерно 170 млн. человек, но также несомненно, что это лишь «айсберг», видимая часть которого является доступной для анализа. Тенденция к росту заболеваемости гепатитом С сохраняется и в Российской Федерации, и в мире в целом до сегодняшнего дня [1,3,4,5].
Возбудитель способен годами, десятилетиями, а вернее всего пожизненно персистировать в организме человека, вызывая многообразие клинических форм и вариантов заболевания, но в то же время одной из главных характеристик этой инфекции является малосимптомное во многих случаях течение. Считается, что ХГС развивается у 75-85% больных, инфицированных HCV. В 18-20% случаев в течение нескольких (до 20-30) лет идет трансформация фиброза в цирроз и далее в печеночную недостаточность либо гепатоцеллюлярную карциному (ГЦК) [17].
Развитие фиброза и цирроза печени традиционно связывают с активацией синтеза коллагена фибробластами. Фиброзирование, или процесс формирования фиброзного рубца - результат превалирования образования внеклеточного матрикса и тканевых коллагеназ над его разрушением, причем известно, что клетки печени, обладающие фиброгенной активностью, гетерогенны [8]. Клетками, непосредственно задействованными в процессе фиброзирования, являются гепатоциты, клетки Купфера, синусоидальные эндотелиоциты, звездчатые клетки печени [ 2,8,18].
Клетки Купфера - специализированные резидентные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы организма, крупные пирамидальные клетки с отростками, с овальным крупным ядром и маленькими выделяющимися ядрышками, с различными функциями от фагоцитоза до продукции цитокинов, запускающих экспрессию белков острой фазы воспаления [6,19]. Клетки Купфера принимают непосредственное участие в патогенезе вирусных гепатитов, стеатогепатита, алкогольного поражения печени, внутрипеченочного холестаза, активации отторжения трансплантанта печени, в фиброгенезе и находятся в ближайшем контакте с кровотоком [ 11,20]. Стимулирующие факторы клеток Купфера являются важными ранними активаторами звездчатых клеток [10].
Одни исследователи устанавливают прямую корреляционную связь между степенью пролиферации резидентных макрофагов и выраженностью фиброза, другие - обратную зависимость [9,10]. Данные по происхождению клеток Купфера также крайне противоречивы [14]. Популяция печеночных макрофагов не принимает прямого участия в фиброзировании органа, но регулирует приток нейтрофилов, которые, возможно, играют важную роль в деградации внеклеточного матрикса [ 12]. Клетки Купфера напрямую стимулируют фиброгенез посредством продукции кислородных радикалов (ROS) и провоспалительных цитокинов, например, TGF-beta, стимулирующего трансформацию звездчатых клеток в миофибробласты на ранних сроках фиброзирования [13,16].
Звездчатые клетки в покоящемся состоянии (клетки Ито, адипоциты) запасают липиды и витамин А и играют важную роль в метаболизме ретиноидов; в условиях хронического поражения печени они подвергаются выраженной фенотипической активации, приобретают фиброзопродуцирующие свойства и становятся основными источниками компонентов внеклеточного матрикса [ 2,7,8].
Сегодня большинство ученых уделяет главное внимание основным продуцентам внеклеточного матрикса и коллагена - звездчатым клеткам. Однако более важными на данном этапе являются изменения, происходящие при фиброзировании в предшествующем активации клеток Ито звене - резидентных макрофагах печени, которые мы описали в клиническом и прогностическом контексте ХГС.
Цель исследования
Выявить дополнительные критерии диагностики и прогноза ХГС в разных группах больных по выраженности пролиферации иммунологически активных резидентных макрофагов и предпринять попытки определения темпов, тяжести и сроков хронизации и цирротизации процесса.
Материалы и методы
В исследование включили 70 пациентов с хроническим вирусным моногепатитом С. У 51 больного в условиях специализированного отделения получали информированное согласие на биопсию печени как компонента рутинного обследования для уточнения патофизиологического диагноза и принятия решения о необходимости назначения специфической терапии ХГС.
Диагноз ХГС был установлен у всех 70 больных на основании клинических, биохимических, инструментальных данных и верифицирован вирусологическими маркерами заболевания после проведенного ПЦР-РНК и исключения других вирусных гепатитов. Среди пациентов было 29 женщин. Средний возраст больных составил 34 года (от 17 до 58 лет).
Обследование больных включало сбор эпидемиологических данных, выяснение анамнеза болезни, описание клинических проявлений инфекции с учетом сопутствующей патологии, определение основных биохимических показателей, выявление антител к неструктурному белку NS3 вируса гепатита С, качественное определение ПЦР-РНК в сыворотке крови больных с генотипированием HCV.
Пациенты с 1 и не-1 генотипом HCV (n=66) распределились поровну, по 33 человека в каждой группе. У 4 больных генотип HCV определен не был.
У 51 пациента проводили прижизненную чрескожную слепую пункционную биопсию печени с последующим морфологическим исследованием биоптата и оценкой индекса гистологической активности (ИГА) и степени фиброза по 4-балльной системе (F0-F4) [ 15]. Парафиновые срезы окрашивали гематоксилином и эозином. Клетки Купфера лучше всего визуализировались при иммуногистохимической окраске по экспрессии рецептора CD68 в 23 препаратах. Исследование проводили в универсальном микроскопе Olympus. Микрофотографии получали с использованием цифровой камеры Olympus и компьютерной программы UTHSCSA Image Tool 3.00. Для иммунодетекции применяли адаптированную методику иммуногистохимических реакций с первичными мышиными моноклональными антителами к CD68 RTU (готовые к использованию) (NovoCastra Lab. Ltd, UK); в качестве вторичных антител - универсальные биотинилированные антитела. Морфометрический анализ состоял в оценке количества клеток Купфера во всем препарате (во всех полях зрения) с вычислением среднего арифметического. При статистической обработке данных вычисляли среднее арифметическое, стандартную ошибку среднего значения. Для оценки средних значений вычисляли критерий Спирмана (r). Всех больных делили на группы 1 и не-1 генотипа HCV, по величине индекса гистологической активности, по выраженности фиброза.
Обсуждение результатов
Базовые характеристики 66 больных с известным генотипом HCV, включенных в исследование, приведены в табл. 1.
Таблица 1
Базовые характеристики когорты исследования после разделения пациентов на группы в зависимости от генотипа возбудителя
|
Пациенты по генотипам HCV
Базовые характеристики |
Пациенты с 1 генотипом HCV (n=33) |
Пациенты с не-1 генотипом HCV (2, 3а) (n=33)* |
Всего (n=66) |
|
Средний возраст, лет (IQR) |
34 (17, 57) |
36 (18, 58) |
34 (17, 58) |
|
Мужчин / женщин |
20/13 |
18/15 |
38 / 28 |
|
Средняя длительность HCV инфекции, лет (IQR) |
10 (1, 30) |
9,5 (1, 42) |
9,5 (1, 42) |
|
Группы риска: - ПИН - гемотрансфузии - операции - стоматология - половой - профессиональный - маникюр - неизвестно |
9 7 5 - 2 - 1 9 |
12 3 5 2 1 2 - 8 |
21 10 10 2 3 2 1 17 |
|
Степень фиброза: F0 F1 F3 F4 |
4 20 2 2 |
3 21 3 2 |
7 41 5 4 |
* генотип 1b+3a и лица без генотипирования в таблицу не включены
В нашем исследовании у 38% больных присутствовали жалобы диспептического и астеновегетативного характера без статистически значимой разницы в симптоматологии у лиц с 1 и не-1 генотипом (p>0,05). Пациентов с жалобами на тяжесть в правом подреберье в группе с 1 генотипом HCV оказалось больше, чем в группе с не-1 генотипом (36% и 39% соответственно). Статистически значимой разницы в клинической картине в группах по генотипу HCV обнаружить не удалось (p>0,05).
Показатели периферической крови мало отличались в группах 1 и не-1 генотипов HCV и находились в пределах нормы. При оценке биохимического анализа крови средняя активность АЛТ в группе 1 генотипа HCV составила 83,4±11,9 Ед/л, в группе не-1 генотипа - 95,6±11,7 Ед/л. Значимой статистической разницы в этих группах не обнаружили (p>0,05).
Как при объективном осмотре, так и по данным УЗ-исследования незначительное увеличение печени нашли у 1/3 пациентов с 1 и не-1 генотипом HCV. Печень была несколько крупнее у больных с не-1 генотипом (в основном 3a) со средним косым вертикальным размером (КВР) 142,2±4,1 мм по сравнению с 141,9±7,5 мм у лиц с 1 генотипом. Гистологически тяжелого стеатоза печени не нашли ни у одного пациента с 1 генотипом HCV, в то время как 4% больных с 3а генотипом возбудителя имели тяжелый стеатоз по данным морфологического исследования (p<0,05). Увеличение селезенки в 2 раза чаще встречали у лиц с не-1 генотипом.
Индекс гистологической активности в среднем в группах 1 и не-1 генотипа составил по 9,1±0,5 баллов в каждой группе, не показав статистических различий (p>0,05).
Среди пациентов с 1 генотипом HCV абсолютное число моноцитов крови коррелировало с активностью АЛТ (p<0,01). В обеих группах больных активность АЛТ была связана статистически значимой связью с несколькими параметрами (индексом гистологической активности (ИГА), выраженностью фиброза и степенью пролиферации резидентных макрофагов, p<0,05).
Выраженную пролиферацию клеток Купфера в 4 раза чаще находили у пациентов с не-1 генотипом HCV (8% против 33%), причем у них же пролиферация была более неравномерной со скоплениями клеток, больше у портальных трактов (33% при 1 генотипе против 57% при не-1 генотипе HCV). Абсолютное число моноцитов периферической крови было выше у больных с более выраженной пролиферацией клеток Купфера (p<0,05), что подтверждает мнение исследователей о моноцитарном происхождении резидентных макрофагов [14].
После проведенных иммуногистохимических исследований на выявление клеток Купфера и активированных звездчатых клеток, оказалось, что у пациентов с 1 генотипом HCV клеток Купфера в среднем в препарате в 2 раза больше, чем у пациентов с не-1 генотипом, что вполне может говорить о более высокой воспалительной активности в печени. Эти данные противоречат морфологическому заключению, где ранее отмечали более высокую пролиферацию клеток Купфера при не-1 генотипе. По-видимому, при морфологическом исследовании все резидентные макрофаги окрашиваются одинаково, а при иммуногистохимическом - лишь те, которые экспрессируют молекулу CD68, причем с разной выраженностью окраски. Возможно, наиболее интенсивно окрашенные макрофаги экспрессируют эту молекулу в большей степени и являются более активными.
При делении всех пациентов по степени пролиферации клеток Купфера получилась следующая картина (p=0,01) (см. табл. 2).
Таблица 2
Абсолютное число лимфоцитов и моноцитов периферической крови у пациентов в группах по выраженности пролиферации клеток Купфера
|
|
Пролиферация клеток Купфера |
||
|
Слабая (n=18) |
Умеренная (n=23) |
Выраженная (n=11) |
|
|
Абсолютное число лимфоцитов, х109/л (интервал) |
2,15±0,12 (1,16-3,06) |
2,00±0,12 (1,02-3,12) |
1,50±0,21 (0,99-2,92) |
|
Абсолютное число моноцитов, х109/л (интервал) |
0,29±0,04 (0,08-0,67) |
0,52±0,04 (0,29-0,96) |
0,43±0,06 (0,10-0,77) |
Из иммуногистохимически окрашенных препаратов биоптатов печени на маркер CD68 взяли 6 первых случайных образцов для оценки (табл. 3). Окраска клеток Купфера моноклональными антителами на CD68 выявила макрофагальные клетки коричневого цвета, различной формы и величины, расположенные как перипортально, так и на периферии препаратов.
Таблица 3
Иммуногистохимический маркер CD68 у 6 пациентов в зависимости от выраженности фиброза печени
|
Клетки Купфера
Фиброз |
Морфологическое исследование |
ИГХ |
|
|
Пролиферация клеток Купфера (КК) |
Характеристика фиброза |
CD68 (клетки Купфера) |
|
|
F0 (n=2) |
Слабая-выраженная |
Нет фиброза |
Большое / огромное количество. Крупные клетки |
|
F1 (n=1) |
Умеренная |
Умеренный, распространенный |
Умеренное количество. Мелкие клетки |
|
F3 (n=1) |
Умеренная |
Умеренный-грубый фиброз |
Умеренное количество. Мелкие клетки |
|
F4 (n=2) |
Слабая / отсутствие КК |
Грубый фиброз с септами, цирроз |
Малое количество / единичные клетки Мелкие клетки |
Первые результаты показали, что чем ниже степень фиброза печени и чем короче время инфицированности гепатитом С, тем выраженнее пролиферация клеток Купфера по экспрессии CD68 и тем слабее активность звездчатых клеток по альфа-гладкомышечному актину. При фиброзе печени F3-F4 клетки Купфера встречались в умеренном или незначительном количестве, а звездчатые клетки наиболее активны при фиброзе F3.
На рис. 1 и 2 показаны примеры иммуногистохимически окрашенных препаратов при различной выраженности фиброза и длительностью инфекции.
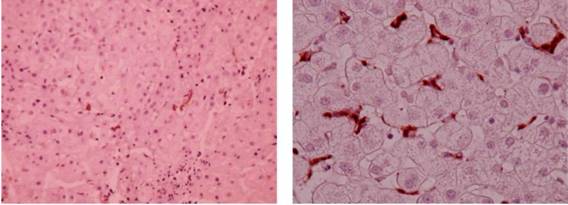
|
Рис. 1. Биоптат печени. Иммуногистохимическая окраска на CD68. Х 100. Пациентка с предположительной длительностью ХГС 4 года, генотипом HCV 3а, фиброзом F4 с числом клеток Купфера 6,53 кл. |
Рис.2. Биоптат печени. Иммуногистохимическая окраска на CD68. Х 200. Пациент с длительностью ХГС более 20 лет и 1b генотипом HCV при отсутствии фиброза F0 с умеренным числом клеток Купфера 10,95 кл. |
У больных с ХГС в печени формируются патологические процессы двух типов. Первый - внутридольковый, связанный с цитопатическим действием и ведущий к цитолизу, и второй - с преимущественной локализацией в портальных трактах, зависящий от циркуляции РНК HCV в крови и связанный с иммуноопосредованным компонентом воспаления, увеличивающимся по мере нарастания длительности инфекционного процесса [ 3]. В наших исследованиях средняя предположительная длительность HCV инфекции была выше у тех пациентов, у которых как клетки Купфера, так и звездчатые клетки локализовались у портальных трактов. Однако статистически значимой связи между этими параметрами установить не удалось (p>0,05). Прямую положительную корреляционную связь нашли между локализацией клеток Купфера и звездчатых клеток (r=0,5; p=0,01). Следовательно, чем больше клеток Купфера располагалось диффузно, тем диффузнее оказалась пролиферация активированных звездчатых клеток и тем менее длительной была инфекция у больных.
Выводы
1. Хронический гепатит С 1 генотипа чаще характеризуется жалобами на тяжесть в правом подреберье, выраженность цитолиза у них прямо коррелирует с абсолютным числом моноцитов и степенью пролиферации клеток Купфера (p<0,05). Максимальная величина индекса гистологической активности также более характерна для лиц с 1 генотипом HCV. Клеток Купфера в численном отношении в группе больных с 1 генотипом HCV встречается почти в два раза больше, чем у больных с не-1 генотипом HCV. Все это позволяет предположить большую воспалительную активность ХГС при 1 генотипе.
2. Для не-1 генотипа HCV характерны больший косой вертикальный размер печени, больший размер селезенки, существенно более выраженный стеатоз, что подтверждается и гистологическими методами исследования. Выраженная пролиферация клеток Купфера чаще всего встречается при 3а генотипе HCV.
3. Во всех группах больных, распределенных по величине индекса гистологической активности, хронический гепатит протекает тем тяжелее, чем выше активность гипертрансфераземии (р<0,05). Причем число клеток Купфера всегда выше у больных с более высоким значением индекса гистологической активности при нормальных значениях активности АЛТ.
4. Во всех группах больных, кроме группы с тяжелыми нарушениями функций печени, имеет место прямая корреляционная связь между абсолютным числом моноцитов периферической крови и числом клеток Купфера, подсчитанных после иммуногистохимической окраски (p<0,05), что подтверждает моноцитарное происхождение резидентных макрофагов и позволяет косвенно судить о выраженности пролиферации резидентных макрофагов в печени по абсолютному числу моноцитов.
5. У пациентов с тяжелым хроническим гепатитом С (по ИГА) пролиферация клеток Купфера тем выше, чем менее выражен фиброз (р=0,02). К тому же длительность инфекции и число резидентных макрофагов связаны отрицательной корреляционной связью (р=0,01).
6. Предположительная длительность инфекции ХГС и выраженность фиброза убедительно статистически значимо не связаны ни в одной группе больных (p>0,05).
7. Морфологическая картина резидентных макрофагов печени при окраске гематоксилин-эозином и при иммуногистохимическом методе окраски различается. Моноклональные антитела окрашивают функционально активные клетки Купфера, в то время как гематоксилин-эозин помогает оценить общую картину и выраженность пролиферации резидентных макрофагов в паренхиме печени. Соответственно, картины при этих исследованиях могут значительно отличаться друг от друга и противоречить друг другу, что следует особо учитывать при интерпретации полученных данных при изучении биоптатов.
Список литературы
- Беляева Т.В. Современное состояние проблемы вирусных гепатитов // Материалы Первого российско-итальянского симпозиума «Вирусные гепатиты: решенные и нерешенные проблемы». - СПб., 2000. - С. 6-8.
- Комарова Д.В., Цинзерлинг В.А. Морфологическая диагностика инфекционных поражений печени: практ. рук-во. - СПб.: Сотис, 1999. - 245 с.
- Лобзин Ю.В., Жданов К.В., Волжанин М.В., Гусев Д.А. Вирусные гепатиты: диагностика, лечение. - СПб.: ООО «Изд-во Фолиант», 2003. - 192 с.
- Рахманова А.Г., Яковлев А.А., Виноградова Е.Н. и др. Хронические вирусные гепатиты и цирроз печени: руководство для врачей. - СПб.: СпецЛит., 2006. - 413 с.
- Сельков С.А., Селькова М.С. Обзор современных методов лабораторной диагностики вирусных гепатитов // Вирусные гепатиты в Российской Федерации 2009. Справочник. - СПб.: НИИЭМ им. Пастера, 2009. - С. 62-73.
- Andus T., Geiger T., Hirano T., Kishimoto T., Heinrich P.C. Action of recombinant human interleukin 6, interleukin 1β and tumor necrosis factor α on the mRNA induction of acute-phase proteins // European Journal of Immunology. - 2005. - Vol. 18 (5). - P. 739-746.
- Balabaud C., Bioulac-Sage P., Desmouliere A. The role of hepatic stellate cells in liver regeneration // J. Hepatol. - 2004. - Vol. 40. - P. 1023-1026.
- Bataller R., Brenner D.A. Liver fibrosis // Clin. Invest. - 2005. - Vol. 115. - P. 209-218.
- Cardoso E.M., Duarte M.A., Ribeiro E., Rodrigues P., Hultcrantz R., Sampaio P., Ehrlich R., Carvalho J., Fraga J., de Sousa M. A study of some hepatic immunological markers, iron load and virus genotype in chronic hepatitis C // J. Hepatol. - 2004. - Vol. 41(2). - P. 319-326.
- Chedid A., Arein S., Snyder A., Mathurin P., Capton F., Naveau S. The Immunology of fibrogenesis in alcoholic liver disease // Archives of Pathology and Laboratory Medicine. - 2004. - Vol. 128 (11) - P.1230-1238.
- Gochee P.A., Jonsson J.R., Clouston A.D., Pandeya N., Purdie D.M., Powell E.E. Steatosis in chronic hepatitis C: association with increased messenger RNA expression of collagen I, tumor necrosis factor-alfa and cytochrome P450 2E1 // J. Gastroenterol. Hepatol. - 2003. - Vol. 18(4). - P. 386-392.
- Harty M.W., Papa E.F., Huddleston H.M., Young E., Nazareth S., Riley C.A., Ramm G.A., Gregory S.H., Tracy T.F. Hepatic macrophages promote the neutrophil-dependent resolution of fibrosis in repairing cholestatic rat livers // Surgery. - 2008. - Vol. 143(5). - P. 667-678.
- Isobe K., Nakayama H., Uetsuka K. Relation between lipogranuloma formation and fibrosis, and the origin of brown pigments in lipogranuloma of the canine liver // Comp. Hepatol. - 2008. - Vol. 12(7). - P. 5.
- Klein I., Cornejo J.C., Polakos N.K., John B., Wuensch S.A., Topham D.J., Pierce R.H., Crispe I.N. Kupffer cell heterogeneity: functional properties of bone marrow derived and sessile hepatic macrophages // Blood. - 2007. - Vol. 110(12). - P. 4077-4085.
- Knodell R.G., Ishak K.G., Black W.C. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis // Hepatology. - 1981. - Vol. 1. - P. 431-435.
- Kolios G., Valatas V., Kouroumalis E. Role of Kupffer cells in the pathogenesis of liver disease // World J. Gastroenterol. - 2006. - Vol. 12(46). - P. 7413-7420.
- Mandell G., Bennett J., Dolin R. Principles and Practice of Infectious Diseases, 6th ed. / Churchill Livingstone. - 2005. - P. 1451-1454.
- Shetty K., Wu G.Y. Chronic viral hepatitis, diagnosis and therapeutics. Clinical Gastroenterology / Humana Press. - 2009. - P.33.
- Sleyster E.C., Knook D.L. Relation between localization and function of rat liver Kupffer cells // Laboratory Investigation. - 1982. - Vol. 47 (5). - P. 484-490.
- Wisse E., Braet F., Luo D., De Zanger R., Jans D., Crabbe E., Vermoesen A. Structure and function of sinusoidal lining cells in the liver // Toxicology and Pathology. - 1996. - Vol. 24. - P. 100-111.
Библиографическая ссылка
А.Г. Шевалдин ХРОНИЧЕСКИЙ ГЕПАТИТ С И РЕЗИДЕНТНЫЕ МАКРОФАГИ ПЕЧЕНИ // Фундаментальные исследования. 2010. № 2. С. 138-147;URL: https://fundamental-research.ru/ru/article/view?id=1660 (дата обращения: 07.03.2026).



