На сегодняшний день актуальным является изучение морфологических критериев, связанных с важнейшими клинико-морфологическими параметрами немелкоклеточного рака легкого (НМКРЛ), выживаемостью больных и способностью с большой долей вероятности прогнозировать течение заболевания. Пролиферация – основополагающий процесс в возникновении и развитии опухоли, а также фактор прогноза ее биологического поведения. На сегодняшний день существуют определенные трудности в достоверной оценке пролиферативного потенциала опухоли, так как пролиферация включает в себя не только количество пролиферирующих клеток (пролиферативная активность, фракция роста), но и скорость прохождения фаз клеточного цикла (продолжительность клеточного цикла).
Для оценки пролиферативной активности общепризнанным и доступным является иммуногистохимическое определение антигена Ki-67. Антиген Ki-67 выявляется в клетках в позднюю G1, S, G2, М фазы, однако функциональное значение этого ядерного белка в процессе пролиферации до конца не известно [1]. Аргирофильные белки, ассоциированные с ядрышкообразующими районами (Ag-ЯОР-белки), являются маркером скорости клеточного цикла. До 75 % окрашивания Ag-ЯОР-белков составляют два главных аргирофильных белка С23 (нуклеолин) и В23 (нуклеофозмин), играющих важнейшую роль в синтезе рибосомальной РНК. Эти белки выявляются в ядрах клеток на протяжении всего клеточного цикла, количественно увеличиваясь в 1,5–3 раза в S- и G2-фазы [2]. Показана обратная зависимость между Ag-ЯОР-белками и длительностью клеточного цикла [3], временем удвоения НМКРЛ [4, 5].
Munakata S. и Hendricks J.B. предложили метод двойного окрашивания на антиген Ki-67 и Ag-ЯОР-белки, позволяющий оценивать активность ядрышковых организаторов (продолжительность клеточного цикла) в пролиферирующих клетках [6]. В мировой литературе работы, посвященные исследованию пролиферативного потенциала опухоли с использованием двойного окрашивания на антиген Ki-67 и Ag-ЯОР-белки, немногочисленны [7-13]. Отсутствуют работы, в которых результаты двойного окрашивания на антиген Ki-67 и Ag-ЯОР-белки оцениваются с использованием компьютерного анализа изображений и во взаимосвязи с клинико-морфологическими параметрами и выживаемостью при НМКРЛ.
Исходя из вышеизложенного целью работы стало исследование Ag-ЯОР-белков в MIB-1 позитивных клетках во взаимосвязи с клинико-морфологическими параметрами и выживаемостью при НМКРЛ.
Материал и методы исследования
Исследованы 207 операционных материалов НМКРЛ, удаленных за период 2007–2009 гг. в Алтайском краевом онкологическом диспансере (случаи с М1 и множественными опухолями исключены из исследования). Средний возраст пациентов составил 59 лет (от 35 до 75 лет), 177 мужчин (86 %) и 30 женщин (14 %). Выполнена лобэктомия 145 пациентам (70 %) и пневмонэктомия 62 пациентам (30 %). Предоперационная химиотерапия и лучевая терапия не проводились. Постоперационная химиотерапия проведена 30 пациентам (14 %), чаще использовались цисплатин и этопозид. Постоперационная лучевая терапия проведена 64 пациентам (31 %), суммарной очаговой дозой 50–60 Гр. Патогистологическая характеристика опухолей определена согласно классификации TNM 7 пересмотра [14] и представлена в таблице.
Кусочки ткани фиксировали 18–24 часа в 10 % нейтральном забуференном формалине. После стандартной проводки операционного материала готовили гистологические срезы толщиной 4 мкм. Препараты окрашивали гематоксилином и эозином, ШИК-реактивом/альциановым синим, по Крейбергу. Для уточнения гистогенеза опухоли и с дифференциально-диагностической целью иммуногистохимическим методом определяли цитокератины 7 (клон SP52), 20 (клон SP33), High Molecular Weight (клон 34βE12), 5/6 (клон D5/16B4) в автоматическом стейнере Ventana XT (контроль окрашивания – эпидермис кожи и слизистая оболочка желудка).
Площадь Ag-ЯОР-белков в MIB-1 позитивных клетках при НМКРЛ.
|
Характеристика |
Количество случаев (абс. (%)) |
Площадь Ag-ЯОР-белков в MIB-1 позитивных клетках (в мкм2) |
|
|
Ме (и.и.) |
p |
||
|
Первичная опухоль Т 1 Т 2-3 Наибольший размер < 3 см > 3 см Лимфатические узлы N 0 N 1-3 Стадия I II-III Гистогенез аденокарцинома плоскоклеточный рак Дифференцировка высокая умеренная-низкая |
55 (27) 152 (73) 87 (42) 120 (58) 132 (64) 75 (36) 107 (52) 100 (48) 94 (45) 113 (55) 52 (25) 155 (75) |
8,95 (7,60–10,91) 11,08 (8,92–13,16) 8,93 (7,60–10,92) 11,60 (9,37–13,42) 9,43 (8,04–11,88) 11,89 (10,37–14,23) 9,35 (7,89–11,87) 11,41 (9,21–13,75) 10,20 (8,79–12,53) 10,58 (8,37–12,69) 8,79 (7,73–10,95) 11,01 (8,97–13,04) |
< 0,001 < 0,001 < 0,001 < 0,001 0,8 < 0,001 |
Из парафиновых блоков забраны столбики ткани иглой-панчером с внутренним диаметром 1,5 мм, на основании просмотра соответствующих гистологических препаратов. Для исключения гетерогенности окрашивания изготовлена тканевая матрица, с которой приготовлены гистологические срезы толщиной 4 мкм. Тканевая матрица окрашена иммуногистохимическим методом, согласно протоколу производителя: стрептавидин-биотиновым методом с первичными антителами к Ki-67 (клон MIB-1, DAKO) и хромогеном – new fuchsin. Перед окрашиванием срезы автоклавировали при 120 °С 20 минут, в 0,01 М цитратном буфере (рН = 6,0). После инкубации с хромогеном срезы отмывали в бидистиллированной воде. Далее срезы окрашивали азотнокислым серебром по одностадийной методике [6, 15]: во влажной камере при 37 °С 19 минут. Докрашивание ядер не проводили, срезы заключали в водную среду Faramount (DAKO). В каждом случае определяли площадь Ag-ЯОР-белков (в мкм2) в ядрах 100 случайно выбранных MIB-1 позитивных клеток с 10–30 цифровых изображений, полученных с соответствующих полей зрения микроскопа при увеличении х1000 (объектив х100, 1.25, oil). Компьютерный анализ изображений проводили в программе ImageJ 1.42. Для исключения ошибки измерений гранулы размером менее 0,1 мкм² исключены из анализа.
Статистический анализ данных осуществляли в программе Statistica 6.0. Так как полученные данные в выборках не соответствовали критериям нормального распределения, то меру центральной тенденции в группах представляли в виде медианы (Ме), а меру рассеяния в виде интерквартильного интервала (и.и.). При проверке статистических гипотез применяли непараметрические методы: однофакторный тест Краскела – Уоллиса, U-тест Манна – Уитни, для определения корреляции – χ2 тест. Определяли общую скорректированную выживаемость больных за пятилетний период после операции, использовали метод Каплана – Мейера, логарифмический ранговый тест, регрессионную модель Кокса. Достоверность полученных критериев оценивали при р < 0,05.
Результаты исследования и их обсуждение
Результат иммуногистохимического окрашивания срезов с первичными антителами MIB-1 и последующей окраской азотнокислым серебром определялся в виде округлых гранул черного цвета (Ag-ЯОР-белки), расположенных на фоне красного ядра (в MIB-1 позитивных клетках) или на фоне коричневого ядрышка или бледно-желтого ядра (в MIB-1 негативных клетках) (рис. 1). Результаты определения Ag-ЯОР-белков в MIB-1 позитивных клетках НМКРЛ во взаимосвязи с морфологическими параметрами опухоли, а также результаты сравнения между этими группами представлены в таблице.
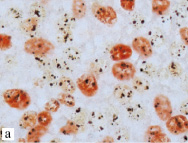
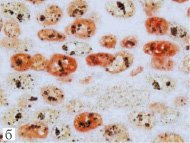
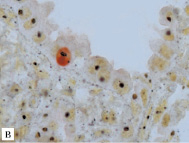
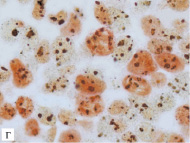
Рис. 1. Аргирофильные белки, ассоциированные с ядрышкообразующими районами (Ag-ЯОР-белки) в MIB-1 позитивных и негативных клетках немелкоклеточного рака легкого: в плоскоклеточном раке с отсутствием (а) и наличием (б) метастазов в лимфатические узлы, в аденокарциноме с высокой (в) и низкой (г) дифференцировкой. Двойная окраска на Ki-67 (клон MIB-1) методом иммуногистохимии и на Ag-ЯОР-белки азотнокислым серебром, х1000
В НМКРЛ площадь Ag-ЯОР-белков в MIB-1 позитивных клетках составила 10,47 (8,57–12,69) мкм². Отмечалось увеличение площади Ag-ЯОР-белков в MIB-1 позитивных клетках в группе Т2-3 по сравнению с Т1. При размере первичной опухоли менее 3 см площадь Ag-ЯОР-белков в MIB-1 позитивных клетках была меньше, чем в опухоли более 3 см. Найдено увеличение площади Ag-ЯОР-белков в MIB-1 позитивных клетках НМКРЛ с наличием метастазов в лимфатические узлы по сравнению с опухолью без метастазов (рис. 1 а, б). Площадь Ag-ЯОР-белков в MIB-1 позитивных клетках меньше в I стадию заболевания по сравнению с II–III стадиями. Отсутствовало отличие площади Ag-ЯОР-белков в MIB-1 позитивных клетках между аденокарциномой и плоскоклеточным раком. Площадь Ag-ЯОР-белков в MIB-1 позитивных клетках больше при умеренной и низкой дифференцировке по сравнению с высокодифференцированной карциномой (рис. 1 в, г). В НМКРЛ площадь Ag-ЯОР-белков в MIB-1 позитивных клетках имела корреляцию с показателем Т (р < 0,001), наибольшим размером опухоли (р < 0,001), показателем N (р < 0,001), стадией заболевания (р < 0,001) и дифференцировкой (р < 0,001).

Рис. 2. График выживаемости по Каплану – Мейеру больных немелкоклеточным раком легкого с небольшой (сплошная линия) и большой (прерывистая линия) площадью Ag-ЯОР-белков в MIB-1 позитивных клетках. По оси абсцисс – время жизни (в днях), по оси ординат – доля выживших больных
Случаи с площадью Ag-ЯОР-белков в MIB-1 позитивных клетках 10,47 мкм² и более считались с большой площадью (101 случай – 49 %), до 10,47 мкм² – с небольшой (106 случаев – 51 %). Общая скорректированная выживаемость больных НМКРЛ за пятилетний период после операции составила 39,3 ± 3,8 %. Выживаемость больных НМКРЛ имела статистически значимое отличие (р < 0,001) в зависимости от площади Ag-ЯОР-белков в MIB-1 позитивных клетках: 61,2 ± 5,4 % – при небольшой площади и 16,2 ± 4,2 % – при большой (рис. 2). При однофакторном регрессионном анализе площадь Ag-ЯОР-белков в MIB-1 позитивных клетках НМКРЛ имела влияние на выживаемость больных (χ2 = 59,9, β = 1,51, стандартная ошибка 0,21, р < 0,001). При проведении многофакторного регрессионного анализа (χ2 = 60,3) влияние на выживаемость больных имели площадь Ag-ЯОР-белков в MIB-1 позитивных клетках (β = 1,05, стандартная ошибка 0,23, р < 0,001), наибольший размер опухоли (β = 0,90, стандартная ошибка 0,33, р = 0,007), показатель N (β = 0,81, стандартная ошибка 0,33, р = 0,01) и гистогенез НМКРЛ (β = 0,22, стандартная ошибка 0,10, р = 0,03).
В нашем исследовании НМКРЛ найдена взаимосвязь площади Ag-ЯОР-белков в MIB-1 позитивных клетках с клинико-морфологическими параметрами по системе TNM: показателем Т, наибольшим размером опухоли, показателем N, стадией заболевания и дифференцировкой опухоли. В других исследованиях также показана взаимосвязь отдельных клинико-морфологических параметров по системе TNM с Ag-ЯОР-белками в MIB-1 позитивных клетках. Yamaguchi S. при НМКРЛ нашел увеличение количества Ag-ЯОР-белков в MIB-1 позитивных клетках при Т4 по сравнению с Т1-3 и при N 2, 3 по сравнению с N 0, 1 [13]. Kidogawa H. с соавторами при раке молочной железы нашли увеличение количества Ag-ЯОР-белков в MIB-1 позитивных клетках в опухоли с наибольшим размером более 2 см по сравнению с опухолью менее 2 см [10]. Tomobe M. с соавторами при раке мочевого пузыря нашли последовательное увеличение количества Ag-ЯОР-белков в MIB-1 позитивных клетках в группах Т1, Т2, Т3 [12]. Однако, результаты в этих работах получены при субъективном анализе (визуальном подсчете количества Ag-ЯОР-белков) в отличие от наших результатов, полученных при объективном анализе (компьютерном программном анализе изображений).
Выживаемость больных НМКРЛ с небольшой площадью Ag-ЯОР-белков в MIB-1 позитивных клетках лучше по сравнению с большой. При проведении одно- и многофакторного регрессионного анализа площадь Ag-ЯОР-белков в MIB-1 позитивных клетках имела независимое влияние на выживаемость больных НМКРЛ. Результаты, аналогичные нашим, получены при исследовании НМКРЛ [9], рака молочной железы [7, 8, 10, 11] и мочевого пузыря [12]. Многочисленные исследования Ag-ЯОР-белков в злокачественных опухолях указывают, что содержание Ag-ЯОР-белков – независимый фактор прогноза [16]. Прогностическая значимость содержания Ag-ЯОР-белков в MIB-1 позитивных клетках взаимосвязана с разными темпами пролиферации НМКРЛ: при большой площади Ag-ЯОР-белков в MIB-1 позитивных клетках – короткий клеточный цикл пролиферирующих клеток и высокая скорость пролиферации и наоборот, при небольшой площади – длинный клеточный цикл пролиферирующих клеток и низкая скорость пролиферации.
Таким образом, площадь Ag-ЯОР-белков в MIB-1 позитивных клетках взаимосвязана с клинико-морфологическими параметрами по системе TNM и выживаемостью при НМКРЛ.
Выводы
1. В НМКРЛ площадь Ag-ЯОР-белков в MIB-1 позитивных клетках взаимосвязана с клинико-морфологическими параметрами по системе TNM: показателем Т, наибольшим размером опухоли, показателем N, стадией заболевания и дифференцировкой.
2. Выживаемость больных НМКРЛ с небольшой площадью Ag-ЯОР-белков в MIB-1 позитивных клетках лучше по сравнению с большой.
3. Площадь Ag-ЯОР-белков в MIB-1 позитивных клетках – независимый фактор прогноза при НМКРЛ.
Рецензенты:
Лепилов А.В., д.м.н., профессор кафедры патологической анатомии с секционным курсом, ГБОУ ВПО «Алтайский государственный медицинский университет», г. Барнаул;
Талалаев С.В., д.м.н., профессор кафедры гистологии, ГБОУ ВПО «Алтайский государственный медицинский университет», г. Барнаул.
Библиографическая ссылка
Кобяков Д.С., Авдалян А.М., Лазарев А.Ф., Лушникова Е.Л., Непомнящих Л.М. ВЗАИМОСВЯЗЬ АРГИРОФИЛЬНЫХ БЕЛКОВ ЯДРЫШКООБРАЗУЮЩИХ РАЙОНОВ В MIB-1 ПОЗИТИВНЫХ КЛЕТКАХ С КЛИНИКО-МОРФОЛОГИЧЕСКИМИ ПАРАМЕТРАМИ И ВЫЖИВАЕМОСТЬЮ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО // Фундаментальные исследования. 2015. № 1-8. С. 1600-1604;URL: https://fundamental-research.ru/ru/article/view?id=38256 (дата обращения: 03.02.2026).



