Ранее проведенные исследования [1, 3-5] показали, что взаимодействие фурфурола 1 с пероксидом водорода в отсутствие электрического тока протекает с преимущественным образованием двух основных продуктов – 2(5Н)-фуранона 2 и янтарной кислоты 3. Кроме того, была установлена зависимость направленности этой реакции от ряда факторов – рН реакционной среды, природы растворителя, типа катализатора и др. [1, 3, 5]. С учетом этого нам представилось интересным выявить особенности реакции альдегида 1 с Н2О2 под воздействием ранее не изученного фактора – постоянного электрического тока. Электрохимические превращения органических веществ, в том числе фурановых соединений, в присутствии пероксида водорода в качестве химического соокислителя ранее не изучались.
Нами установлено, что взаимодействие соединения 1 с пероксидом водорода в условиях анодного окисления заметно ускоряется по сравнению с «бестоковой» реакцией и приводит к преимущественному образованию фуранона 2 и 5-гидрокси-2(5Н)-фуранона 4 [11-13]. Соединения 2 и 4 известны как ценные полупродукты органического синтеза и препараты для фармакологии и сельского хозяйства [6, 8, 14, 15].
С целью получения более полных данных о механизме и синтетических возможностях изучаемого электрохимического процесса нами изучены его особенности в условиях катодного восстановления на графитовых электродах.
Материалы и методы исследования
В качестве анодной и катодной ячеек использовали химические цилиндрические плоскодонные стаканы из термостойкого стекла объемом 150 мл, снабженные герметичными крышками из органического стекла с уплотнением. В крышках предусмотрены пять отверстий для электрода, электролитического ключа, термометра, мешалки и отбора проб.
Для проведения электролиза применяли электроды из прессованного пористого графита сечения квадратной формы и длиной 100 мм.
Перед каждым опытом поверхность электродов обезжиривали и активировали прокаливанием в муфельной печи при 600 °С, после чего зачищали мелкой наждачной бумагой и полировали фильтровальной бумагой. Эта процедура предотвращает нежелательную адсорбцию компонентов реакционной смеси вследствие увеличения шероховатости и площади поверхности графитовых электродов в ходе электролиза [10].
Электролитическим ключом служила стеклянная U-образная трубка, заполненная гелеобразным агар-агаром (3 % масс.) в 1 М растворе NaCl. Электролиз проводили при 50 °С, силе тока 0,01–5 A и постоянном перемешивании реакционной смеси с помощью электрической вертикальной мешалки 8 – ЕR 10, снабженной регулятором оборотов мотора от 10 до 900 об/мин. Исходный католит имел рН около 6,5 с начальной концентрацией соединения 1, равной 1,0 моль/л. Реакцию вели при мольном соотношении альдегида 1 и Н2О2, равном 1:1,6. В этих условиях, как и в ранее изученной анодной реакции [11], достигалось полное взаимное превращение обоих реагентов. В анодную ячейку электролизера помещали 0,1 М раствор LiClO4·3H2O в качестве анолита.
Качественный состав образующихся промежуточных и конечных продуктов устанавливали методом ТСХ на пластинах Silufol в системах: хлороформ; хлороформ – ацетон, 3:1; ацетон – хлороформ, 2:1; толуол – этанол, 20:3. Для обнаружения непредельных соединений пластины обрабатывали раствором KMnO4 в разбавленной HCl. Карбоновые кислоты и пероксиды обнаруживали соответственно с помощью спиртово-щелочного раствора бромфенолового синего и раствора KI соответственно. За расходом фурфурола 1 и образованием продуктов с альдегидной группой следили путем проявления пластин раствором 2,4-динитрофенилгидразина в НCl. В качестве универсального проявителя использовали пары иода.
Для качественного анализа гидроксигидропероксида фурфурола 5 методом ТСХ использовали его предварительно приготовленный эталонный образец [5].
За ходом изучаемой реакции наблюдали по превращению исходных реагентов, образованию промежуточных и конечных продуктов с помощью комплекса физико-химических методов. Количественное определение фурфурола 1 проводили методом УФ-спектроскопии при λmax 278 нм. Общее количество карбоновых кислот, образующихся в ходе реакции, определяли методом кислотно-основного титрования [9]. Суммарное содержание в реакционной смеси перекисных соединений определяли методом иодометрического титрования [2].
Результаты исследования и их обсуждение
В принятых условиях реакционная среда в катодной ячейке гомогенизируется в первые минуты процесса и остается гомогенной до полного расхода реагентов. Как и в случае анодного процесса, изученная реакция протекает без заметного тепловыделения и смолообразования, характерного для «бестокового» окисления фурфурола 1 пероксидом водорода [1, 3, 4]. Показательно, что для завершения катодной реакции требуется больше времени по сравнению с анодной – в указанных условиях полное превращение обоих реагентов достигается соответственно через 11 и 8 ч [11]. Оба процесса характеризуются постоянным снижением рН католита с 6,5 до 2–2,5, что объясняется накоплением кислотных продуктов соответственно в катодной и анодной ячейках.
С помощью метода УФ-спектроскопии получены данные о характере расхода фурфурола 1 в условиях анодной, катодной и «бестоковой» реакции (рис. 1). Из рис. 1 видно, что в отсутствие тока (кривая 1) взаимодействие фурфурола 1 с Н2О2 проходит медленно (общая продолжительность процесса превышает 20 ч) и характеризуется наличием достаточно продолжительного индукционного периода в начале реакции. Через 40 мин реакции расход фурфурола 1 интенсифицируется, что объясняется накоплением карбоновых кислот, ускоряющих его взаимодействие с пероксидом водорода [5].
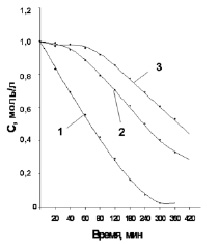
Рис. 1. Кинетические кривые расхода фурфурола 1 в условиях его электрохимических реакций с Н2О2: кривая 1 – анодная реакция; кривая 2 – «бестоковая» реакция; кривая 3 – катодная реакция
В условиях анодного окисления (кривая 2) процесс значительно ускоряется. Период полупревращения альдегида 1 (τ1/2) сокращается в 5 раз (таблица), а общая продолжительность реакции – в 2,5 раза. Что характерно, анодный процесс проходит без индукционного периода, на всем его протяжении наблюдается интенсивный расход фурфурола 1.
В условиях катодного восстановления (кривая 3) начальный индукционный период имеет бόльшую продолжительность по сравнению с «бестоковой» реакцией (кривая 2). Однако в последующем катодная реакция ускоряется и завершается быстрее «бестоковой». В то же время τ1/2 фурфурола 1 в этом случае почти в 4 раза больше по сравнению с анодным процессом.
На основании данных титриметрии построены кинетические кривые расхода Н2О2, накопления и расхода органических пероксидов в условиях катодной и анодной реакций (рис. 2). Из рис. 2 видно, что в первые 3 ч катодной реакции пероксид водорода расходуется малоинтенсивно (кривая 2), тогда как в анодном процессе интенсивный распад Н2О2 происходит на всем протяжении процесса (кривая 1).
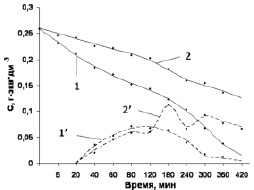
Рис. 2. Кинетические кривые расхода пероксида водорода (кривые 1 и 2), накопления и расхода органических пероксидов (кривые 1’ и 2’) в условиях анодной и катодной реакций соответственно
Ранее было установлено, что на начальной стадии «бестоковой» реакции фурфурола 1 с Н2О2 в условиях кислотного автокатализа образуется гидроксигидропероксид фурфурола (ГГПФ) 5 в качестве первичного ключевого интермедиата [1, 5]. Методом ТСХ нами установлено, что в условиях катодного процесса в системе «фурфурол – Н2О2» через 20 мин реакции, то есть сразу после периода наиболее интенсивного расхода Н2О2, начинают накапливаться органические пероксиды. Наибольшее их содержание в реакционной среде наблюдается в первые 1–3 ч реакции, т.е. в период некоторого замедления расхода пероксида водорода (рис. 2). Методом ТСХ установлено, что основным среди образующихся в катодной реакции органических пероксидов является пероксид 5, что характерно и для анодного процесса [11, 12].
Рис. 3 показывает, что накопление карбоновых кислот в катодном процессе происходит медленнее по сравнению с анодной реакцией (кривые 2 и 1 соответственно). Последняя, как и «бестоковая» реакция, характеризуется интенсивным накоплением кислот с самого начала процесса.
Методами ПМР и ИК спектроскопии установлен состав продуктов реакции фурфурола 1 с Н2О2 в условиях катодного восстановления (таблица). Как оказалось, катодная и «бестоковая» реакции близки по качественному и количественному составу конечных продуктов. В обоих случаях преимущественно образуются фуранон 2 и кислота 3 [1, 5, 11], тогда как основными продуктами анодного процесса являются 5-гидрокси-2(5Н)-фуранон 4 и яблочная кислота 6 [11, 12]. В условиях катодного восстановления и «бестоковой» реакции выходы фуранона 4 и кислоты 6 заметно ниже.
Выводы
Представленные результаты показывают, что изученная нами реакция фурфурола 1 с пероксидом водорода в условиях катодного восстановления близка к «бестоковой» и анодной реакциям по качественному составу промежуточных продуктов. В то же время она существенно отличается от них по скорости и характеру расхода исходных реагентов. Это указывает на возможное изменение механизма реакции при переходе от условий анодного окисления к условиям катодного процесса. Наблюдаемое ускорение анодного процесса по сравнению с «бестоковым» можно объяснить установленным нами образованием свободных радикалов при анодном окислении Н2О2 [12]. Мы также установили, что введение ингибиторов свободно-радикальных реакций в катодный процесс не влияет на скорость превращения фурфурола. Это позволяет предположить, что, по крайней мере, некоторые ключевые стадии катодной реакции сходны по механизму с «бестоковым» процессом. Возможная роль свободных радикалов может проявляться в различной направленности анодного и катодного процессов и, как следствие, в различных выходах основных конечных продуктов 2, 3, 4 и 6.
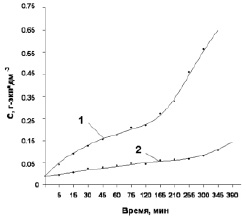
Рис. 3. Кинетические кривые накопления карбоновых кислот в анодной (кривая 1) и катодной (кривая 2) реакциях фурфурола 1 с Н2О2
Результаты реакции фурфурола (Фл) 1 с Н2О2 в различных условиях: [фурфурол]0 = 1,0 моль/л; [фурфурол]0 : [Н2О2]0 : [LiClO4]0 = 1 : 1.6 : 0.1; 50 °С; 0.03 А
|
Тип реакции |
Фл, τ1/2, мин |
Время реакции а, ч |
Выходы продуктов, % |
|||
|
фуранон 2 |
кислота 3 |
фуранон 4 |
кислота 6 |
|||
|
«Бестоковая» |
220 |
20 |
38–42 |
20–22 |
8–10 |
3–4 |
|
Анодная |
45 |
8 |
14–16 |
– |
46–50 |
24–26 |
|
Катодная |
160 |
11 |
36–40 |
21–23 |
11–13 |
9–11 |
Примечание. а определяли на момент полного расхода фурфурола и Н2О2.
Рецензенты:Стрижов Н.К., д.х.н., профессор, Кубанский государственный технологический университет, кафедра стандартизации и сертификации, г. Краснодар;
Кайгородова Е.А., д.х.н., проф., профессор, Кубанский государственный технологический университет, кафедра неорганической и физической химии, г. Краснодар.
Работа поступила в редакцию 17.10.2013.
Библиографическая ссылка
Посконин В.В., Яковлев М.М. ОСОБЕННОСТИ РЕАКЦИИ ФУРФУРОЛА С ПЕРОКСИДОМ ВОДОРОДА В УСЛОВИЯХ КАТОДНОГО ВОССТАНОВЛЕНИЯ НА ГРАФИТОВЫХ ЭЛЕКТРОДАХ // Фундаментальные исследования. 2013. № 10-9. С. 1978-1982;URL: https://fundamental-research.ru/ru/article/view?id=32571 (дата обращения: 13.12.2025).



