Этилендиамин (ЭДА) – вещество, нашедшее широкое применение в народном хозяйстве. Его используют в качестве ингибитора коррозии, из него получают этилендиаминтетрауксусную кислоту, применяемую в производстве комплексонов (трилон Б) и фунгицидов. ЭДА применяют в нефтехимической промышленности при производстве красителей, эмульгаторов, стабилизаторов латексов, антиокислительных присадок к моторным маслам [1].
Производство ЭДА основано на взаимодействии 1,2-дихлорэтана с аммиаком. При этом образуется водный раствор дигидрохлорида этилендиамина (ДХГ ЭДА), который для выделения ЭДА нейтрализуют раствором щелочи:
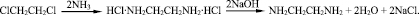
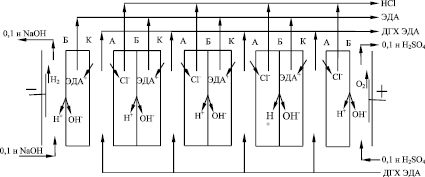
Рис. 1. Схема электродиализного аппарата: К – катионообменная мембрана; А – анионообменная мембрана; Б – биполярная мембрана
Реакционную смесь, содержащую воду, аммиак, хлорид натрия и ЭДА, подвергают выпариванию. Кубовый остаток после выпаривания, содержащий водный раствор хлорида натрия с примесью около 1 % аминов, формирует значительное количество сточных вод производства [2].
При получении 1 т ЭДА, в соответствии со стехиометрией, образуется 2,21 т ДГХ ЭДА. Разрушение образующегося ДГХ ЭДА производится 40 % раствором NaOH, для чего необходимо затратить 3,32 т гидроксида натрия. В результате образуется 1,95 т NaCl. Процесс выпаривания проводят до получения в кубе насыщенного раствора соли. В результате получается 5,42 м3 сточной воды, содержащей насыщенный раствор NaCl и около 1 % аминов, что составляет примерно 54 кг. С учетом ПДК [3] такой сток перед сбросом в водоем необходимо развести почти в 20000 раз. Кроме того, со сточными водами происходит потеря аминов. При условном годовом производстве ЭДА 10000 т потеря аминов ежегодно составит 540 т. Учитывая вышесказанное, необходимо констатировать, что сокращение или полная ликвидация сточных вод производства ЭДА имеет большое значение не только с точки зрения экологии, но и может дать экономический эффект за счет ликвидации потерь аминов со стоком.
В работах [4] показано, что обработка ДГХ ЭДА в трехкамерном электролизере с монополярными мембранами позволяет значительно сократить количество NaOH, затрачиваемое на разрушение ДГХ ЭДА. Это приводит к сокращению как объема стоков, так и потерь аминов со сточными водами. При переработке ДГХ ЭДА в четырехкамерном электролизере с монополярными мембранами возможно получение ЭДА и HCl [5, 6]. В этом случае процесс разрушения ДГХ ЭДА щелочью полностью заменяется на его обработку в мембранном электролизере, что приводит к ликвидации операции выпарки аминов. В этом случае в процессе получения ЭДА ликвидируются сточные воды и потеря аминов с ними. Мембранные электролизеры, рассчитанные на условное годовое производство ЭДА 10000 т с учетом размеров ионообменных мембран, выпускаемых объединенной химической компанией «Щекиноазот» (1420 х 450 мм), должны состоять примерно из 400 секций, включающих 3 или 4 камеры. Конструкция мембранного электролизера типа фильтр-пресса предполагает для разделения секций применение электродов. Следовательно, в таких аппаратах необходимо использование около 200 анодов, состоящих из титана, покрытого окисью рутения (ОРТА) или окисью иридия и окисью рутения (ОИРТА).
Известно [7, 8], что для разделения камер концентрирования кислоты и щелочи в электродиализных аппаратах могут использоваться биполярные мембраны. Это значительно дешевле, чем применение для подобных целей электродов, особенно ОРТА или ОИРТА. В этом случае схематично конструкция электродиализного аппарата выглядит, как показано на рис. 1.
Раствор ДГХ ЭДА прокачивается через камеры электродиализатора, ограниченные катионообменными и анионообменными мембранами. В катодной камере циркулирует 0,1 н раствор NaOH, а в анодной камере – 0,1 н раствор H2SO4. Ионы ЭДА+ в электрическом поле, созданном между катодом и анодом, мигрируют через катионообменные мембраны по направлению к катоду, а ионы Cl- мигрируют через анионообменные мембраны по направлению к аноду. На биполярных мембранах происходит разложение воды с образованием ионов H+ и OH-. Таким образом, в камерах, разделенных биполярными мембранами, должны концентрироваться растворы ЭДА и HCl соответственно.
Для исследования процесса разделения раствора ДГХ ЭДА на ЭДА и HCl, определения величины выхода по току и энергозатрат, а также материального баланса была исследована переработка дигидрохлорида этилендиамина в непроточном электродиализаторе с монополярными и биполярными мембранами (см. рис. 2).
Камеры электродиализного аппарата выполнены из оргстекла в виде отдельных блоков, разделенных катионообменной, анионообменной и биполярными мембранами марки МК-40, МА-40 и МБ-1 соответственно. Рабочая поверхность каждой мембраны равнялась 14,1 см2. В качестве материала катода применяли пластину из нержавеющей стали. Анодом служила титановая пластина, покрытая оксидом рутения.
Раствор ДГХ ЭДА, используемый во всех опытах, содержал 58,6 г/л ЭДА и 71,3 HCl. Перед началом опыта в каждую камеру аппарата заливали по 60 мл растворов, как показано на рис. 2. Растворы 0,1 н NaOH, 0,1 н HCl и 0,1 н H2SO4 были необходимы для создания проводимости в соответствующих камерах. При такой организации процесса после подачи напряжения на электроды, на электродах и биполярных мембранах происходит разложение воды. На катоде выделяется водород и генерируются ионы OH-, на аноде выделяется кислород и генерируются ионы Н+, а на биполярных мембранах вода разлагается с образованием ионов Н+ и OH- (см. рис. 2). В результате должно происходить извлечение ЭДА и HCl из 3 камеры аппарата и концентрирование ЭДА во 2 камере, а HCl – в 4 камере. Опыты проводили при токах, равных 150 мА, 200 мА, 250 мА, 300 мА, 500 мА, что соответствовало мембранной плотности тока 10,6 мА/см2, 14,2 мА/см2, 17,7 мА/см2, 21,3 мА/см2 и 35,5 мА/см2. Количество электричества, пропущенное через электролизер во всех экспериментах оставалось постоянным и равнялось 1 А•ч. После опытов растворы из всех камер аппарата количественно переносились в мерные колбы и анализировались на содержание ЭДА и HCl. Концентрация ЭДА определялась фотоколориметрическим методом с сульфатом меди, а концентрация HCl по ионам хлора – титрованием растворов азотнокислой ртутью с нитропруссидом натрия.
Распределение ЭДА в камерах аппарата после проведения эксперимента, извлечение ЭДА из 3 камеры и погрешность материального баланса представлены в табл. 1. Перед опытами ЭДА в составе ДГХ ЭДА загружался только в 3 камеру электролизера в количестве 3,52 г.
Погрешность материального баланса по ЭДА колеблется от 2,0 % до 6,3 %, что связано в основном с точностью анализа на этилендиамин. Извлечения ЭДА из 3 камеры электролизера определяется количеством пропущенного электричества и не зависит от мембранной плотности тока. Количество ЭДА извлеченного из 3 камеры, изменяется от 34,7 % до 38,1 %. После опыта ЭДА обнаруживается не только во 2 и 3 камерах аппарата, но и в 1 камере. Это указывает на то, что при протекании электрического тока через биполярную мембрану на ней происходит не только разложение воды с образованием ионов Н+ и ОН-, но и перенос ионов ЭДА+ через мембрану по направлению к катоду. Доля ЭДА, перенесенного из 2 камеры аппарата в 1 камеру, лежит в диапазоне от 10 % до 27 %.
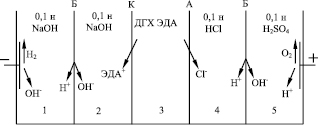
Рис. 2. Схема непроточного электродиализного аппарата
Таблица 1
Материальный баланс аппарата по ЭДА
|
Плотность тока, мА/см2 |
Масса ЭДА, г |
Извлечено ЭДА, |
Погрешность материального баланса, % |
|||
|
1 камера |
2 камера |
3 камера |
г |
% |
||
|
10,6 |
0,10 |
0,94 |
2,26 |
1,26 |
35,8 |
6,3 |
|
14,2 |
0,11 |
1,02 |
2,18 |
1,34 |
38,1 |
6,0 |
|
17,7 |
0,06 |
1,06 |
2,30 |
1,22 |
34,7 |
2,8 |
|
21,3 |
0,25 |
0,93 |
2,18 |
1,34 |
38,1 |
4,5 |
|
35,5 |
0,21 |
0,99 |
2,25 |
1,27 |
36,1 |
2,0 |
Таблица 2
Материальный баланс аппарата по HCl
|
Плотность тока, мА/см2 |
Масса HCl, г |
Извлечено HCl, % |
Погрешность материального баланса, % |
|||
|
3 камера |
4 камера |
5 камера |
г |
% |
||
|
10,6 |
2,95 |
1,35 |
0,04 |
1,33 |
31,1 |
9,6 |
|
14,2 |
2,97 |
1,35 |
0,05 |
1,31 |
30,6 |
9,7 |
|
17,7 |
3,03 |
1,36 |
0,03 |
1,25 |
29,2 |
1,7 |
|
21,3 |
2,99 |
1,37 |
0,04 |
1,29 |
30,1 |
2,2 |
|
35,5 |
2,89 |
1,39 |
0,04 |
1,39 |
32,4 |
4,0 |
Таблица 3
Выход по току и удельные затраты электроэнергии
|
Плотность тока, мА/см2 |
Выход по току HCl, % |
Затраты электроэнергии на извлечение, Вт•ч/г |
|
|
ЭДА |
HCl |
||
|
10,6 |
97,8 |
3,02 |
2,86 |
|
14,2 |
96,3 |
3,89 |
3,97 |
|
17,7 |
91,9 |
5,16 |
5,04 |
|
21,3 |
94,8 |
5,71 |
5,89 |
|
35,5 |
94,8 |
9,84 |
8,99 |
Распределение HCl в камерах аппарата после проведения эксперимента, извлечение HCl из 3 камеры и погрешность материального баланса приведены в табл. 2. Перед опытами HCl в составе ДГХ ЭДА загружался в 3 камеру электролизера в количестве 4,28 г и 4 камеру в количестве 0,22 г. Таким образом, полная масса соляной кислоты в электролизере до опыта составляла 4,50 г.
Так же, как и в случае с ЭДА, влияние мембранной плотности тока извлечение HCl из 3 камеры аппарата не наблюдается. Количество HCl, извлеченной из 3 камеры, изменяется от 29,2 % до 32,4 %. Это немного меньше, чем извлечение из 3 камеры ЭДА. После опыта HCl обнаруживается в 3, 4 и 5 камерах электролизера. Это свидетельствует о том, что через биполярную мембрану происходит перенос ионов Cl- по направлению к аноду. Однако количество HCl, обнаруживаемое в 5 камере аппарата, в среднем в 4,3 раза ниже, чем перенесенное в эту камеру в соответствии с материальным балансом. Это объясняется тем, что при попадании в 5 камеру электролизера ионы Cl- вместе с ионами ОН- разряжаются на аноде с образованием газообразных хлора и кислорода. Поэтому погрешность в материальном балансе электролизера по HCl достигает 9,7 %, что несколько больше погрешности материального баланса по ЭДА.
В табл. 3 представлены выход по току и удельные затраты электроэнергии на извлечение ЭДА и HCl.
Выход по току рассчитывали как отношение массы HCl, извлеченной из 3 камеры электролизера, к массе HCl, которое можно извлечь в соответствии с законом Фарадея [9]. Удельные затраты электроэнергии определяли делением затрат электроэнергии на процесс электрохимической обработки ДГХ ЭДА на массу извлеченных ЭДА и HCl из 3 камеры аппарата.
Выход по току HCl изменяется от 91,9 % до 97,8 % и не имеет какой-либо зависимости от мембранной плотности тока. Анализ процесса извлечения ЭДА из 3 камеры аппарата свидетельствует о том, что в исследуемом растворе этилендиамин находится в виде и двухвалентных, и одновалентных ионов (+NH3CH2CH2NH3+ и +NH3CH2CH2NH3OH). Это следует из значений количества ЭДА, извлеченного из 3 камеры электролизера (см. табл. 1). Расчет количества ЭДА, извлекаемого из 3 камеры аппарата по закону Фарадея, показывает следующее. Если считать, что весь этилендиамин в 3 камере электролизера находится в виде двухвалентного иона ЭДА2+, то количество извлеченного ЭДА должно быть равно 1,12 г. Выход по току в этом случае изменяется от 110 % до 120 %. Если допустить, что этилендиамин в 3 камере аппарата находится в виде одновалентного иона ЭДА+, то количество извлеченного ЭДА должно быть равно 2,24 г. Выход по току в этом случае оказывается достаточно низким (около 54 %), что противоречит значениям выхода по току, определенного по извлеченной HCl. В основу определения соотношения между ЭДА+ и ЭДА2+ в растворе 3 камеры аппарата положили, что выход по току ЭДА должен быть практически равен выходу по току HCl. Из данных табл. 3 видно, что среднее значение выхода по току НСl равно 95,1 %. При этом среднее значение количества извлечено из 3 камеры электролизера ЭДА составляет 1,29 г. Исходя из этих значений выхода по току и количества ЭДА, извлеченного из 3 камеры нетрудно определить соотношение ионов ЭДА+ и ЭДА2+. Получено, что в 3 камере аппарата около 75 % ЭДА находятся в виде одновалентного иона, около 25 % ЭДА находятся в виде двухвалентного иона.
Затраты электрической энергии на извлечение и ЭДА и НСl из 3 камеры электролизера, рассчитанные на 1 г вещества, имеют близкие значения как для ЭДА, так и для НСl. При этом, с увеличением токовой нагрузки на электролизере, затраты электрической энергии на извлечение веществ возрастают. Так при плотности тока на мембранах равной 10,6 мА/см2 энергозатраты составляют 3,02 Вт•ч/г для ЭДА и 2,86 Вт•ч/г для НСl, а при мембранной плотности тока равной 35,5 мА/см2 энергозатраты равны 9,84 Вт•ч/г для ЭДА и 8,99 Вт•ч/г для НСl.
Проведенные исследования показали, что в процессе работы электролизера ЭДА концентрируется во 2 камере, а HCl – в 4 камере аппарата. Однако происходит перенос ионов ЭДА через биполярную мембрану в 1 камеру и перенос ионов HCl через биполярную мембрану в 4 камеру электролизера. Показано, что в растворе ДГХ ЭДА ионы этилендиамина находятся как в одновалентном, так и в двухвалентном виде. Причем ионов ЭДА+ в 3 раза больше, чем ионов ЭДА2+. Выход по току процесса переноса ионов через ионообменные мембраны имеет достаточно высокое значение (в среднем 95,1 %). Затраты электрической энергии на процесс извлечения ЭДА и HCl из 3 камеры электролизера колеблются от 2,86 Вт•ч/г до 9,84 Вт•ч/г в зависимости от токовой нагрузки на электролизере. При этом значительной разницы затрат электрической энергии на процессы извлечения ЭДА и HCl не наблюдается.
В заключение можно отметить, что переработка ДГХ ЭДА в мембранном электролизере с монополярными и биполярными мембранами позволяет получать ЭДА и HCl в различных камерах аппарата. При этом в концентрате ЭДА обнаруживается присутствие HCl, а в концентрате HCl наблюдается наличие ЭДА. Однако для определения состава растворов, генерируемых в камерах концентрирования электролизера, необходимо проведение исследований работы аппарата в проточном режиме.
Библиографическая ссылка
Быковский Н.А., Пучкова Л.Н., Фанакова Н.Н. ПЕРЕРАБОТКА ДИГИДРОХЛОРИДА ЭТИЛЕНДИАМИНА В НЕПРОТОЧНОМ ЭЛЕКТРОДИАЛИЗАТОРЕ С МОНОПОЛЯРНЫМИ И БИПОЛЯРНЫМИ МЕМБРАНАМИ // Фундаментальные исследования. 2018. № 1. С. 7-11;URL: https://fundamental-research.ru/ru/article/view?id=42040 (дата обращения: 20.01.2026).



