Теоретический анализ
На пороге XXI века литиевые аккумуляторы в повседневной реальности стали уверенно теснить традиционные химические источники тока (ХИТ) [1]. Однако использование в них в качестве материала отрицательного электрода металлического лития не получило своего развития вследствие образования на литии при контакте с окружающей средой пассивирующей пленки, а также дендритообразования и инкапсулирования, что неизбежно ведет к снижению коэффициента использования зарядной емкости и срока службы электрода. Более эффективным оказалось использование сплавов лития с более электроположительными металлами (серебро, алюминий, кадмий, магний, свинец, цинк, кремний, сплавы Вуда и другие) [2]. Наиболее перспективным оказался сплав лития с алюминием. Однако из-за низкой морфологической стабильности этот сплав при циклировании довольно быстро разрушается, что также не могло устроить потребителя. Поэтому поиск энергоёмких электрохимических систем с высокой эффективностью циклирования по литию остаётся не менее актуальным и в настоящее время. В настоящее время большая часть работ посвящена разработке способов модифицирования литийсодержащих сплавов, их оксидов и оксофторидов, обеспечивающих стабильность их структуры и, соответственно, их циклируемость. Среди ряда перспективных направлений поиска можно выделить разработку технологий, основанных на активации электродов литиевых аккумуляторов (ЛА) посредством механических, физико-химических и электрохимических способов обработки. Один из наиболее эффективных способов активации связан с появлением нового направления в теории и технологии ЛА – это способ, основанный на использовании метода электрохимического внедрения, который позволяет реализовать высокую циклируемость электродов [3]. Обратимая работа электродов в этом случае обеспечивается благодаря принципиально новому подходу к подбору активных материалов, основанному на том, что в этом случае как положительный (литированные оксиды и оксофториды переходных металлов, так и отрицательный (сплавы лития и его соединения с углеродом) электроды являются своеобразными «резервуарами» для ионов лития, участвующих в переносе зарядов между электродами. При разряде ионы Li+ покидают анод и перемещаются к катоду, где по каналам, туннелям, межслоевым пространствам кристаллической решетки материала катода внедряются в структуру электрода с образованием соединений внедрения LixMeAy (A: O, S, Se…) вследствие изменения валентности потенциалопределяющего переходного металла (Ме: Cr, Ni, V, Mn, Nb, Pb и др.). При заряде ионы лития покидают решетку LixMeAy и восстанавливаются по механизму электрохимического внедрения на отрицательном электроде из сплава лития (LiAl и др.) [4].
Все вышесказанное предопределило цель данного исследования – выявление роли электрохимически активных добавок в электролит и установление закономерностей, обеспечивающих улучшение электрохимических характеристик литированного MnO2 электрода путем модифицирования его по методу катодного внедрения катионов РЗЭ, анионов F- и фуллерена С60, как особой формы углерода, обладающей электрохимической активностью [5]. Это может позволить решить проблему отрицательного влияния процесса диспропорционирования ионов марганца (IV) и связанного с этим искажения кристаллической решетки MnO2 как вследствие возможного влияния эффекта Яна – Теллера [6], так и растворения активного материала катода.
Повышению донорной активности ионов фтора по отношению к ионам лантана и его аналогов должна способствовать достаточно высокая адсорбционная активность высокомолекулярных фуллеренов, их способность переходить в анионную форму и образовывать эндоэдральные (с лантаном и литием) и экзоэдральные (с фтором) соединения [7]. Согласно данным ЯМР и РСА [5], это приводит к росту плотности донорных состояний ионов фтора – в соединении состава C60F18 все ионы фтора размещаются на одной полусфере молекулы С60, что делает возможным существование донорно-акцепторных комплексов с наиболее долгим временем жизни.
Исходя из вышесказанного, исследование влияния добавок фуллерена совместно с ионами фтора в органические апротонные растворы солей лантана и лития на кинетику внедрения ионов La3+ в подрешетку марганца, а также на способность ионов La3+ и Li+ накапливаться во фторированных сферах фуллерена С60 и на электрохимическое поведение модифицированного MnO2-электрода в условиях циклирования, является актуальным.
Материалы и методы исследования
Объектами исследования служили исходные MnO2 электроды, полученные по методике [8] и модифицированные по методу катодного внедрения электроды: LixMnO2, LixLayMn1-yO2, LixLayMn1-yO2(C60)n, LixLayMn1-yO2-σFσ, LixLayMn1-yO2-σFσ(C60)n. Катодное интеркалирование лантана осуществляли из раствора 0,5 М салицилата лантана в ДМФ в потенциостатическом режиме при потенциале Е = –2,9 В (относительно неводного ХСЭ) в течение 30 минут. Выбранная концентрация добавки фторида лития в раствор соли лантана составляла 14 г/л, соответственно фуллерена С60 – 28,1 г/л.
Согласно предварительным исследованиям в растворах соли лантана с добавками фторид-ионов и фуллерена указанных концентраций были зафиксированы наиболее высокие отрицательные значения бестоковых потенциалов модифицированных диоксидномарганцевых электродов, что однозначно указывает на увеличение содержания лантана в них. Поляризационная емкость модифицированных электродов тем более резко меняется в первые 10–20 с, чем ниже концентрация добавки, но при увеличении времени контакта с раствором (t = 20...120 с) перестает зависеть от концентрации добавки и составляет величину ≈ 32 ± 2 Ф/см2, что на порядок выше, чем на начальном этапе (Спол ≈ 2,8 ± 0,2 Ф/см2). При более длительном контакте бестоковый потенциал сохраняет постоянное значение и емкость электрода стабилизируется. Повышение стабильности заряда литированного диоксида марганца при модифицировании, наряду с ионами лантана и его аналогов, фторид-ионами и фуллереном при потенциалах катодного внедрения щелочного металла согласно [7], обусловлено образованием на поверхности MnO2 электрода слоя оксофторидов типа MnO2-σFσ, которые отличаются высокой стабильностью структуры и явно выраженной устойчивостью к восстановительным процессам. Значительное накопление ионов в междоузлиях и возможность их диффузии внутри кристаллической решетки по вакансионному механизму [9] создают благоприятные условия для захвата фторид-ионов кубическими центрами ионов La3+ и переходом последних в тетрагональную форму.
Значительное смещение бестокового потенциала модифицированных LayMn1-yO2-δFδ и LayMn1-yO2(С60)n электродов и уменьшения разрядной емкости c введением в раствор соли лантана добавок фторид-ионов и фуллерена в область более отрицательных значений благодаря электрокаталитическому действию фторид-ионов и фуллерена на процесс внедрения ионов лантана и лития и на емкость MnO2-электрода по лантану и литию согласуется с результатами сканирующей электронной микроскопии, согласно ранее полученным спектрам характеристического излучения (рис. 4) [10].
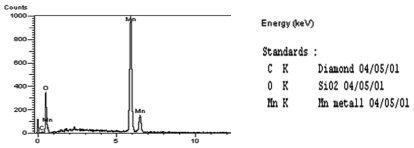
а)
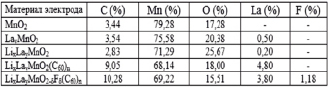
б)
Рис. 1. а) Спектр характеристического излучения материала исходного MnO2 , б) элементный состав: MnO2, LaxMn1-yO2, LayMn1-yO2-δFδ, LayMn1-yO2(С60)n, LayMn1-yO2-δFδ(С60)n электродов
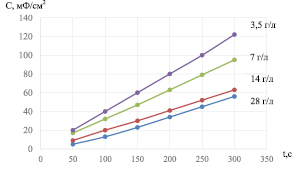
Рис. 2. Зависимость поляризационной ёмкости модифицированной LayMn1-yO2(С60)n.электрода при разряде в бестоковом режиме от содержания фуллерена в электролите
На гальваностатических кривых разряда (рис. 4) можно видеть три задержки потенциала. Характерно, что во всех случаях наибольшая емкость электрода достигается, когда модифицирование лантаном проводили из раствора салицилата лантана с добавками фторид-ионов и фуллерена. Значения емкости при заряде и разряде разработанных на основе MnO2 модифицированных электродов приведены в таблице.
Обобщение полученных данных позволяет предложить следующую схему электрохимических превращений на электродах MnO2, LayMn1-yO2, LayMn1-yO2-σFσ, LayMn1-yO2(С60)n, LayMn1-yO2-σFσ(С60)n в лантан- и литий – содержащих электролитах с добавками фуллерена С60 и фторид-ионов:
yLa3+ + ye- → yLa2+, (1)
yLa2+ + 2ye- → Lay0 (Mn1-yO2), (2)
yLa2+ + 2ye- + MnO2 → LayMn1-yO2, (3)
xLi2+ + LayMn1-yO2 → LixLayMn1-yO2, (4)
zLa2+ + 2zе-+C602- → LazC60, (5)
δF- + C60 → C60Fδ-, (6)
LazC60 + δF- + δLi+ → LiδLazC60Fδ-. (7)
Значения удельной емкости заряда/разряда до – (0,20 ± 0,05) В от номера цикла в гальваностатическом режиме при (ip = 0,05 мA/см2)
|
Электрод |
Номер цикла, N |
Удельная разрядная емкость Qp, мАч/г |
Удельная зарядная емкость Qз, мАч/г |
Отдача по емкости, % |
|
LiхMnO2 |
1 |
218,7 |
240,0 |
91,1 |
|
5 |
128,4 |
240,0 |
53,5 |
|
|
10 |
39,3 |
240,0 |
16,4 |
|
|
100 |
20,0 |
240,0 |
8,3 |
|
|
LiхLayMn1-yO2-σFσ(C60)n |
1 |
180,6 |
240 |
75,2 |
|
5 |
141,4 |
240 |
58 |
|
|
10 |
50,6 |
240 |
21,1 |
|
|
100 |
40,8 |
240 |
16,8 |
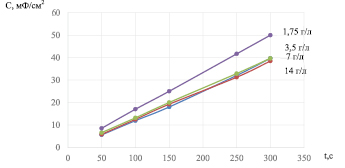
Рис. 3. Зависимость поляризационной ёмкости модифицированного LayMn1-yO2-σFσ электрода при разряде в бестоковом режиме от концентрации фторид-ионов в электролите
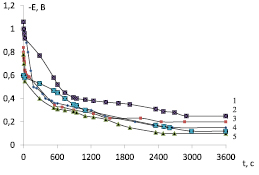
Рис. 4. Гальваностатические кривые разряда модифицированных диоксидномарганцевых электродов в растворе 0,8М LiClO4 в смеси ПК+ДМЭ (плотность тока i = 0,05 мА/см2): 1 – LixLayMn1-yO2-σFσ(C60)n; 2 – LixLayMn1-yO2(C60)n; 3 – LixLayMn1-yO2-σFσ; 4 – LixLayMn1-yO2; 5 – LixMnO2
Результаты исследования и их обсуждение
Анализ результатов циклирования разработанных электродов в гальваностатическом режиме показал, что после 50 цикла и далее до 100 (таблица) емкостные характеристики электродов перестают меняться, но влияние состава электролита модифицирования сохраняется: емкость возрастает в ряду
LixMnO2 < LixLayMn1-yO2 < LixLayMn1-yO2(C60)n < < LixLayMn1-yO2-δFδ  LixLayMn1-yO2-δFδ(C60)n.
LixLayMn1-yO2-δFδ(C60)n.
В потенциодинамическом режиме (80 мВ/c) плотность тока при смещении потенциала от –1 до –4 В на первом цикле повышается от 2,5 до 18 мА/см2. На 100 цикле она снижается до 0,5 мА/см2 при –1 В, а при –4 В составляет ≈ 4 мА/см2.
Можно сделать вывод, что наибольшая отдача по емкости, наименьшая скорость деградации характерна для исследуемых образцов, модифицированных лантаном в электролите, содержащем соль лантана одновременно с добавками фторида лития и фуллерена. Полученные нами данные по влиянию добавок фуллерена и фторид-ионов в электролит лантанирования при модифицировании MnO2-электрода лантаном на стадии предобработки позволяет получать материалы с наименьшими ограничениями по диффузии лития, с большой токопроводимостью и наименьшим сопротивлением для последующего процесса интеркалирования-деинтеркалирования ионов лития позволяет говорить об эффективности введения добавки фуллерена в сочетании с фторид-ионами в электролит лантанирования на стадии предобработки как обеспечивающего наиболее высокую сохранность заряда и увеличение длительности циклирования электрода разработанного состава.
Библиографическая ссылка
Гусева Е.С., Попова С.С., Францев Р.К. ВЛИЯНИЕ ДОБАВОК В НЕВОДНОМ ЭЛЕКТРОЛИТЕ НА ПРОЦЕСС ЭЛЕКТРОХИМИЧЕСКОГО МОДИФИЦИРОВАНИЯ MNO2-ЭЛЕКТРОДА // Фундаментальные исследования. 2017. № 11-1. С. 53-57;URL: https://fundamental-research.ru/ru/article/view?id=41897 (дата обращения: 02.07.2025).



