На современном этапе развития техники все более актуальными становятся вопросы получения новых материалов с заданными эксплуатационными характеристиками. К числу таких материалов относятся оксидные соединения переходных элементов. Они находят широкое применение в различных областях: от магнитных материалов до катализаторов. Наряду с интенсивным развитием технологий синтеза новых соединений остро встает вопрос обеспечения экологической безопасности химических производств. В частности, в российской [1–5] и зарубежной [13–16] литературе активно обсуждается проблема каталитического окисления органических соединений пероксидом водорода. Так, в [4] приводятся данные о процессе Фентона на катализаторах, полученных на основе перовскитов, содержащих лантаноиды. Максимальная степень деструкции органического вещества достигает 60 %. Такие материалы предлагают использовать в процессах водоподготовки. В [1] приводятся данные о высокоэффективном процессе окислительной деструкции индигокармина системами Раффа или Фентона, что может выступать альтернативой биодеградации.
Метиловый оранжевый относится к синтетическим органическим красителям группы азокрасителей, класс опасности 6.1 (токсичные вещества). Вопросам очистки водных растворов от примеси таких соединений посвящен ряд публикаций [10, 12, 13, 15].
Целью настоящего исследования являлось изучение возможности применения оксидных соединений переходных металлов, в том числе синтезированных, в процессах окислительной деструкции метилового оранжевого в присутствии пероксида водорода.
Материалы и методы исследования
Для проведения исследования были использованы оксиды MnO2 квалификации «хч» и Fe2O3 квалификации «ч» для ферритов.
Образцы ферритов-хромитов никеля-меди с общей формулой Ni0,3Cu0,7Fe0,6Cr1,4O4 были получены из оксидов никеля (II) (0,3 мол. %), меди (II) (0,7 мол. %), железа (III) (0,3 мол. %), хрома (III) (0,7 мол. %) в стехиометрическом соотношении. Синтез осуществляли по керамической технологии [11]. Фазовый состав образца изучали на рентгеновском дифрактометре STOE IPDS II, использовали Cu-Kα излучение. Уточнение структуры фаз, входящих в образцы, проводили по рефлексам 220, 311, 222, 422, 333, 440, 533 для фазы кубической шпинели, 006 и 012 для хромита меди (I) в ромбоэдрической симметрии (параметры ячейки рассчитывали в гексагональной установке). Фотографии образцов были получены на сканирующем электронном микроскопе на базе Дрезденского технического университета.
Изучение каталитической активности синтезированных материалов проводили на модельном растворе метилового оранжевого с концентрацией 40 мг/л. При этом 10 мл исходного раствора метилового оранжевого помещали в плоскодонную колбу, добавляли 0,0010 г катализатора и 2 мл раствора пероксида водорода с концентрацией 3 % (мас.). Определение концентрации метилового оранжевого в растворе проводили фотокалориметрическим методом с помощью прибора КФК-2-УХЛ 4,2 через определенные интервалы времени. Расчет количества метилового оранжевого, подвергшегося каталитической деструкции (Р), проводили по формуле
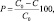
где С0 – начальная концентрация раствора, мг/л; С – текущее значение концентрации раствора, мг/л.
Результаты исследования и их обсуждение
Синтез образца. Синтез был осуществлен из оксидов никеля (II), меди (II), железа (III), хрома (III) в соотношении, отвечающем составу твердого раствора Ni0,3Cu0,7Fe0,6Cr1,4O4. Исходные вещества гомогенизировали в агатовой ступке в присутствии этилового спирта. Далее смесь оксидов брикетировали в таблетки под давлением 15 кПа и подвергали термообработке при температуре 900 °С. На рентгенограмме синтезированного образца (рис. 1) выявлены линии, соответствующие твердому раствору, кристаллизующемуся в структуре кубической шпинели, и линии, характеризующие фазу состава CuCrO2 (Cu2Cr2O4), кристаллизующуюся в ромбоэдрической симметрии. В соответствии с результатами гармонического анализа сложных профилей линий можно предположить следующий фазовый состав образца: 3 % – фаза делафоссита CuCrO2 (Cu2Cr2O4) (рассчитанные параметры решетки aр = 0,2982 нм, cр = 1,7111 нм), 97 % – твердый раствор примерного состава Ni0,31Cu0,66?0,03Fe0,62Cr1,38O4, содержащий, по-видимому, вакансии в решетке шпинели (рассчитанный параметр решетки aк = 0,8326 нм).
На рис. 2 приведена микрофотография образца. Видно, что структура материала хорошо окристаллизована, можно выделить кристаллы размером 140 нм – 2 мкм.
Обсуждение результатов. Образование делафоссита может протекать по реакции разложения хромита меди (II), предложенной в [16]:
CuCr2O4 + CuO = Cu2Cr2O4 + 1/2 O2.
Авторы этой работы отмечают, что процесс протекает при нагревании реакционной смеси выше 850 °С в течение более 70 часов. В свою очередь, образование хромита меди (II) протекает в ходе твердофазной реакции между оксидами меди и хрома:
CuO + Cr2O3 = CuCr2O4.
Следует предположить, что параллельно протекает реакция образования феррита никеля (II):
NiO + Fe2O3 = NiFe2O4.

Рис. 2. Микрофотография шпинели
Процесс формирования фаз завершается реакцией:
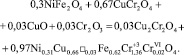
При этом, по-видимому, часть катионов хрома переходит из трехвалентного в шестивалентное состояние. При составлении уравнения этой реакции авторы исходили из необходимости получения формульной единицы шпинели общего состава АВ2О4.
На свойства шпинелей существенное влияние оказывает распределение катионов по кристаллографическим позициям (параметр обращенности λ – количество катионов Ме3 + , занимающих тетраэдрические позиции решетки). Параметр обращенности полученной шпинели λ ≈ 0,42 рассчитан с использованием понятия кластерных компонентов в соответствии с методикой, описанной в [6], по формуле
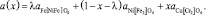
Здесь х – параметр состава твердого раствора феррита-хромита никеля-меди Ni 1–x CuxFe2(1–x) Cr2xO4, в рассматриваемом случае x = 0,7 (твердый раствор имеет формулу Ni0,3 Cu0,7 Fe0,6 Cr1,4 O4). Параметры решеток «идеализированных» нормальных феррита никеля (II) 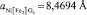 , хромита меди (II)
, хромита меди (II) 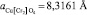 и обращенного феррита никеля (II)
и обращенного феррита никеля (II) 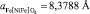 рассчитывали по методике, приведенной в [7], с учетом анион-анионного взаимодействия.
рассчитывали по методике, приведенной в [7], с учетом анион-анионного взаимодействия.
Распределение катионов можно представить следующим образом:
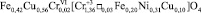 .
.
При этом использованы следующие допущения:
1. Катионы распределяются с учетом энергии стабилизации ионов по узлам кристаллической решетки [7].
2. CrVI располагается в центре кислородного тетраэдра.
3. Вакансии занимают октаэдрические позиции в решетке шпинели, аналогично наблюдаемому для γ-Fe2O3 [8].
Изучение каталитической активности синтезированных материалов проводили на примере реакции окислительной деструкции метилового оранжевого в присутствии пероксида водорода. В ходе проведенного исследования установлено, что материалы, содержащие в составе Fe3+, проявляют каталитическую активность в реакции Фентона. Временная зависимость количества метилового оранжевого, подвергшегося каталитической деструкции, приведена на рис. 3.
При введении в систему в качестве катализатора MnO2 наблюдали интенсивное разложение пероксида водорода, сопровождающееся обильным газообразованием. Процесс разложения пероксида водорода завершается в течение 1 часа. За это время количество метилового оранжевого, подвергшегося каталитической деструкции, составило порядка 5 % и далее не менялось. Полученный результат представляется особенно интересным, поскольку контрольный образец раствора, содержащий органический краситель и пероксид водорода (рис. 3), подвергается постепенной деструкции, по-видимому, под действием света. Следует предположить, что введение в систему катализатора способствует интенсивному разложению пероксида водорода и тем самым выводит окислитель из системы.
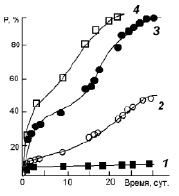
Рис. 3. Зависимость степени разложения метилового оранжевого от времени протекания реакции: 1 – в присутствии MnO2; 2 – без катализатора; 3 – в присутствии Fe2O3; 4 – в присутствии Ni0,3Cu0,7Fe0,6Cr1,4O4
Как видно из рис. 3, зависимость количества красителя, подвергшегося деструкции, для Fe2O3 и Ni0,3Cu0,7Fe0,6Cr1,4O4 имеет вид кривой, характерной для адсорбции молекул непористым твердым телом. Относительно невысокая скорость реакции для исследованных систем может быть связана с повышенной кристалличностью материала и, вследствие этого, малым количеством активных центров.
В случае применения в качестве катализаторов синтезированных сложных оксидных систем Ni0,3Cu0,7Fe0,6Cr1,4O4 скорость процесса оказывается выше приблизительно на 35 % по сравнению со скоростью реакции с участием оксида Fe2O3. Такой результат может быть связан с наличием катионов в тетраэдрических позициях решетки шпинели (Fe2O3 имеет структуру шпинели, в которой тетраузлы вакантны [8]). Энергия связи металл – кислород для А- и В-позиций шпинельной решетки различна [9], что, по-видимому, и приводит к снижению энергетического барьера протекания рассматриваемого каталитического процесса.
Таким образом, согласно результатам проведенного исследования, в случае применения Fe2O3 и синтезированного феррита-хромита никеля (II) – меди (II) в процессе окислительной деструкции метилового оранжевого в присутствии пероксида водорода удается достичь практически полного удаления (степень деструкции достигает 98 %) органического вещества из водного раствора. Полученные результаты могут служить ориентиром для выбора материалов, перспективных для применения в системах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
Выводы
Изучен процесс формирования структуры шпинели в системе состава Ni0,3Cu0,7Fe0,6Cr1,4O4, его фазовый состав и морфологические особенности. Рассмотрена возможность применения ряда оксидов переходных элементов и полученной шпинели для процесса окислительной деструкции метилового оранжевого в присутствии пероксида водорода. Высказано предположение о связи количества катионов Fe3+ в тетрадрических позициях решетки шпинели (параметра обращенности) и каталитической активности материала. Установлено, что введение в систему метиловый оранжевый – пероксид водорода диоксида марганца MnO2 способствует интенсивному разложению Н2О2 и выведению его из системы, что приводит к прекращению реакции окислительной деструкции метилового оранжевого. Полученные результаты могут быть полезны для выбора материалов, пригодных в процессах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
Библиографическая ссылка
Зеленская Е.А., Чернышев В.М., Шабельская Н.П., Сулима С.И., Сулима Е.В., Семченко В.В., Власенко А.И. ИЗУЧЕНИЕ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ОКСИДОВ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ В РЕАКЦИИ РАЗЛОЖЕНИЯ ПЕРОКСИДА ВОДОРОДА // Фундаментальные исследования. 2016. № 4-2. С. 261-265;URL: https://fundamental-research.ru/ru/article/view?id=40164 (дата обращения: 24.01.2026).



