В предыдущих наших исследованиях [1, 7] было отмечено, что в периферической крови кроликов, как в норме, так и в эксперименте, циркулировало некоторое количество деструктивных лейкоцитов, которые отражали резорбтивную фазу физиологической, а также репаративной регенерации белой крови. Разные формы деструктивных лейкоцитов обуславливались, во-первых, преобладанием одного из стереотипных процессов клеточной альтерации – коагуляции и колликвации, а во-вторых, неравномерным распадом ядра и цитоплазмы. Существовала прямо пропорциональная зависимость между числом деструктивных лейкоцитов в циркулирующей крови и лейкоцитарной реакцией. Усиление регенерации белой крови сопровождалось повышением числа деструктивных лейкоцитов. Некробиозу лейкоцитов предшествовали дистрофические изменения внутриклеточных структур. Наиболее ранние деструктивные изменения возникали в митохондриях и эндоплазматическом ретикулуме. Однако определенные дистрофические изменения в лейкоцитах могли быть проявлением репарации структурных элементов клетки и носить обратимый характер.
Результаты исследования и их обсуждение
Приведенные в работе деструктивные формы лейкоцитов в сущности являлись проявлением разных этапов единого процесса клеточной альтерации, без которой немыслимо представить клеточную регенерацию. Ранние признаки освобождения организма от «изношенных», потерявших способность эффективно функционировать клеточных элементов, прежде всего, затрагивали наиболее ответственные в энергетическом балансе и пластических процессах структурные образования – митохондрии и эндоплазматический ретикулум. Деструкция митохондрий начиналась с нарушения правильного расположения и фрагментации крист, исчезновения гранул, потери двухконтурности оболочки. Возможно, эти изменения в митохондриях носили обратимый характер и являлись проявлением одного из этапов внутриклеточного обновления. Однако в основе описываемых нами форменных элементов крови могли лежать и грубые деструктивные изменения. В одних случаях происходило уплотнение митохондрий (их матрикса), коагуляция белков с образованием электронно-плотных структур типа «белково-гиалиновых» превращений. Последние имели неровные, слабо выраженные контуры и гомогенное или слоистое строение. В других – наблюдалось набухание митохондрий. Вслед за гомогенизацией внутренних структур наступали вакуолизация или общая гидратация матрикса. На фоне выраженного отека и растворения крист выступали участки коагуляции белка типа миелиноподобной дистрофии гомогенного и слоистого характера. Впоследствии происходила фрагментация и лизис митохондрий (рис. 1). Ранние изменения эндоплазматического ретикулума заключались в очаговом или диффузном расширении канальцев, исчезновении на поверхности рибосом, скоплении в расширенных канальцах обрывков мембран, распавшихся клеточных структур («заболачивание»). К более поздним и глубоким изменениям эндоплазматического ретикулума относились разрыв оболочек сильно расширенных канальцев, появление в них электронно-плотных участков вследствие коагуляции белка, фрагментация канальцев, а затем и растворение их (рис. 2).
В погибающих лейкоцитах определенные изменения испытывал и пластинчатый комплекс. Эти сдвиги заключались чаще в набухании цистерн и растворении внутренних структур. Несколько реже после коагуляционного некроза наблюдалось превращение их в плотные осмифильные тельца.
Электронно-микроскопическая картина псевдоэозинофилов с частичной или полной редукцией ядра одновременно характеризовалась и заметными деструктивными изменениями цитоплазмы, в том числе и специфической зернистости. Тельца Боткина – Гумпрехта гранулоцитарного происхождения имели электронно-плотную полиморфную грануляцию, которая, вероятно, была обусловлена частично остатками специфической зернистости и ядерного материала, а также ограниченными участками фокального коагуляционного некроза компонентов цитоплазмы. В описываемых тельцах хорошо заметны признаки разрушения, как ядра, так и цитоплазмы. Ядерная оболочка фрагментировалась и местами полностью растворялась. В участках разрыва ядерной мембраны кариоплазма как бы «вливалась» в цитоплазму и смешивалась с гиалоплазмой, превращаясь в относительно однородную массу со средней электронной плотностью и расплывчатыми контурами. Хроматин ядра терял свое типичное строение и напоминал растекающуюся разбавленную темную краску. В цитоплазме на фоне общей гидратации определялись остатки разрушенных органоидов (обрывки цитомембран, фрагменты митохондрий с гомогенизированной матрицей и т.д.), а также тельца Маллори – локальные участки коагуляционного некроза гиалоплазмы. Иногда эти форменные элементы со множеством везикулярных структур выпускали большое число ложноножек – цитоплазматических выростов. Тельца Боткина – Гумпрехта, являющиеся результатом преобладания колликвационного некроза над коагуляционным некрозом лимфоцитов и моноцитов, чаще были лишены гранулярных структур и представляли собой полигональной формы, более или менее однородную массу. Однако в этой относительно гомогенной массе, особенно если имели место не самые поздние стадии цитолизиса, нетрудно было заметить сильное изменение ядра с разрушенной оболочкой. В цитоплазме находились лизирующиеся осмофильные образования коагуляционного некроза. В некоторых случаях в тельцах Боткина – Гумпрехта общая гидратация сочеталась с ограниченной формой ее вакуолизации.
Таким образом, в изучаемых нами деструктивных формах лейкоцитов периферической крови в целом прослеживались стереотипные явления некроза тканевых структур. В клетках возникали типичные изменения ядра и цитоплазмы. Ядро сморщивалось (кариопикноз), распадалось на глыбки (кариорексис) и растворялось (кариолизис) (рис. 3). Эти изменения ядра, очевидно, отражали динамику процесса активации гидролаз – рибонуклеазы и дезоксирибонуклеазы, что ведет к отщеплению от нуклеопротеидов фосфатных группировок и высвобождению нуклеиновых кислот, подвергающихся деполимеризации. В цитоплазме происходили денатурация и коагуляция белка, что может поначалу захватывать часть цитоплазмы (локальный коагуляционный некроз) (рис. 4), а затем и всю клетку. Наиболее ранние изменения при этом выявлялись в митохондриях и эндоплазматическом ретикулуме. По мере увеличения в них деструкции, вероятно, усиливалась активность лизосомального аппарата клетки. Вслед за коагуляцией цитоплазмы происходили не только ее распад (плазморексис), но и все нарастающая гидратация, что может привести к фокальному колликвационному некрозу или расплавлению всей клетки (цитолиз). В динамике некроза клетки наблюдалась смена процессов коагуляции и колликвации. Однако нередко отмечалось преобладание одного из них, что может зависеть от различных причин. Видимо, этим и объясняется наличие разных видов деструктивных форм лейкоцитов в периферической крови.
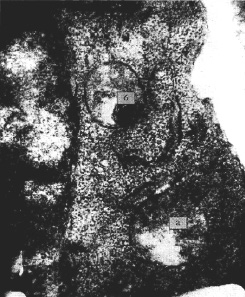
Рис. 1. Экспериментальная затравка кроликов ионолом (150 мг/кг). 10 сут. Лимфоцит. Деструкция митохондрии – локальная гидратация дезагрегация крист (а), белково-миелиновая дистрофия (б). Э.м.ф. х65500
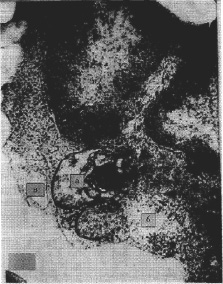
Рис. 2. Экспериментальная затравка кроликов ионолом (150 мг/кг). 10 сут. Лимфоцит. Гидратация, белково-миелиновая дистрофия митохондрии (а), локальная гидратация гиалоплазмы (б), расширенный каналец эндоплазматической сети (в). Э.м.ф. х45000
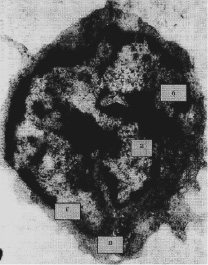
Рис. 3. Экспериментальная затравка кроликов ионолом (150 мг/кг). 10 сут. Лимфоцит. Сегментация ядра (а,б), белково-миелиновая дистрофия митохондрии (в), гидратация ядра (г). Э.м.ф. х1000
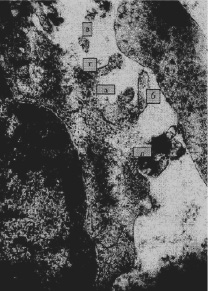
Рис. 4. Экспериментальная затравка кроликов ионолом (150 мг/кг). 10 сут. Лимфоцит. Аквадукты (а), псевдоподии (б), микроклазматоз (в), маргинальный лизис (г), краевая белково-миелиновая дистрофия (д). Э.м.ф. х62500
Параллельное изучение цитохимических особенностей разрушающихся лейкоцитов показывало заметные сдвиги внутриклеточного обмена. При окраске мазков крови на гликоген во всех видах деструктивных лейкоцитов отмечалась отрицательная реакция. Постановка бензидиновой реакции на выявление пероксидазы за исключением редких случаев также показывала отрицательные результаты. В то же время в изучаемых лейкоцитах определялась умеренная активность щелочной фосфатазы. В целом полученные цитохимические данные указывали на нарушение гликогенообразовательной функции, снижение окислительно-восстановительной реакции и на некоторую активацию процессов, связанных с деятельностью гидролаз, катализируемых гидролиз эфиров фосфорной кислоты. Последнее, очевидно, обусловлено выходом в гиалоплазму гидролитических ферментов из лизосом, направленных на переваривание разрушающихся внутриклеточных структур. Процентное содержание деструктивных лейкоцитов в периферической крови здоровых кроликов составляло в среднем 0,8 %. В условиях введения ионола (150 мг/кг) относительное число их повышалось. На 10 сутки введения препарата оно приобретало максимальное значение – в среднем 2,3 %. Это происходило в состоянии наибольшего дефицита эритрона. Повышенное содержание деструктивных лейкоцитов периферической крови в условиях гипоксии, обусловленной введением ионола в концентрации 150 мг/кг, отражало более высокий уровень обновления белой крови вследствие более быстрого изнашивания и альтерации в связи с функциональным напряжением.
Заключение
Следовательно, применение антиокислителей небезразлично для организма. В физиологических концентрациях биоантиоксиданты необходимы для осуществления ферментативного окисления клеточного дыхания и, как правило, или стимулируют, или нормализуют его [2–6]. Однако при длительном действии высоких концентраций антиокислителей может наступить снижение синтеза в организме собственных антиоксидантов, что повлечет усиление свободнорадикального окисления. Но и чрезмерное преобладание биологического окисления при резком угнетении свободнорадикального окисления может привести к нарушению постоянства уровня суммарной антиокислительной активности тканей, что служит одним из основных условий физиологического гомеостаза. Кроме того, некоторые продукты переокисления, в частности перекиси липидов, являются промежуточными продуктами гормонов, простагландина Е и прогестерона. Они также участвуют в гидроксилировании астероидного ядра холестерина. Перекиси, образовавшиеся в результате неферментативного окисления, могут выступать в роли неспецифических участков обмена, например в фаго- и пиноцитозе, регулируя проницаемость мембран лизосом. Таким образом, значительное и длительное изменение антиокислительного эффекта определяется не количеством антиокислителя, а тем, насколько фактически удается усилить систему естественных тканевых биоантиокислителей.
Рецензенты:
Миннебаев М.М., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Овсянников В.Г., д.м.н., профессор, зав. кафедрой патофизиологии, ГБОУ ВПО «Ростовский государственный медицинский университет», г. Ростов-на-Дону.
Библиографическая ссылка
Еникеев Д.А., Хисамов Э.Н., Нургалеева Е.А., Срубилин Д.В., Идрисова Л.Т. ЭЛЕКТРОННАЯ МИКРОСКОПИЯ ДЕСТРУКТИВНЫХ ЛЕЙКОЦИТОВ КРОВИ ПРИ ДЕЙСТВИИ ИОНОЛА // Фундаментальные исследования. 2015. № 1-4. С. 735-739;URL: https://fundamental-research.ru/ru/article/view?id=37411 (дата обращения: 04.07.2025).



