Исследуемое вещество 11-дезоксимизопростол (11-ДМП) – этиловый эфир (±)-11,15-дидезокси-16-метил-16-гидроксипростагландина E1 (рисунок), проявляющее утеротоническую активность.
Это соединение относится к ряду 11-дезоксипростагландинов и близко по химическому строению к мизопростолу. Будучи химически более стабильным и в 2 раза менее токсичным, оно превосходит мизопростол по утеротонической активности, что, наряду с синтетической доступностью и отсутствием побочных эффектов, делает его исключительно перспективным для внедрения в практику с целью замены мизопростола в гинекологических бинарных препаратах. Описаны синтез [5], противоязвенная и ряд других видов активности соединений 11-дезоксимизопростола [4, 8, 9].
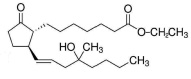
Этиловый эфир (±)-11,15-дидезокси16-метил-16-гидроксипростагландина E1 (11-дезоксимизопростол)
Исходя из того, что 11-ДМП в настоящее время рассматривается как перспективное утеротоническое, иммуномодулирующее и противоязвенное средство, представляется целесообразным изучение и детализация механизмов его антиоксидантного действия, поскольку показано, что окислительный стресс может лежать в основе многих патологических процессов, а его устранение способствует коррекции нарушений [1]. Однако, прежде чем приступать к изучению специфической активности новых фармакологических субстанций, необходимо предварительно оценить их токсические свойства. Одним из обязательных этапов доклинических исследований новых лекарственных средств является изучение их влияния на функциональную активность иммунной системы лабораторных животных.
Под иммунотоксическим действием фармакологических средств понимают побочные, опасные для здоровья некомпенсированные нарушения в структуре и функции иммунной системы, которые могут привести к снижению резистентности организма к инфекции, повышению риска развития онкологических заболеваний, развитию аутоиммунных патологий [6].
Под аллергизирующими свойствами понимают способность того или иного вещества вызывать при введении в организм состояние повышенной чувствительности (гиперчувствительность, сенсибилизация) [2]. В основе патогенеза наиболее тяжелых аллергических осложнений, развивающихся по 1 типу гиперчувствительности, лежит активация Th2 хелперов и продукция цитокинов IL-4, IL-5 и IL-13, с последующим синтезом IgE-антител, имеющих высокое сродство к тучным клеткам и базофилам [3]. Антиген вступает во взаимодействие с фиксированными на тучных клетках IgE-антителами, что приводит к активации клеток и секреции медиаторов аллергии (гистамина, серотонина и др.). Согласно классификации P.G.H.Gell и P.R.A.Coombs имеется еще 4 типа гиперчувствительности, в основе которых лежат другие иммунопатологические механизмы [10].
Цель исследования: изучение иммунотоксических и аллергизирующих свойств лекарственного средства «11-дезоксимизопростол» при внутрижелудочном введении.
Материалы и методы исследования
Иммунотоксическое действие лекарственного средства 11-ДМП изучено на лабораторных животных. Исследование проведено в соответствии с «Методическими указаниями по оценке иммунотоксического действия фармакологических веществ» [6, 7]. Эксперименты выполнены на мышах-самках линии СВА 7–8-недельного возраста (масса тела 20–22 г), и белых морских свинках. Длительность карантина (акклиматизационного периода) для всех животных составляла четырнадцать (14) дней. В течение карантина проводили ежедневный осмотр каждого животного (поведение и общее состояние), дважды в день животных наблюдали в клетках (заболеваемость и смертность).
Животных распределяли по группам, используя при рандомизации в качестве основного критерия массу тела (отклонение значений массы тела в пределах группы не более 10 %). Количество животных в каждой экспериментальной группе – 15. Животные, не соответствующие критериям включения в исследование, исключены из исследования в течение карантина. Для оценки иммунотоксического действия 11-ДМП вводили животным внутрижелудочно в дозах 2, 10 и 20 мг/кг массы в форме суспензии в 1 %-м крахмальном геле. Рабочие разведения 11-ДМП готовили в день введения. Животные из группы негативного контроля получали 1 % крахмальный гель (плацебо).
Для оценки иммунотоксических свойств исследовали показатели неспецифического, специфического гуморального и клеточного иммунитета мышей, оценивали его влияние на массу лимфоидных органов и их клеточность. Аллергенные свойства 11-ДМП оценивали в методах анафилактического шока, непрямой реакции дегрануляции тучных клеток, реакции иммунных комплексов и конъюнктивальной пробы [6]. Для постановки конъюнктивальной пробы использованы белые морские свинки (самцы с массой тела 200–250 г., n = 30), разделенные в ходе эксперимента на две группы: опытную (n = 15) и контрольную (n = 15).
Результаты обрабатывались общепринятыми методами вариационной статистики и выражались в виде среднеарифметической (М) и её стандартной ошибки (m). Применялись критерии непараметрической статистики: Манна – Уитни (U). Обработка полученных данных производилась с использованием пакета прикладных программ Statistica 6.
Результаты исследования и их обсуждение
Лимфоидные органы (тимус и селезенка) экспериментальных животных взвешивали и определяли их массовые коэффициенты (индексы массы (ИМ)) и количество ядросодержащих клеток (клеточность). Результаты исследования представлены в табл. 1. Введение 11-ДМП не сопровождалось изменениями величины массовых коэффициентов и клеточности тимуса и селезенки у животных опытных групп.
Размеры и форма селезенки и тимуса у животных опытных групп не отличались от таковых в контрольной группе. Полученные данные позволяют заключить, что введение 11-ДМП в дозах 2, 10 и 20 мг/кг не привело к изменению массовых и клеточных параметров тимуса и селезенки.
Из данных, представленных в табл. 2, следует, что введение животным исследуемого препарата не повлияло на фагоцитарную активность макрофагов. Процент фагоцитирующих клеток значимо не изменялся в группах животных, которым вводили препарат. Таким образом, введение 11-ДМП экспериментальным животным не оказало влияния на изменение функциональной активности макрофагов.
Таблица 1
Индексы массы (мг/10 г веса тела, М ± m) и клеточность (х106, М ± m) тимуса и селезенки мышей при введении 11-ДМП
|
Группы |
Исследуемые органы |
|||
|
Тимус |
Селезенка |
|||
|
ИМ |
Клеточность |
ИМ |
Клеточность |
|
|
Контроль(n = 15) (плацебо, крахмал) |
25,1 ± 1,8 |
37,5 ± 3,5 |
52,4 ± 3,5 |
100,3 ± 5,9 |
|
11-ДМП, 2 мг/кг (n = 15) |
25,3 ± 1,4 |
37,3 ± 1,2 |
53,2 ± 2,1 |
105,1 ± 8,7 |
|
11-ДМП, 10 мг/кг (n = 15) |
26,5 ± 2,9 |
39,1 ± 4,5 |
54,8 ± 1,5 |
109,3 ± 9,1 |
|
11-ДМП, 20 мг/кг (n = 15) |
24,8 ± 1,9 |
37,1 ± 2,0 |
52,9 ± 2,8 |
104,0 ± 4,5 |
Таблица 2
Влияние 11-ДМП на фагоцитарную активность перитонеальных макрофагов
|
Группы |
Доза препарата, мг/кг |
Фагоцитарный индекс, %, M ± m |
|
Контроль (n = 15) (плацебо, крахмал) |
– |
29,8 ± 3,9 |
|
11-ДМП |
2 (n = 15) |
29,1 ± 3,0 |
|
10 (n = 15) |
31,0 ± 3,4 |
|
|
20 (n = 15) |
28,6 ± 3,0 |
Таблица 3
Влияние 11-ДМП на величину отека лапы
|
Группы |
Доза, мг/кг |
Величина отека, мг (M ± m) |
ИР, % (M ± m) |
|
Контроль (n = 15) (плацебо, крахмал) |
– |
413 ± 4,7 |
36,8 ± 4,1 |
|
11-ДМП |
2 (n = 15) |
40,8 ± ,0 |
37,4 ± 3,0 |
|
10 (n = 15) |
39,7 ± 2,9 |
35,1 ± 3,8 |
|
|
20 (n = 15) |
409±4,1 |
37,0 ± 2,9 |
Таблица 4
Влияние 11-ДМП на гуморальный иммунный ответ
|
Группы |
Доза, мг/кг |
Общий титр антител (Log2), M ± m |
Титр IgG, (Log2), M ± m |
|
Контроль (n = 15) (плацебо, крахмал) |
– |
5,9 ± 0,9 |
5,0 ± 0,7 |
|
11-ДМП |
2 (n = 15) |
5,7 ± 1,0 |
5,1 ± 0,8 |
|
10 (n = 15) |
5,5 ± 1,1 |
5,0 ± 0,5 |
|
|
20 (n = 15) |
5,3 ± 0,9 |
4,8 ± 0,6 |
Таблица 5
Влияние препарата 11-ДМП на показатель дегрануляции тучных клеток
|
Группы |
Доза, мг/кг |
ПДТК, кол-во клеток (M ± m) |
|
Контроль (плацебо, крахмал) |
– |
0,089 ± 0,018 |
|
11-ДМП |
2 (n = 15) |
0,085 ± 0,019 |
|
10 (n = 15) |
0,088 ± 0,025 |
|
|
20 (n = 15) |
0,09 ± 0,021 |
Введение животным 11-ДМП во всех исследованных дозах не оказало влияния на интенсивность клеточного иммунного ответа. Величина отека лапы у животных, которым вводили 11-ДМП, не отличалась от соответствующих показателей группы контроля (табл. 3).
Таким образом, 11-ДМП не обладает значимыми сенсибилизирующими свойствами и не оказывает влияния на клеточное звено иммунной системы (табл. 4).
Результаты проведенного эксперимента свидетельствуют о том, что введение 11-ДМП не влияет на развитие антителообразования у мышей.
Введение 11-ДМП в обеих исследуемых дозах не повлияло на развитие аллергических реакций у морских свинок. Отека ткани на месте инъекции, гиперемии, изменений кожного покрова не отмечено.
Введение исследуемого вещества не оказало влияния на процесс дегрануляции тучных клеток. Значение показателя дегрануляции тучных клеток (ПДТК) у животных из опытных и контрольной групп не превышало 0,2 (табл. 5).
Таким образом, полученные результаты позволяют заключить, что 11-ДМП не обладает аллергенными свойствами, выявляемыми в непрямой реакции дегрануляции тучных клеток.
На всех сроках наблюдения ни у одного животного не была выявлена реакция на введение исследованных доз препарата при проведении конъюнктивальной пробы. Введение препарата не сопровождалось покраснением слезного протока, склеры или конъюнктивы.
Заключение
При изучении иммунотоксических свойств 11-ДМП показано, что препарат не вызывает изменений иммунитета, выявляемых по влиянию на лимфоидные органы, в реакции гиперчувствительности замедленного типа, образовании антител и фагоцитарной активности перитонеальных макрофагов. В результате изучения аллергенного действия препарата показано, что 11-ДМП не обладает аллергенными свойствами, выявляемыми в реакциях дегрануляции тучных клеток, иммунных комплексов, а также в конъюнктивальной пробе.
Рецензенты:
Зарудий Ф.С., д.м.н., профессор кафедры фармакологии № 1 с курсом клинической фармакологии ГБОУ ВПО «Башкирский государственный медицинский университет» Минздрава РФ, г. Уфа;
Дианов В.М., д.фарм.н., профессор, профессор кафедры фармацевтической химии с курсами аналитической и токсикологической химии ГБОУ ВПО «Башкирский государственный медицинский университет» Минздрава РФ, г. Уфа.
Работа поступила в редакцию 30.12.2014.
Библиографическая ссылка
Катаева Р.М., Аглетдинов Э.Ф., Катаев В.А., Иванова Н.А., Халиков Р.А ИЗУЧЕНИЕ ИММУНОТОКСИЧНОСТИ И АЛЛЕРГЕННЫХ СВОЙСТВ 11-ДЕЗОКСИМИЗОПРОСТОЛА // Фундаментальные исследования. 2014. № 10-10. С. 1938-1941;URL: https://fundamental-research.ru/ru/article/view?id=36675 (дата обращения: 04.07.2025).



