Инфекция вируса гепатита С (ВГС) является одним из наиболее распространенных хронических заболеваний: около 180 млн человек во всем мире инфицированы ВГС [7]. У 3–10 % инфицированных в течение примерно 20 лет развивается цирроз печени с возможным последующим развитием гепатоцеллюлярной карциномы [16]. Кроме того, с данным вирусом ассоциировано большое количество проявлений, непосредственно не связанных с печенью и затрагивающих кровь (напр., криоглобулинемия) [12], почки (напр., гломерулонефрит) [15] и т.п. В настоящее время инфекция является ведущей причиной смерти от заболеваний печени и наиболее распространенным показанием к трансплантации печени [9].
Гепатит C поддается лечению. До 2011 года стандартной терапией инфекции ВГС являлась комбинация пегелированного интерферона α и рибавирина, с продолжительностью терапии от 24 недель для генотипов 2 и 3 (с 70–80 % устойчивого вирусологического ответа) до 48 недель для генотипа 1 (с 40–50 % устойчивого вирусологического ответа). Данная схема сопряжена с различными побочными эффектами, в том числе гриппоподобными симптомами, депрессией, сыпью и цитопенией [6]. В 2011 году лечение было значительно расширенным с введением двух новых ВГС NS3/4A ингибиторов протеазы, телапревира и боцепревира. Данные препараты явились первыми агентами прямого действия, направленные на подавление репликации ВГС. Их комбинация с пегелированным интерфероном α и рибавирином показала улучшенный вирусингибиторный эффект и сокращение продолжительности лечения. Тем не менее, они ограничены в лечении пациентов с генотипом 1 [5] и сопровождаются дополнительными побочными эффектами, особенно у больных с выраженным фиброзом печени [2], что требовало медицинского наблюдения [10, 19, 20]. Помимо этого при клиническом применении этих препаратов отмечалось быстрое появление резистентных к ним вариантов ВГС [21].
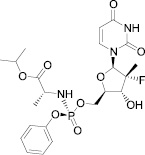
Софосбувир Симепревир
Рис. 1. Ингибиторы репликации ВГС
Софосбувир (рис. 1), являющийся мощным ингибитором NS5B РНК-зависимой РНК полимеразы ВГС и одобренный FDA в 2013 г., стал первым препаратом, который применялся в комбинации с рибавирином для лечения инфекции ВГС генотипов 2 и 3 без использования пегелированного α-интерферона [13]. Комбинация софосбувира, симепревира (также одобренного FDA в 2013 г. для лечения ВГС в качестве ингибитора вирусной протеазы) и рибавирина в течение 12–24 недель имела очень высокий терапевтический эффект, который составил около 90 % устойчивого вирусологического ответа для всех генотипов вируса [3].
Однако стоит отметить чрезвычайно высокую стоимость лечения. В частности,12-недельный курс только одним софосбувиром стоит более $84000, в то время как такой же курс симепревира составляет порядка $66000 [4, 8]. Кроме того, было отмечено появление мутаций, снижающих эффективность данной терапии [14]. Таким образом, следует искать новые агенты с другим механизмом действия, способные уменьшать курс лечения, не снижая его эффективности. Это позволит снизить как вероятность появления устойчивых вариантов вируса, так и стоимость лечения.
Производные 5-аминоурацила являются перспективным классом соединений, проявивших широкий спектр противовирусной активности. В частности, производные 5-(фениламино)урацила, содержащие в положении 1 остатка урацила бензильный или 3-(фенокси)бензильный заместитель ингибируют репликацию ВИЧ-1 и ЕБВ в микромолярных концентрациях [11]. Кроме того, ранее нами были получены производные 5-(фениламино)урацила, проявившие выраженную ингибиторную активность в отношении ВГС [1].
Цель исследования. С целью поиска новых ингибиторов репродукции ВГС нами был осуществлен синтез и изучены противовирусные свойства производных 5-(фениламино)урацила, содержащих в положении 1 урацила 4-(фенокси)бензильный фрагмент. Общая структура данного ряда соединений представлена на рис. 2.
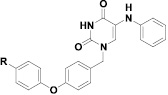
Рис. 2. 1-(4-феноксибензил)производные 5-(фениламино)урацила
Результаты исследования и их обсуждение
Синтез целевых соединений, представленный на рис. 3, был осуществлен путем конденсации эквимолярных количеств 2,4-бис(триметилсилилокси)5-(фениламино)пиримидина 2, полученного кипячением исходного 5-(фениламино)производных урацила с избытком гексаметилдисилазана в присутствии каталитического количества NH4Cl, как это было описано ранее [11], и 4-(4-R-фенокси)бензилбромидов, полученных бромированием соответствующих 4-(фенокси)толуолов [18, 22]. Кипячение в безводном 1,2-дихлорэтане без доступа влаги воздуха в течение 24 ч привело к образованию целевых производных 1-[4-(4-фенокси)бензил]-5-(фениламино)урацила 3–9, выход которых составил 62–78 % после хроматографической очистки.
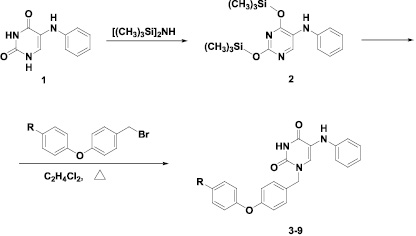
Рис. 3. Схема синтеза производных 1-[4-(фенокси)бензил]-5-(фениламино)урацила
Структуры синтезированных соединений доказаны методом ЯМР-спектроскопии, чистота – тонкослойной хроматографией. Физико-химические свойства целевых соединений представлены в табл. 1.
Таблица 1
Свойства производных 1-[4-(фенокси)бензил]-5-(фениламино)урацила (3-9)
|
Соединение |
R |
Выход, % |
Rf* |
Тпл., °С |
|
3 |
Н |
74 |
0,67 |
198–199 |
|
4 |
t-Bu |
63 |
0,82 |
233,5–235 |
|
5 |
MeO |
68 |
0,74 |
202–203 |
|
6 |
F |
78 |
0,74 |
209,5–211,5 |
|
7 |
Cl |
67 |
0,80 |
203–205 |
|
8 |
Br |
71 |
0,79 |
206–207 |
|
9 |
NO2 |
62 |
0,75 |
228–230,5 |
Примечание. * этилацетат.
Материалы и методы исследования
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H) в ССl4 и ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254». В качестве элюента использовали этилацетат. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
Общий метод получения 1-[4-(фенокси)бензил]-5-(фениламино)урацилов (3-9)
Раствор соответствующего 4-феноксибензилбромида (6,81 ммоль) в безводном 1,2-дихлорэтане (20 мл) добавляют к раствору 2,4-бис(триметилсилилокси)-5-(фениламино)пиримидина (6,80 ммоль) в 1,2-дихлорэтане (50 мл). Полученную смесь кипятят в течение 24 ч с защитой от влаги воздуха и охлаждают до комнатной температуры. Затем реакционную массу обрабатывают 10 мл изопропанола и упаривают при пониженном давлении досуха, остаток перекристаллизовывают из смеси изопропанол-ДМФА.
1-(4-Феноксибензил)-5-(фениламино)урацил (3). 1H ЯМР (ДМСО-d6): d 4,90 (2 H, с, CH2), 6,69 (1H, т, J = 7,3 Гц, H-4′), 6,79 (2H, дд, J = 8,7 и 1,0 Гц. H-2′, H-6′), 6,98-7,18 (8H, м, NH, H-3′, H-5′, H-2″, H-6″, H-2‴, H-4‴, H-6‴), 7,35-7,43 (4H, м, H-3″, H-5″, H-3‴, H-5‴), 7,74 (1H, с, H-6), 11,61 (1H, с, NH); 13C ЯМР (ДМСО-d6): d 49,7; 114,5; 116,8; 118,2; 118,7; 118,8; 123,6; 128,9; 129,6; 130,1; 132,1; 134,8; 145,7; 150,0; 156,3; 156,6; 161,9,
1-[4-(4-трет-Бутилфенокси)бензил]-5-(фениламино)урацил (4). 1H ЯМР (ДМСО-d6): δ 1,28 (9H, с, CH3), 4,90 (2H, с, CH2), 6,69 (1H, т, J = 7,3 Гц, H-4″), 6,80 (2H, д, J = 7,7 Гц, H-2″, H-6″), 6,94 (2H, д, J = 8,7 Гц, H-2″′, H-6″′), 6,98-7,00 (3H, м, NH, H-2′, H-6′), 7,12 (2H, т, J = 8,1 Гц, H-3″, H-5″), 7,37-7,40 (4H, м, ароматич. H), 7,69 (1H, с, H-6), 11,55 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 35,5; 38,2; 53,9; 118,6; 118,8; 122,4; 122,5; 122,6; 130,9; 133,1; 133,8; 136,0; 138,5; 149,8; 150,2; 154,2; 158,3; 160,9; 166,0,
1-[4-(4-Метоксифенокси)бензил]-5-(фениламино)урацил (5). 1H ЯМР (ДМСО-d6): δ 3,74 (3H, с, OCH3), 4,87 (2H, с, CH2), 6,68 (1H, т, J = 7,3 Гц, H-4″), 6,78 (2H, дд, J = 7,3 и 0,8 Гц, H-2″, H-6″), 6,91-7,01 (7H, м, NH, ароматик H), 7,11 (2H, т, J = 8,6 Гц, H-3″, H-5″), 7,34 (2H, д, J = 8,8 Гц, H-3′, H-5′), 7,69 (1H, с, H-6), 11,55 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 49,7; 55,4; 114,5; 115,1; 116,8; 117,4; 118,2; 120,7; 128,8; 129,5; 131,1; 134,5; 145,6; 149,3; 149,9; 155,7; 157,6; 161,7,
1-[4-(4-Фторфенокси)бензил]-5-(фениламино)урацил (6). 1H ЯМР (ДМСО-d6): δ 4,87 (2H, с, CH2), 6,67 (1H, т, J = 7,3 Гц, H-4″), 6,77 (2H, д, J = 8,6 Гц, H-2″, H-6″), 6,98 (2H, д, J = 8,6 Гц, H-2′, H-6′), 7,02-7,12 (5H, м, NH, ароматич. H), 7,20 (2H, т, J = 8,6 Гц, H-3″, H-5″), 7,37 (2H, д, J = 8,6 Гц, H-3′, H-5′), 7,71 (1H, с, H-6), 11,56 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 50,0; 114,8; 116,8; 117,0; 117,1; 118,5; 121,0; 121,1; 129,2; 129,9; 132,3; 135,0; 146,0; 150,3; 152,8; 157,0; 157,4; 159,8; 162,1,
1-[4-(4-Хлорфенокси)бензил]-5-(фениламино)урацил (7). 1H ЯМР (ДМСО-d6): δ 4,91 (2H, с, CH2), 6,70 (1H, т, J = 7,0 Гц, H-4″), 6,80 (2H, д, J = 7,5 Гц, H-2″, H-6″), 6,98 (1H, с, NHPh), 7,02-7,05 (4H, м, ароматич. H), 7,12 (2H, т, J = 7,4 Гц, H-3″, H-5″), 7,40-7,42 (4H, м, ароматич. H), 7,70 (1H, с, H-6), 11,53 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 53,9; 118,8; 121,1; 122,5; 123,2; 124,5; 131,5; 133,9; 134,0; 134,1; 136,8; 138,5; 149,8; 154,2; 159,8; 160,1; 166,0,
1-[4-(4-Бромфенокси)бензил]-5-(фениламино)урацил (8). 1H ЯМР (ДМСО-d6): δ 4,89 (2H, с, CH2), 6,68 (1H, т, J = 7,3 ГЦ, H-4″), 6,78 (2H, д, J = 7,8 Гц, H-2″, H-6″), 6,96 (2H, д, J = 9,1 Гц, H-2′, H-6′), 7,03-7,06 (3H, м, NHPh, H-2″′, H-6″′), 7,11 (2H, т, J = 7,3 Гц, H-3″, H-5″), 7,40 (2H, д, J = 8,8 Гц, H-3′, H-5′), 7,54 (2H, д, J = 9,0 Гц, H-3″′, H-5″′), 7,74 (1H, с, H-6), 11,59 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 53,9; 118,8; 121,1; 122,5; 123,2; 124,5; 131,5; 133,9; 134,0; 134,1; 136,8; 138,5; 149,8; 154,2; 159,8; 160,1; 166,0,
1-[4-(4-Нитрофенокси)бензил]-5-(фениламино)урацил (9). 1H ЯМР (ДМСО-d6): δ 4,95 (2H, с, CH2), 6,67 (1H, т, J = 7,3 Гц, H-4″), 6,81 (2H, д, J = 8,6 Гц, H-2″, H-6″), 6,98 (1H, уш.с., NHAr), 7,10-7,14 (м, арматич. H), 7,20 (2H, д, J = 8,6 Гц, H-2′, H-6′), 7,48 (2H, д, J = 8,6 Гц, H-3′, H-5′), 7,75 (1H, с, H-6), 8,23 (2H, д, J = 9,2 Гц, H-3″′, H-5″′), 11,58 (1H, с, NH). 13C ЯМР (ДМСО-d6): δ 49,7; 114,6; 116,9; 117,4; 118,3; 120,5; 126,1; 128,8; 129,8; 134,2; 134,3; 142,3; 145,5; 149,9; 153,8; 161,8; 162,7.
Таблица 2
Анти-ВГС активность синтезированных соединений
|
Соединение |
R |
ИК50, μM |
Цитотоксичность |
|
|
ЦК50, μM |
ИС |
|||
|
3 |
H |
13,8 |
> 316,2 |
> 22,9 |
|
4 |
t-Bu |
> 200 |
– |
– |
|
5 |
MeO |
> 200 |
– |
– |
|
6 |
F |
> 200 |
– |
– |
|
7 |
Cl |
> 200 |
– |
– |
|
8 |
Br |
8,13 |
9,12 |
1,12 |
|
9 |
NO2 |
1,07 |
3,16 |
2,95 |
Примечания:
ИК50 – ингибиторная концентрация – концентрация вещества, обеспечивающая подавление репликации вируса на 50 %;
ЦК50 – цитотоксическая концентрация – концентрация вещества, при которой наблюдается гибель 50 % неинфицированных клеток;
ИС – индекс селективности – отношение ЦК50 к ИК50.
Противовирусная активность
Изучение противовирусных свойств синтезированных соединений было осуществлено в культуре клеток Huh 7.5, инфицированных ВГС (штамм JFH-1), в соответствии с описанным методом [16]. Ранее [1] нами было обнаружено, что 1-[4-(фенокси)бензил]-5-(фениламино)урацил (3) проявляет заметную анти-ВГС активность. Соединение блокировало репликацию ВГС в концентрации ИК50 13,8 µМ. Обнаружено, что введение в пара-положение феноксильного фрагмента различных заместителей, таких как t-Bu, OMe, F или Cl (соединения 4–7), ведет к полной потере противовирусной активности. Однако, введение атома брома (соединение 8) или нитро-группы (соединение 9) усиливает вирусингибиторные свойства. Соединения 8 и 9 проявили выраженную ингибиторную активность в концентрациях ИК50 8,13 и 1,07 µМ соответственно. Однако при этом возрастали цитотоксические свойства соединений, что существенно снижает ИС. Данные по активности синтезированных соединений представлены в табл. 2.
Выводы
Таким образом, нами синтезированы 6 новых, ранее неописанных в литературе производных 1-[4-(фенокси)бензил]5-(фениламино)урацила, содержащих различные заместители в 4-(фенокси)бензильном фрагменте. Изучены спектральные, физико-химические свойства и анти-ВГС активность синтезированных соединений. Представляется перспективным дальнейший поиск в ряду 5-(фениламино)урацила новых эффективных блокаторов репликации ВГС.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 13-04-01391А. Авторы выражают благодарность профессору Луису Шангу (департамент биохимии, медицинской микробиологии и иммунологии, университет Альберты, Эдмонтон, Канада) за данные скрининга.
Рецензенты:
Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения, Волгоградский государственный медицинский университет, г. Волгоград;
Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии, Волгоградский государственный медицинский университет, г. Волгоград.
Работа поступила в редакцию 06.11.2014.
Библиографическая ссылка
Гуреева Е.С., Бабков Д.А., Озеров А.А., Новиков М.С. СИНТЕЗ И АНТИ-ВГС АКТИВНОСТЬ НОВЫХ 1-[4-(ФЕНОКСИ)БЕНЗИЛ]- ПРОИЗВОДНЫХ 5-ФЕНИЛАМИНОУРАЦИЛА // Фундаментальные исследования. 2014. № 11-7. С. 1574-1578;URL: https://fundamental-research.ru/ru/article/view?id=35810 (дата обращения: 15.01.2026).



