Инфекция вируса гепатита С (ВГС) является глобальной проблемой современного здравоохранения. В настоящее время по приведенным в литературе оценкам около 3 % мирового населения (180 млн. человек) инфицировано ВГС [10]. У 3–10 % инфицированных в течение примерно 20 лет развивается цирроз печени с возможным последующим развитием гепатоцеллюлярной карциномы [7, 12]. Кроме того, с данным вирусом ассоциировано большое количество заболеваний, непосредственно не связанных с печенью и затрагивающих кровь, почки и другие органы [8].
Современные протоколы терапии, используемые для лечения ВГС-инфекции, основаны на регулярных инъекциях α-интерферона, а также его комбинации с нуклеозидным аналогом рибавирином (ежедневный пероральный прием) [1]. Следует отметить, что этот протокол лечения не оказывает прямого воздействия на вирус, а лишь стимулирует иммунную систему организма. По этой причине данная терапия имеет крайне низкую эффективность, особенно в отношении вируса первого генотипа (чувствительными к терапии оказываются менее 30 % пациентов) [3, 14].
Разработка первого поколения анти-ВГС агентов была сосредоточена на комбинации их с интерфероном/рибавирином с целью повысить процент излечения и снижения продолжительности лечения [2, 4, 6, 13]. Так, недавно два ингибитора протеазы NS3/4 – телапревир и боцепревир (рис. 1) в сочетании с интерфероном/рибавирином были одобрены для лечения гепатита С у пациентов с генотипом 1. Обе эти комбинации лечения показали улучшенный вирусингибиторный эффект и сокращение продолжительности лечения. Тем не менее, они ограничены в лечении пациентов с генотипом 1, по-прежнему требуют дополнительной терапии интерфероном/рибавирином и сопровождаются побочными эффектами, которые требуют медицинского наблюдения.
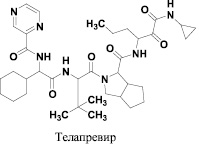
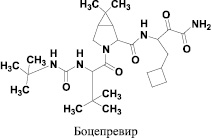
Рис. 1. Ингибиторы протеазы NS3/4
В связи с этим проблема создания новых ингибиторов репродукции ВГС в настоящее время является чрезвычайно актуальной.
Цель исследования. С целью поиска новых потенциальных анти-ВГС агентов нами был осуществлен синтез 5-фениламинопроизводных урацила, содержащих в положении 1 пиридинового цикла 4-феноксибензильный фрагмент. Общая структура данного ряда соединений представлена на рис. 2.
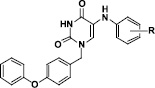
Рис. 2. 1-(4-Феноксибензил)производные 5-(фениламино)урацила
Результаты исследования и их обсуждение
Целевые 1-[4-(фенокси)бензил]-5-(фениламино)-производные урацила 18-25, синтез которых представлен на рис. 3, были получены в две стадии. Аминирование исходного 5-бромурацила осуществлялось путем кипячения в растворе этиленгликоля с трехкратным мольным избытком соответствующего анилина, в соответствии с известным методом [5]. Вторая стадия заключалась в конденсации эквимолярных количеств 2,4-бис(триметилсилилокси)-5-(фениламино)пиримидина 10-17 и 4-(фенокси)бензилбромида при кипячении в растворе безводного 1,2-дихлорэтана в течение 25–30 ч, как это было описано нами ранее [8]. При этом выход целевых продуктов 18-25 составил 60–74 %.
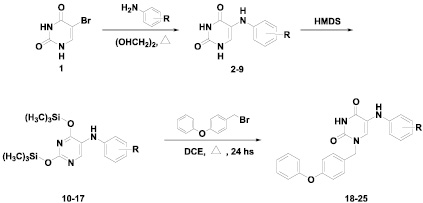
Рис. 3. Схема синтеза 1-[4-(фенокси)бензил]-5-(фениламино)урацилов
Структуры синтезированных соединений доказаны методом ЯМР-спектроскопии, чистота – тонкослойной хроматографией. Физико-химические свойства целевых соединений представлены в табл. 1.
Таблица 1
Свойства 1-[4-(фенокси)бензил]-5-(фениламино)урацилов (18-25)
|
Соединения |
R |
Выход, % |
Rf* |
Тпл. , °С |
|
18 |
Н |
74 |
0,67 |
198–199 |
|
19 |
2-Me |
66 |
0,77 |
146,5–148 |
|
20 |
3-Me |
65 |
0,76 |
219–220 |
|
21 |
4-Me |
71 |
0,76 |
223–225 |
|
22 |
3,4-Me2 |
64 |
0,78 |
214–216 |
|
23 |
3,5-Me2 |
60 |
0,80 |
153,5–155 |
|
24 |
2-OMe |
67 |
0,79 |
184–185,5 |
|
25 |
3-OMe |
60 |
0,70 |
192,5–194 |
Примечание. * этилацетат.
Материалы и методы исследования
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H) в ССl4 и ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254». В качестве элюента использовали этилацетат. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
Общий метод получения 5-фениламиноурацилов (2-9). К 5,0 г (0,026 моль) 5-бромурацила (1) добавляют трехкратный мольный избыток соответствующего анилина и 50 мл этиленгликоля. Полученную смесь кипятят в течение 2 ч. Затем охлаждают до комнатной температуры и добавляют 100 мл воды. Полученный осадок фильтруют и высушивают. Перекристаллизовывают из диметиформамида.
Общий метод получения 1-[4-(фенокси)бензил]-5-(фениламино)урацилов (18-25). К 2,4-бис(триметилсилилокси)-5-(фениламино)пиримидину, полученному кипячением 5,98 ммоль соответствующего 5-фениламиноурацила (2-9) в избытке ГМДС, добавляют 11,96 ммоль 4-феноксибензилбромида и 50 мл безводного 1,2-дихлорэтана. Полученную смесь кипятят в течение 30 ч с защитой от влаги воздуха. Затем реакционную массу обрабатывают 5 мл изопропанола и упаривают при пониженном давлении досуха, остаток перекристаллизовывают из смеси изопропанол-ДМФА.
1-(4-Феноксибензил)-5-(фениламино)урацил (18). 1 H ЯМР (ДМСО-d6): δ 4,90 (2 H, с, CH2), 6,69 (1 H, т, J = 7,3 Гц, H-4′), 6,79 (2 H, дд, J = 8,7 и 1,0 Гц. H-2′, H-6′), 6,98-7,18 (8 H, м, NH, H-3′, H-5′, H-2″, H-6″, H-2‴, H-4‴, H-6‴), 7,35-7,43 (4 H, м, H-3″, H-5″, H-3‴, H-5‴), 7,74 (1 H, с, H-6), 11,61 (1 H, с, NH); 13C ЯМР (ДМСО-d6): d 49,7; 114,5; 116,8; 118,2; 118,7; 118,8; 123,6; 128,9; 129,6; 130,1; 132,1; 134,8; 145,7; 150,0; 156,3; 156,6; 161,9;5-[(2-Метилфенил)амино]-1-(4-феноксибензил)урацил (19). 1 H ЯМР (ДМСО-d6): d 2,15 (3 H, с, CH3), 4,88 (2 H, с, CH2), 6,24 (1 H, уш.с., NH), 6,64 (1 H, д, J = 8,0 Гц, H-6′), 6,70 (1 H, тд, J = 7,3 и 1,0 Гц, H-4′), 6,95-7,03 (5 H, м, H-5′, H-2″, H-6″, H-2‴, H-6‴), 7,05 (1 H, д, J = 7,2 Гц, H-3′), 7,14 (1 H, тт, J = 7,4; 1,0 Гц, H-4‴), 7,33-7,42 (4 H, м, H-3″, H-5″, H-3‴, H-5‴), 7,52 (1 H, с, H-6), 11,58 (1 H, с, NH); 13C ЯМР (ДМСО-d6): d 21,8; 53,8; 118,7; 121,8; 122,9; 122,9; 123,4; 127,8; 128,9; 130,7; 133,8; 134,3; 134,5; 136,3; 138,2; 147,6; 154,2; 160,5; 160,8; 165,9;5-[(3-Метилфенил)амино]-1-(4-феноксибензил)урацил (20). 1 H ЯМР (ДМСО-d6): d 2,17 (3 H, с, CH3), 4,89 (2 H, с, CH2), 6,50 (1 H, д, J = 7,6 Гц, H-4′), 6,53-6,62 (3 H, м, H-2′, H-5′, H-6′), 6,91 (1 H, уш.с., NH), 6,96-7,04 (4 H, м, H-2″, H-6″, H-2‴, H-6‴), 7,11-7,17 (1 H, м, H-4‴), 7,35-7,42 (4 H, м, H-3″, H-5″, H-3‴, H-5‴), 7,68 (1 H, с H-6), 11,55 (1 H, с, NH); 13C ЯМР (ДМСО-d6): d 25,5; 53,8; 116,2; 119,1; 121,1; 122,9; 123,4; 127,8; 133,0; 133,8; 134,3; 136,3; 138,5; 142,2; 149,8; 154,1; 160,5; 160,7; 166,0;5-[(4-Метилфенил)амино]-1-(4-феноксибензил)урацил (21). 1 H ЯМР (ДМСО-d6): d 2,17 (3 H, с, CH3), 4,89 (2 H, с, CH2), 6,74 (2 H, д, J = 8,1 Гц, H-2′, H-6′), 6,93 (3 H, д, J = 7,8 Гц, H-3′, H-5′, NH), 7,00 (4 H, д, J = 6,6 Гц, H-2″, H-6″, H-2″′, H-6″′), 7,13 (1 H, т, J = 7,4 Гц, H-4″′), 7,31-7,43 (4 H, м, H-3″, H-5″, H-3″′, H-5″′), 7,63 (1 H, с, H-6), 11,60 (1 H, с, NH); 13C ЯМР (ДМСО-d6): δ 20,5; 49,9; 115,4; 117,9; 119,0; 119,1; 123,9; 127,4; 129,6; 129,9; 130,4; 132,3; 132,4; 143,0; 150,1; 156,5; 156,9; 162,0;5-[(3;4-Диметилфенил)амино]-1-(4-феноксибензил)урацил (22). 1 H ЯМР (ДМСО-d6): δ 2,08 (3 H, с, CH3), 2,09 (3 H, с, CH3), 4,89 (2 H, с, CH2), 6,57 (1 H, д, J = 7,9 Гц, H-5″), 6,61 (1 H, с, NHAr), 6,76 (1 H, с, H-2″), 6,87 (1 H, д, J = 8,1 Гц, H-6″), 6,99-7,02 (4 H, м, ароматич. H), 7,13 (1 H, т, J = 7,4 Гц, H-4′), 7,36-7,39 (4 H, м, ароматич. H), 7,59 (1 H, с, H-6), 11,57 (1 H, с, NH). 13C ЯМР (ДМСО-d6): δ 18,5; 19,7; 49,5; 112,8; 116,5; 117,8; 118,7; 118,8; 123,6; 126,1; 129,6; 129,9; 130,1; 131,7; 132,2; 136,4; 142,9; 149,8; 156,3; 156,5; 161,7;5-[(3;5-Диметилфенил)амино]-1-(4-феноксибензил)урацил (23). 1 H ЯМР (ДМСО-d6): δ 4,30 (6 H, с, CH3), 4,84 (2 H, с, CH2), 6,67 (1 H, т, J = 7,3 Гц, H-4′), 6,76 (2 H, д, J = 8,4 Гц, H-2′, H-6′), 6,91-7,05 (5 H, м, NH, H-2″, H-6″, H-2″′, H-6″′), 7,11 (1 H, т, J = 7,8 Гц, H-4″′), 7,28 (2 H, д, J = 7,3 Гц, H-3″, H-5″), 7,32 (2 H, д, J = 8,4 Гц, H-3″′, H-5″′), 7,69 (1 H, с, H-6), 11,56 (1 H, с, NH); 13C ЯМР (ДМСО-d6): δ 21,2; 49,5; 112,4; 117,0; 118,7; 120,2; 123,6; 129,7; 130,1; 132,1; 134,4; 137,8; 145,6; 150,0; 156,4; 161,9;5-[(2-Метоксифенил)амино]-1-(4-феноксибензил)урацил (24). 1 H ЯМР (ДМСО-d6): δ 3,37 (3 H, с, OCH3), 4,91 (2 H, с, CH2), 6,49 (1 H, с, NHAr), 6,74-7,01 (7 H, м, ароматич. H), 7,13 (1 H, т, J = 7,4 Гц, H-4′), 7,35-7,39 (3 H, м, ароматич. H), 7,66 (1 H, с, H-6), 11,70 (1 H, с, NH). 13C ЯМР (ДМСО-d6): δ 50,1; 55,9; 110,9; 113,4; 117,4; 119,0; 119,5; 121,1; 123,8; 129,8; 130,1; 130,4; 132,5; 133,4; 147,7; 149,8; 156,5; 156,9; 161,8;5-[(3-Метоксифенил)амино]-1-(4-феноксибензил)урацил (25). 1 H ЯМР (CDCl3): δ 3,62 (3 H, с, OCH3), 4,88 (2 H, с, CH2), 6,26 (1 H, д, J = 8,3 Гц, H-4′), 6,32 (1 H, s, H-2′), 6,36 (1 H, д, J = 8,1 Гц, H-6′), 6,92-7,06 (6 H, м, NH, H-5′, H-2″, H-6″, H-2″′, H-6″′), 7,13 (1 H, т, J = 7,5 Гц, H-4″′), 7,31-7,43 (4 H, м, H-3″, H-5″, H-3″′, H-5″′), 7,71 (1 H, с, H-6), 11,59 (1 H, с, NH); 13C ЯМР (ДМСО-d6): δ 50,0; 55,0; 100,4; 104,3; 107,5; 116,9; 119,0; 123,9; 129,9; 130,0; 130,4; 132,3; 135,4; 147,4; 150,3; 156,6; 156,8; 160,4; 162,1.
Противовирусная активность
Изучение противовирусных свойств синтезированных соединений было осуществлено в культуре клеток Huh 7.5, инфицированных ВГС (штамм JFH-1), в соответствии с описанным методом [11]. В результате проведенных исследований соединения 18, 19 и 23 проявили выраженную ингибиторную активность в диапазоне ИК50 12,59–13,8 µМ. Данные по активности синтезированных соединений представлены в табл. 2.
Таблица 2
Анти-ВГС активность синтезированных соединений
|
Соединение |
ИК50, μM |
Цитотоксичность |
|
|
ЦК50, μM |
ИС |
||
|
18 |
13,8 |
> 316,2 |
> 22,9 |
|
19 |
12,59 |
– |
– |
|
20 |
> 100 |
– |
– |
|
21 |
> 100 |
– |
– |
|
22 |
> 200 |
– |
– |
|
23 |
12,89 |
52,48 |
4,07 |
|
24 |
> 100 |
– |
– |
|
25 |
> 100 |
– |
– |
Примечания:
ИК50 – ингибиторная концентрация – концентрация вещества, обеспечивающая подавление репликации вируса на 50 %;
ЦК50 – цитотоксическая концентрация – концентрация вещества, при которой наблюдается гибель 50 % неинфицированных клеток;
ИС – индекс селективности – отношение ЦК50 к ИК50.
Выводы
Таким образом, нами синтезированы 8 новых, ранее не описанных в литературе производных 5-фениламиноурацила, содержащих в положении N1 пиримидинового цикла 4-(фенокси)бензильный фрагмент. Изучены спектральные, физико-химические свойства и анти-ВГС активность синтезированных соединений.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 13-04-01391А. Авторы выражают благодарность профессору Луису Шангу (департамент биохимии, медицинской микробиологии и иммунологии, университет Альберты, Эдмонтон, Канада) за данные скрининга.
Рецензенты:
Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения, Волгоградский государственный медицинский университет, г. Волгоград;
Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии, Волгоградский государственный медицинский университет, г. Волгоград.
Работа поступила в редакцию 10.10.2014.
Библиографическая ссылка
Гуреева Е.С., Бабков Д.А., Озеров А.А., Новиков М.С. СИНТЕЗ ПРОИЗВОДНЫХ 5-ФЕНИЛАМИНОУРАЦИЛА КАК ПОТЕНЦИАЛЬНЫХ АНТИ-ВГС АГЕНТОВ // Фундаментальные исследования. 2014. № 11-3. С. 570-574;URL: https://fundamental-research.ru/ru/article/view?id=35562 (дата обращения: 03.07.2025).



