Синтез новых органических потенциально биологически активных веществ (БАВ), изучение их активности и взаимосвязи «структура – биологическое действие» является актуальной задачей фармацевтической химии. Весьма перспективным направлением является поиск новых БАВ в ряду замещенных амидов пиридин-2-карбоновой (пиколиновой) кислоты.
Известно, что пиколиновая кислота обладает антибактериальной активностью в отношении S. aureus, S. epidermidis, E. coli [7]. Производное пиридин-2-карбоновой кислоты – фузариновая кислота обладает антибактериальной, инсектицидной, бактерицидной активностью [8]. Синтезированные нами ариламиды пиридин-2-карбоновой кислоты, обладают противовоспалительной или анальгетической активностью [1]. Приведенные данные литературы свидетельствуют о том, что среди производных пиридин-2-карбоновой кислоты имеются биологически активные вещества.
Целью исследования – разработать методики синтеза новых потенциально биологически активных соединений в ряду производных пиридин-2-карбоновой кислоты на основе хлорангидрида пиридин-2-карбоновой кислоты для получения эфиров или амидов пиридин-2-карбоновой кислоты, изучение их физико-химических свойств. Проанализировать результаты биологических испытаний полученных соединений на противомикробную активность в сравнении с активностью препаратов-эталонов. Выявить взаимосвязь структура – активность в ряду эфиров и амидов пиридин-2-карбоновой кислоты.
Материалы и методы исследования
Структура полученных соединений подтверждена спектральными методами анализа. ЯМР 1Н-спектры записаны на спектрометре ЯМР MERCURY-300 фирмы Varian, (300 МГц), в ДМСО-d6, внутренний стандарт – ГМДС. Ход реакций и чистоту соединений контролировали методом ТСХ на пластинах Silufol UV-254 в системе углерод четыреххлористый – ацетон (6:1), пятна детектировали парами йода. Данные элементного анализа синтезированных веществ соответствуют вычисленным значениям. Биологические испытания синтезированных соединений проведены согласно методическим указаниям.
Результаты исследования и их обсуждение
В литературе известна реакция 4-нитрофениловых эфиров 2-замещённых никотиновых кислот с аминокислотами: ГАМК, глицин, ?-аланин, глутаминовая кислота с образованием соответствующих амидов никотиновой кислоты [3]. Для изучения реакционной способности ариловых эфиров пиридин-2-карбоновой кислоты проведены квантово-химические расчеты 4-бромфенилпиридин-2-карбоновой кислоты с использованием пакета программ GAUSSIAN 03W [6] неэмпирическим методом Хартри – Фока RHF/6-31 G(d) с полной оптимизацией геометрических параметров молекулы. Установлено, что на гетероатоме азота, кислороде карбонильной и эфирной групп имеются отрицательные заряды, соответственно: 0,038; 0,073; 0,080, а на углероде карбонильной группы положительный заряд 0,417 в единицах заряда электрона. Эти данные свидетельствуют о реакционной способности эфирной группы ариловых эфиров пиридин-2-карбоновой кислоты.
В ходе опытов было установлено, что при нагревании эфира 4-бромфенилпиридин-2-карбоновой кислоты с аминами в среде ДМФА образуются соответствующие замещённые амиды пиридин-2-карбоновой кислоты (соединения 5, 7, 8). В то же время при взаимодействии эквимолекулярных количеств хлорангидрида пиридин-2-карбоновой кислоты с фенолом или ариламином в бензоле в присутствии триэтиламина образуются соответствующие ариловые эфиры (1–4) или замещённые амиды пиридин-2-карбоновой кислоты (5–12) по схеме:
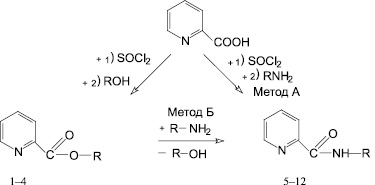
1-4 R = С6H4Br - 4 (1), R = C6H3(NO2)2 - 2,4 (2), R = C6H3(NO2)2 - 2,6 (3), R = C6H4NO2 - 4 (4),
5-12 R = С6Н3 Cl2 - 2,4 (5), R = C6H3(NO2)2 - 2,4 (6), R = С6Н4Br - 4 (7), R = С6Н4CI - 4 (8),
R = С6Н4I - 4 (9), R = C6H4NO2 - 2 (10), R = C6H4NO2 - 3 (11), R = C6H4NO2 - 4 (12).
Полученные соединения (1–12) – это белые кристаллические вещества, нерастворимые в воде и растворимые при нагревании в органических растворителях: диоксане, ДМФА.
Общая методика получения ариловых эфиров пиридин2-карбоновой кислоты (1–4)
К 1,23 г (0,01 моль) пиридин-2-карбоновой (пиколиновой) кислоты прибавляют 20–30 мл тионилхлорида и кипятят на водяной бане 1 час. Избыток тионилхлорида отгоняют при пониженном давлении. Остаток растворяют в 20 мл бензола и прибавляют (0,01 моль) соответствующего фенола, растворенного в 40–50 мл бензола и 0,01 моль триэтиламина. Реакционную массу нагревают на водяной бане в течение 1 часа. Бензол и летучие продукты отгоняют с водяным паром. Остаток обрабатывают 10 % раствором гидрокарбоната натрия, отфильтровывают и перекристаллизовывают соединения из диоксана. Выходы продуктов реакций составляют 71–89 %.
Таблица 1
Характеристики ариловых эфиров (1-4) и замещенных амидов (5-12) пиридин-2-карбоновой кислоты
|
Соединение |
R |
Брутто-формула |
Тпл, °С |
Выход, % метод А |
Выход, % метод Б |
Rf* |
|
1 |
С6H4Br - 4 |
С12Н8BrNO2 |
237-240 |
89 |
|
0,56 |
|
2 |
C6H3(NO2)2 - 2,4 |
C12H8N3O6 |
145-146 |
82 |
|
0,36 |
|
3 |
C6H3(NO2)2 - 2,6 |
C12H8N3O6 |
212-215 |
79 |
|
0,39 |
|
4 |
C6H4NO2 - 4 |
C12H9N2O4 |
130-131 |
71 |
|
0,45 |
|
5 |
С6Н3 Cl2 - 2,4 |
C12H8Cl2N2O |
144-145 |
82 |
76 |
0,62 |
|
6 |
C6H3(NO2)2 - 2,4 |
C12H8N4O5 |
162-163 |
77 |
|
0,12 |
|
7 |
С6Н4Br - 4 |
С12Н9 BrN2O |
135-137 |
80 |
74 |
0,64 |
|
8 |
С6Н4Cl - 4 |
С12Н9CINO2 |
134-135 |
74 |
70 |
0,57 |
|
9 |
С6Н4I - 4 |
C12H9JN2O |
148-150 |
74 |
|
0,65 |
|
10 |
C6H4NO2 - 2 |
C12H9N3O3 |
152-153 |
77 |
|
0,60 |
|
11 |
C6H4NO2 - 3 |
C12H9N3O3 |
158-160 |
79 |
|
0,36 |
|
12 |
C6H4NO2 - 4 |
C12H9N3O3 |
251-252 |
83 |
|
0,41 |
Примечание. * – в системе углерод четыреххлористый – ацетон (6:1).
Общая методика получения амидов пиридин-2-карбоновой кислоты (5–12). Метод А
К 1,23 г (0,01 моль) пиридин-2-карбоновой кислоты прибавляют 20–30 мл тионилхлорида и нагревают на водяной бане 3 часа. Избыток тионилхлорида отгоняют в вакууме. К охлажденной реакционной массе прибавляют 0,01 моль соответствующего амина, растворенного в 40–50 мл бензола и 3–4 мл триэтиламина. Реакционную массу нагревают на водяной бане в течение 1 часа. Бензол и летучие продукты отгоняют с водяным паром. Остаток обрабатывают 10 % раствором NaHCO3, отфильтровывают и перекристаллизовывают соединения из диоксана. Выходы продуктов реакций составляют 74–83 %.
Общая методика получения амидов пиридин-2-карбоновой кислоты (5, 7, 8). Метод Б
К 2,8 г (0,01 моль) 4-бромфенилового эфира пиридин-2-карбоновой кислоты прибавляют (0,01 моль) ариламина, 5 мл ДМФА и нагревают при температуре 150 °С в течение 3 часов. К охлажденной реакционной массе прибавляют 50 мл воды. Остаток отфильтровывают и перекристаллизовывают из диоксана. Выход продуктов реакции составляет 70–76 %. Смешанная проба плавления полученных соединений c аналогичными веществами полученными по методу А не дала депрессии температуры плавления.
Структура полученных соединений 1–12 подтверждена данными ЯМР 1Н-спектрометрии. В спектрах ЯМР1Н соединений 5–12 имеются характерные сигналы протонов ?, м.д.: 10,33–12,22 (1 H, с., NHамид,), группа линий ароматических и гетероциклических протонов в области 7,92–8,36.
Биологические исследования
В структуре некоторых противомикробных лекарственных средств [2] имеются нитрогруппы или галогены, поэтому целенаправленным синтезом нами были получены целевые продукты, в которых есть эти фармакофорные фрагменты.
Испытания синтезированных соединений проведены согласно методическим указаниям «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» [5]. Анализ результатов биологических испытаний апробированных соединений проведен в сравнении с литературными данными по активности препаратов-эталонов: этакридином и диоксидином [4].
Противомикробная активность полученных эфиров и амидов определена методом двукратных серийных разведений в жидкой питательной среде по отношению к тест-штаммам S.aureus ATTC 6538-P и E. coli ATCC 25922. Исходная концентрация исследуемых соединений – 1000 мкг/мл. Микробная нагрузка составила 250000 микробных тел/мл. Учет результатов проводился через 18–20 ч термостатирования при 37 °C. Для всех исследуемых соединений определяли минимальную подавляющую концентрацию (МПК), при которой происходит подавление роста соответствующего микроорганизма. Результаты испытаний приведены в табл. 2.
Таблица 2
Противомикробная активность ариловых эфиров (1-4) и замещённых амидов (5-12) пиридин-2-карбоновой кислоты
|
Соединение |
R |
Минимальная подавляющая концентрация (МПК), мкг/мл |
|
|
S. aureus |
E. coli |
||
|
1 |
С6H4Br - 4 |
250 |
500 |
|
2 |
C6H3(NO2)2 - 2,4 |
500 |
500 |
|
3 |
C6H3(NO2)2 - 2,6 |
250 |
500 |
|
4 |
C6H4NO2 - 4 |
500 |
250 |
|
5 |
С6Н3 Cl2 - 2,4 |
500 |
1000 |
|
6 |
C6H3(NO2)2 - 2,4 |
250 |
250 |
|
7 |
С6Н4Br - 4 |
250 |
500 |
|
8 |
С6Н4Cl - 4 |
500 |
1000 |
|
9 |
С6Н4I - 4 |
1000 |
1000 |
|
10 |
C6H4NO2 - 2 |
1000 |
не активн. |
|
11 |
C6H4NO2 - 3 |
1000 |
1000 |
|
12 |
C6H4NO2 - 4 |
250 |
500 |
|
Этакридин |
2000 |
500 |
|
|
Диоксидин [7] |
62,5-1000 |
3,9-62,5 |
|
Большинство изученных соединений в опытах показали слабую противомикробную активность, их МПК составляет 250–1000 мкг/мл, что соответствует таковой этакридина. Соединение 6 проявляет активность в отношении обеих культур при МПК равной 250 мкг/мл, что соответствует действию диоксидина на золотистый стафилококк, но уступает влиянию на кишечную палочку.
Таким образом, на основании проведенных исследований следует, что поиск биологически активных соединений в рядах эфиров и амидов пиридин-2-карбоновой кислоты является перспективным.
Выводы
- В ходе проведенного исследования установлено, что при нагревании хлорангидрида пиридин-2-карбоновой кислоты с фенолом или ариламином с хорошими выходами образуются соответствующие ариловые эфиры или амиды пиридин-2-карбоновой кислоты.
- Данные расчетов показывают, что ариловые эфиры пиридин-2-карбоновой кислоты проявляют реакционную способность при взаимодействии с ариламинами.
- Индивидуальность полученных соединений установлена с помощью ТСХ, а химическая структура – спектральными данными.
- Противомикробная активность синтезированных соединений зависит от заместителей в ароматическом кольце амидной группы.
Рецензенты:
Хомов Ю.А., д.фарм.н., профессор кафедры фармацевтической химии ФДПО и ФЗО, ГБОУ ВПО ПГФА Министерства здравоохранения России, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Россия, г. Пермь.
Работа поступила в редакцию 01.10.2014.
Библиографическая ссылка
Бояршинов В.Д., Михалев А.И., Ухов С.В., Новикова В.В., Данилов Ю.Л. СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ ЭФИРОВ И АМИДОВ ПИРИДИН-2-КАРБОНОВОЙ КИСЛОТЫ // Фундаментальные исследования. 2014. № 11-1. С. 105-109;URL: https://fundamental-research.ru/ru/article/view?id=35486 (дата обращения: 20.01.2026).



