Проведенные ранее исследования центральных симпатоингибирующих свойств у антиаритмиков II, III и IV классов – пропранолола, амиодарона и верапамила ‒ выявили способность данных препаратов оказывать различной степени выраженности превентивное либо купирующее действие при аритмиях, индуцированных химической и электростимуляцией симпатоактивирующего центра продолговатого мозга кошек [1,2], а также подавлять выработку возбуждающих и увеличивать содержание тормозных нейроаминокислот в этой области мозга [3, 4, 5].
Учитывая полученные данные, представляло интерес исследовать влияние вышеназванных антиаритмиков на основные рецепторные системы, принимающие участие в центральных механизмах регуляции сердечного ритма. К ним относятся два различных семейства рецепторных систем, отличающихся по механизмам передачи внеклеточного сигнала с плазматической мембраны нейронов и формирования клеточного ответа. Одно из семейств мембранных рецепторов нейромедиаторов/нейромодуляторов ЦНС объединяет рецепторы, встроенные в плазматические мембраны нейронов, которые одновременно являются ионными каналами. Активацию таких рецепторов можно оценить по изменению содержания ионов кальция, натрия, хлора в синаптосомальных везикулах, образованных плазматическими мембранами. К ним относятся 5-HT3-тип рецепторов серотонина и P2X-пуриновые рецепторы, ГАМКA-тип рецепторов ГАМК- и NMDA-тип рецепторов глутамата.
Активность 5-HT3-типа рецепторов серотонина и P2X-пуриновых рецепторов опосредована открытием кальциевого канала и последующим повышением внутриклеточного/синаптосомального уровня свободных ионов кальция ([Са2 + ]вн) [6]. Активность ГАМКA типа рецепторов ГАМК определяется током ионов хлора через ионофор, входящий в состав ГАМК-бензодиазепинового комплекса [7]. Активация NMDA-типа рецепторов глутамата сопровождается открытием катионового канала и поступлением ионов кальция и натрия из внеклеточного пространства в синаптосомы [8].
Другое семейство мембранных рецепторов нейромедиаторов/нейромодуляторов ЦНС представлено рецепторами, локализованными в плазматических мембранах нейронов, работа которых сопряжена с активацией G-белков.
Целью исследования явилось сравнительное изучение влияния антиаритмиков различных классов – пропранолола (II), амиодарона (III) и верапамила (IV) ‒ на функциональную активность рецепторов, сопряженных с ионными каналами (5-HT3-тип рецепторов серотонина, ГАМКA-тип рецепторов ГАМК, NMDA-тип рецепторов глутамата и P2X-пуриновые рецепторы).
Материалы и методы исследования
Везикулы плазматических мембран – синаптосомы – из вентролатеральных отделов продолговатого мозга (ВЛПМ) кошек получали методом дифференциального центрифугирования в градиенте перколла [9]. Для оценки изменений внутриклеточной концентрации свободных ионов кальция и натрия использовали специфические флуоресцентные индикаторы Fluo-3 и SBFI. Процедуры нагружения синаптосом флуоресцентными зондами, расчет концентрации ионов в везикулах проводили по методикам, описанным в работах [10, 11]. Конечная концентрация зондов во внутривезикулярной среде составляла 5–7 мкМ. Концентрацию везикулярного ионизированного кальция ([Са2+]вн) рассчитывали по формуле [12]:
[Са2+ ]вн = Кd×(Fmax – F530)/(F530 – Fmin),
где F530 - интенсивность флуоресценции образца при 530 нм; Fmax – флуоресценция в условиях насыщения зонда кальцием, определяемая после внесения 30 мкМ дигитонина и 1 мМ СaCl2; Fmin - интенсивность флуоресценции при нулевой (в присутствии 5 мМ ЭДТА и 5 мкМ А23187) концентрации кальция; Кd - равновесная константа диссоциации комплекса Fluo-Ca, равная 0,42 мкМ. Перед измерением включения Са2 + пробы преинкубировали при 37° в течение 30 мин – времени, достаточного для достижения равновесия в системе «среда-везикулы». Для вычисления количества Са2+, накопленного в везикулах, в предварительных экспериментах был определен внутривезикулярный объем (W), который составил 92 мкл/мг белка.
Для перерасчета интенсивности флуоресценции зонда SBFI в [Na + ]вн выполняли процедуру калибровки как описано в работе [13]. Концентрацию ионов натрия в везикулах рассчитывали по формуле
[Na+]цит = Kd×k×(R – Rmin)/(Rmax – R),
где R – отношение флуоресценции при длинах возбуждающего света 340 нм (F340) и 380 нм (F380); Rmin и Rmax – то же при нулевой и насыщающей концентрации [Na+]цит (150 mM); k – отношение интенсивности флуоресценции при 380 нм для свободного и связанного зонда (2,1 ± 0,1); Kd – равновесная константа диссоциации комплекса зонд-Na, равная 20,8 ± 1,4 мМ [13].
Определение изменений содержания ионов хлора ([Cl-]вн) в изолированных синаптосомах основано на использовании флуоресцентного индикатора Cl-, 6-метокси-N-этилхинолина йодида (MEQ). Условия нагружения зондом, проведения калибровочной процедуры как в работе [14]. Флуоресценция образца везикул в среде, не содержащей хлор ([Cl–]о = 0 мМ), была максимальной (Fmax). Минимальное значение флуоресценции (Fmin) определяли после инкубации везикул в течение 10 мин в присутствии 150 мМ KSCN и 25 мкМ валиномицина. Анион KSCN- вытесняет Cl– из комплекса с красителем, валиномицин служит в качестве ионофора, переносящего KSCN– через плазматическую мембрану в везикулы. Для определения величины константы Штерна‒Волмера экспериментальные данные представляли в координатах Fo/FCl–; [Cl–], где Fo = Fmax – Fmin, FCl– – значение флуоресценции при заданной концентрации ионов хлора в среде ([Cl–]). Везикулярную концентрацию хлора в опытных образцах рассчитывали на основании построенной калибровочной кривой, подставляя экспериментальное значение флуоресценции образцов.
Активацию рецепторов осуществляли путем внесения в суспензию синаптосом, выделенных из вентролатеральных отделов продолговатого мозга, селективных агонистов соответствующих типов рецепторов. Для оценки специфичности выявленных изменений в качестве контроля использовали избирательные антагонисты/ингибиторы изученных в работе рецепторных систем (табл.1).
Расчет доверительных интервалов экспериментальных значений и оценку достоверности различий между ними проводили с помощью параметрического t-критерия Стьюдента при уровне значимости, равном 0,05.
Результаты исследования и их обсуждение
Влияние антиаритмических препаратов пропранолола, амиодарона и верапамила на функциональную активность 5-HT3-типа рецепторов серотонина оценивали по их действию на Са-ответ синаптосом, индуцированный селективным лигандом 5-HT3-рецепторов хлорфенил-бигуанидом. Добавление к суспензии синапотосом хлорфенил-бигуанида в конечной концентрации 0,1 мкМ приводило к статистически достоверному трехкратному увеличению концентрации свободных ионов кальция. Базальная [Са2+]вн в контрольных пробах составила 84 ± 9 нМ. Избирательный антагонист 5-HT3-типа рецепторов серотонина ондансетрон (1,0 мкМ) полностью устранял эффект селективного агониста хлорфенил-бигуанида. Результаты сравнительного анализа действия пропранолола, амиодарона и верапамила на Са-ответ синаптосом приведены на рис. 1. Видно, что в этих услових только верапамил проявил способность статически значимо уменьшать подъем уровня кальция, опосредованный активацией 5-HT3-типа рецепторов серотонина.
Таблица 1
Использованные в работе специфические лиганды различных типов рецепторов
|
Тип рецептора |
Агонист |
Антагонист |
|
5-HT3 |
Хлорфенил-бигуанид |
Ондансетрон |
|
ГАМКA |
Мусцимол |
Блокатор хлор-ионофора пикротоксин |
|
NMDA |
N-метил-D-аспартат |
CGS 19755 (мемантин) |
|
P2X |
АТФ |
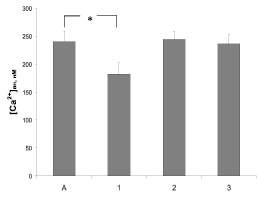
Рис. 1. Влияние верапамила 10 мкМ (1), пропранолола 30 мкМ (2) и амиодарона 20 мкМ (3) на Са-ответ, вызванный агонистом 5-HT3 типа рецепторов серотонина хлорфенил-бигуанидом (А). * – отмечены достоверные изменения (p < 0,05)
Действие пропранолола, амиодарона и верапамила на функциональную активность ГАМКA-типа рецепторов ГАМК исследовали по их влиянию на изменения концентрации Сl– в синаптосомах, вызванные специфическим лигандом этих рецепторов мусцимолом. Внесение в суспензию синапотосом мусцимола в конечной концентрации 10 мкМ приводило к повышению концентрации свободных ионов хлора до максимального значения 36 мМ. [Сl–]вн в контрольных пробах в отсутствие индуктора составляла 14 ± 4 мМ. Блокатор хлорного ионофора пикротоксин (50 мкМ) подавлял стимулирующий эффект мусцимола. При изучении действия пропранолола, амиодарона и верапамила на Сl-ответ синаптосом достоверных изменений отмечено не было (рис. 2).
Исследование влияния изучаемых антиаритмиков на функциональную активность NMDA типа рецепторов глутамата включало определение их действия на содержание в синаптосомах свободных ионов Na+ и Са2+. Избирательный лиганд этого типа рецепторов N-метил-D-аспартат (3 мкМ) достоверно увеличивал базальные значения концентрации катионов в 2,8 и 1,5 раза соответственно. Сравнительное изучение влияния препаратов на Са- и Na-ответы синаптосом показали, что верапамил и амиодарон значимо уменьшают выраженность Са-ответа на N-метил-D-аспартат (рис. 3). Только в присутствии амиодарона достоверно снижается Na-ответ синаптосом, вызванный активацией NMDA типа рецепторов глутамата (рис. 4). Действие пропранолола на этой модели не зарегистрировано.
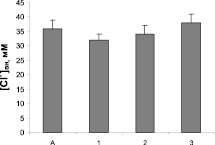
Рис. 2. Влияние верапамила 10 мкМ (1), пропранолола 30 мкМ (2) и амиодарона 20 мкМ (3) на Сl-ответ, вызванный агонистом ГАМКA-типа рецепторов ГАМК мусцимолом (А)
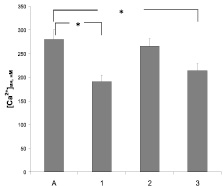
Рис. 3. Влияние верапамила 10 мкМ (1), пропранолола 30 мкМ (2) и амиодарона 20 мкМ (3) на Са-ответ, вызванный агонистом NMDA-типа рецепторов глутамата N-метил-D-аспартатом (А). * – отмечены достоверные изменения (p < 0,05)
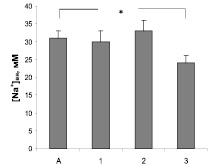
Рис. 4. Влияние верапамила 10 мкМ (1), пропранолола 30 мкМ (2) и амиодарона 20 мкМ (3) на Nа-ответ, вызванный агонистом NMDA-типа рецепторов глутамата N-метил-D-аспартатом (А). * – отмечены достоверные изменения (p < 0,05)
Эффекты пропранолола, амиодарона и верапамила в отношении функциональной активности P2X пуриновых рецепторов изучали по их влиянию на изменения концентрации Са2+ в синаптосомах, индуцированные 30 мкМ АТФ. Из данных, приведенных на рис. 5, видно, что все изученные соединения достоверно не изменяли Са-ответ синаптосом. Вероятно, этот тип рецепторов не участвует в реализации фармакологического действия указанных препаратов на активность симпатоактивирующего центра продолговатого мозга.
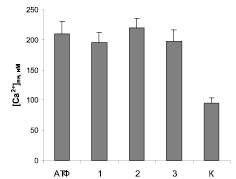
Рис. 5. Влияние верапамила 10 мкМ (1), пропранолола 30 мкМ (2) и амиодарона 20 мкМ (3) на Са-ответ, вызванный агонистом P2X-пуриновых рецепторов 30 мкМ АТФ (АТФ). Базальный уровень [Са2+]вн в контроле (К) составлял 95 ± 9 нМ
Заключение
Полученные данные свидетельствуют о вовлечении различных типов мембранных рецепторов нейромедиаторов/нейромодуляторов ЦНС, сопряженных с ионными каналами, в реализацию центрального действия антиаритмических препаратов амиодарона и верапамила (табл. 2).
Таблица 2
Влияние исследованных антиаритмических препаратов на функциональную активность различных типов рецепторов синаптосом ВЛПМ
|
Антиаритмик |
Тип рецепторов, сопряженных с ионными каналами |
|||
|
5-HT3 |
ГАМКА |
NMDA |
P2X |
|
|
Верапамил |
+ |
+ |
||
|
Амиодарон |
+ |
|||
|
Пропранолол |
||||
В то же время трудно предположить, что все описанные эффекты этих препаратов обусловлены их прямым взаимодействием с узнающими сайтами рецепторов. Не обладая прямым аффинитетом к NMDA-рецепторам глутамата и 5-HT3-типа рецепторам серотонина, антиаритмические соединения могут оказывать на них модифицирующее/аллостерическое действие, усиливая или ослабляя их способность к связыванию [15]. В свете современных представлений о веществах нового типа, не относящихся к прямым агонистам рецепторов, механизм действия изученных антиаритмических препаратов можно представить как эффект модулятора, аллостерически потенцирующего рецептор лиганда и активатора ионных каналов.
Можно полагать, что под влиянием антиаритмиков происходят конформационные изменения мембранных рецепторов нейромедиаторов/нейромодуляторов, сопряженных с ионными каналами.
Выводы
В результате изучения влияния антиаритмических препаратов пропранолола, амиодарона и верапамила на функциональную активность рецепторов, сопряженных с ионными каналами, выявлено, что антиаритмик IV класса верапамил лимитирует повышение уровня Ca2+ в синаптосомах вентролатерального отдела продолговатого мозга, опосредованное активацией 5-HT3-типа рецепторов серотонина и NMDA-типа рецепторов глутамата.
Амиодарон (III класс) уменьшает подъем уровня Ca2+ и Na+ в синаптосомах, связанный со стимуляцией NMDA-типа рецепторов глутамата.
Пропранолол (II класс) не оказывает статистически значимого действия на исследуемые типы рецепторов.
Влияние изученных антиаритмических препаратов на функциональную активность рецепторов, сопряженных с ионными каналами, может реализовываться в условиях in vivo преимущественно в виде купирующего действия. Подобный эффект определяется блокадой ионных токов по каналам для катионов (Ca2 + и Na +). По результатам наших исследований такое свойство наиболее характерно для антиаритмического средства IV класса верапамила.
Рецензенты:
Макляков Ю.С., д.м.н., профессор, зав. кафедрой фармакологии и клинической фармакологии, ГБОУ ВПО РостГМУ Минздрава России, г. Ростов-на-Дону;
Быков И.М., д.м.н., профессор, зав. кафедрой фундаментальной и клинической биохимии, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Работа поступила в редакцию 19.12.2013.
Библиографическая ссылка
Туровая А.Ю., Уваров А.В., Галенко-Ярошевский П.А., Духанин А.C., Каде А.Х. ВЛИЯНИЕ ПРОПРАНОЛОЛА, АМИОДАРОНА И ВЕРАПАМИЛА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ РЕЦЕПТОРОВ ЦНС, СОПРЯЖЕННЫХ С ИОННЫМИ КАНАЛАМИ // Фундаментальные исследования. 2013. № 12-2. С. 344-349;URL: https://fundamental-research.ru/ru/article/view?id=33332 (дата обращения: 01.07.2025).



