Новое поколение аналитических приборов, обладающих сверхвысокой чувствительностью и производительностью, сместило соотношение временных затрат в медицинской диагностике со стадии непосредственного анализа на стадию сбора, перемещения и подготовки биологических проб. Если с небольшим количеством пациентов и при достаточном количестве подготовленных медицинских работников не возникает серьёзных нареканий к традиционным, рутинным методам забора образцов биологических сред, то с увеличением числа обследуемых система детекции быстро достигает своего операционного предела. Особенно это заметно в периоды эпидемий, природных и техногенных катастроф, при масштабном скрининге больших популяций на предмет выявления маркеров инфекционных болезней или токсических веществ.
Вопрос оптимизации и упрощения методов отбора биологических образцов стоит крайне остро и из-за высокого уровня вторичных инфекций, полученных в результате повторного использования или случайного накалывания на неправильно утилизируемые иглы. По данным Всемирной организации здравоохранения (ВОЗ), в мире ежегодно более трех миллионов медработников получают производственные травмы при использовании металлических игл от шприцов. При этом 327,000 человек травмируются иглами, инфицированными вирусом иммунодефицита, 2,100,000 – вирусом гепатита В и 926,000 – вирусом гепатита С, что приводит к заболеванию СПИДом 1000 человек, гепатитом В – 66,000 человек и гепатитом С – 16,000 человек [12].
Классическая система забора крови с использованием иголок или ланцетов болезненна и является негативным психологическим фактором для пациентов, особенно если пациент вынужден отбирать кровь несколько раз в день на протяжении длительного промежутка времени, а порой и всей жизни (сахарный диабет). При использовании данной системы происходит забор значительно большего объема крови, чем требуется для анализа, так например, система иммунодетекции «SIMOA» проводит анализ флюоресценции в лунках объемом несколько фемтолитров и способна детектировать фемто-оттомолярные концентрации биомаркеров [13]. Учитывая незначительные объемы вещества, необходимые для современной клинической диагностики, альтернативой крови может быть подкожная межтканевая жидкость [9]. Состав МТЖ из-за разветвленности подкожной капиллярной сети идентичен набору биомаркеров и метаболитов в крови [14], а некоторые компоненты, такие как соли тяжелых металлов, способны откладываться в подкожном слое.
Широкомасштабный отбор МТЖ можно проводить с помощью микроигольных аппликаторов (МИА) [8, 15]. МИА, имея высоту иголок не более 600 мкм, проникают сквозь кератиновый слой кожи и входят в эпидермис, поверхностный слой живых клеток, в котором нет нервных окончаний, поэтому их введение является безболезненным [5]. Также использование МИА безопасно, поскольку именно в эпидермисе находятся важнейшие элементы иммунной системы человека, клетки Лангерганца, и вероятность проникновения инфекции значительно меньше, чем при обычной подкожной инъекции, когда игла проникает глубже этого защитного слоя [3, 11]. Таким образом, введение в кожу МИА не требует специальной медицинской подготовки, что делает их особенно востребованными для систем самодетекции и широкомасштабного скрининга.
Конструирование МИА является непростой инженерной задачей и требует привлечения большого количества методов микропроизводства и химической инженерии [6, 10]. Создавая МИА, следует учитывать изменение свойств материалов и полимеров в микроразмерном состоянии, а также необходимость жесткого отбора материалов и компонентов на биосовместимость, что значительно сокращает их выбор.
Методами наклонной ультрафиолетовой литографии, микроштамповки и кислотного травления нами были созданы МИА с полыми металлическими иглами [2] (рис. 2, а). Они прекрасно проникали через кератиновый слой кожи, но частично забивались фрагментами ткани. Чтобы ускорить процесс и увеличить объем отбираемой МТЖ, на МИА накладывались дополнительные вакуумные аппликаторы, которые давали желаемый эффект, но делали всю систему отбора громоздкой и мало производительной.
Помимо вакуумного отбора через полые МИА можно использовать процесс диффузии МТЖ в полимерные иглы. Методом микроштамповки нами были созданы твердые растворимые микроиглы на основе карбоксиметилцеллюлозы (КМЦ)[7] (рис. 2, b). Данные микроиглы правильной пирамидальной формы обладают достаточной жесткостью и упругостью, чтобы надежно, с вероятностью 100 % проникать через кератиновый слой свиной кожи и входить в эпидермис (рис. 3, с, d). Через 3 секунды после введения на концах микроигл отмечается растворение КМЦ [7], но процесс всасывания жидкости идет медленно.
Группа японских исследователей, создавая систему малоинвазивной детекции глюкозы в МТЖ, применила последовательно прокалывание кожи нерастворимыми пластиковыми МИА с последующим наложением на это место гидрогеля, обеспечивающего адсорбцию вытекающей МТЖ [14]. Метод показал корреляцию уровня глюкозы, измеренной в крови, с ее уровнем в отобранной МТЖ .
Нами сконструирована система, позволяющая отбирать МТЖ не в два, а в один этап. МИА состояли целиком из кроссполимеризованного гидрогеля, полимеров ПМЭ/МА и ПЭГ. Установлено, что данные МИА обладают достаточной жесткостью, чтобы проникнуть через кератиновый слой кожи, но при попадании в водную среду они начинают стремительно насыщать жидкость.
Материалы и методы исследования
Микроштамповка. Микроштамповочные формы создавали методом фотолитографии и литья [10]. Пошаговая схема представлена на рис. 1. Материнскую мастер-форму создавали, используя эпоксиполимер SU-8 (SU-8 2025, Microchem). Выпуклые мастер-формы были сделаны из полидиметилсилоксана (ПДМС) (PDMS, Sylgard 184, Dow Corning). ПДМС структуры напыляли частицами золота, используя систему напыления (601 Sputtering System, CVC Product). Метод производства полых микроигл описан ранее [2].
МИA на основе КМЦ. Более подробно методика формирования растворимых микроигл описана Ли с соавторами [7]. Карбоксиметилцеллюлозу низкой вязкости (CMC, N360384, Aldrich) растворяли в деионизованной воде с добавлением 0,15 % красителя сульфорадомина-Б. Нагревая раствор до 70 °С, воду постепенно выпаривали до достижения КМЦ финальной концентрации в 20 %. Она образовывала вязкий гидрогель. На 20 мин 300–400 мг данного раствора помещали в материнскую ПДМС-форму при отрицательном давлении в 4,1 бара, чтобы переместить раствор в полости микроигл. МИА высушивали 48 часов и вынимали из ПДМС формы. Перед наложением на кожу МИА взвешивали.
МИA на основе ПЭГ-диакрилата. К раствору, содержащему 10–20 % вес/объем ПЭГ-диакрилата Mм 10 кДа (Sigma) в фосфатном буфере (pH7.4), добавляли катализатор Irgracure 2959 (Ciba, 100 мг/мл в 100 % спиртовом растворе) в конечной концентрации 30 мкл/мл [1]. Раствор помещали в материнскую форму и под вакуумом проводили её заполнение. Полимеризацию ПЭГ-диакрилата (ПЭГДА) осуществляли экспозицией длинноволновым ультрафиолетовым светом (365 нм, 10 мВт/см2) в течение 10 мин. После чего высушивали форму при комнатной температуре в течение 24 ч.
МИA на основе ПЭГ/ PMVE/MA. Для получения гидрогеля с повышенной жесткостью МИ и структурированной (сохраняющей свою форму в гидратированном состоянии) головной частью использован ко-полимер поли (метилвинилового эфира и малеиновой кислоты) ПМВЭ/МК (Sigma) 1980 кДа и ПЭГ 10 кДа (Sigma) [4]. Заливка форм производилась по этапам, отображенным на рис. 1. Соотношение полимеров – 2:1 (15 % ПМВЭ/МК и 7,5 % PEG). После заполнения штамповочной формы кроссшивку ко-полимеров осуществляли термокатализом при 80 °C в течение 24 ч. Термокатализ проводили либо непосредственно сразу после заливки, либо после предварительного высушивания формы в течение 24 часов в вытяжном шкафу.
Аппликации МИА (in vitro). МИА накладывали посредством надавливания на него большим пальцем руки на свиную кожу с удалённым слоем подкожного жира, после чего МИА фиксировался на поверхности кожи липким пластырем (Blenderm, 3M). Анализ насыщения МИА подкожной жидкостью проводился на диффуизонном аппарате – «Ячейка Франза» (PermeGear, Bethlehen). Кожа закреплялась между верхней и нижней камерами. Раствор фосфатного буфера в нижней камере обеспечивал гидратацию кожи. Толщина свиной кожи составила 1,5–2 мм, длина микроигл – 0,6 мм. Таким образом, насыщение микроигольных аппликаторов жидкостью происходило только из кожи. Вес МИА измеряли до наложения на кожу и после, через равные промежутки времени.
Результаты исследования и их обсуждение
Современные достижения в области микроштамповки обеспечили развитие экономически эффективного производства 3-Д микроструктур. Процесс микроштамповки (микромолдинга) включает производство мастер-структуры, изготовление форм для литья, литье и разделение [2, 10]. Мастер-структуры изготавливались методом ультрафиолетовой (УФ) литографии с использованием эпоксиполимера SU-8 для обеспечения негативной фоторезистентности (рис. 1)
Твердая SU-8 форма изготавливалась наклонной УВ-литографией, позволяющей формировать отрицательно вогнутые структуры различной глубины (рис. 1, а) [10]. Глубина формы определялась размером маски и углом падения УФ-света. В областях, где SU-8 подвергался воздействию УФ света, происходило сшивание полимерного материала (рис. 1, a, отмечено темным), а области SU-8, закрытые маской и не подвергавшиеся воздействию, оставались несшитыми (рис. 1, а, показаны белым цветом). Несшитые части удалялись при помощи ПДМС (рис. 1, b). Для изготовления мастер-формы в качестве формовочного материала использовался ПДМС благодаря его механическим свойствам, обеспечивающим высокую точность копирования.
Для получения выпуклой мастер-формы раствор ПДМС вносили в полученную SU-8 форму (рис. 1, c). После высыхания и полимеризации слой ПДМС и SU-8 удалялись. Поверхность формы из ПДМС обрабатывали газом CHF3/О2 в режиме реактивного ионного травления, что обеспечивало формирование нереактивного поверхностного слоя. Выпуклую мастер-форму использовали для изготовления литьевых форм. Для этого опять же использовался ПДМС из-за его гибкости и низкой поверхностной энергии (рис. 1, d) [10].
Полимерные микроструктуры отливаются из гибких форм посредством внесения требуемого полимера в пресс-форму (рис. 1, e). Далее в этой форме микроструктуры полимера либо затвердевают и высушиваются, либо подвергаются реакциям межполимерной сшивки. На последнем этапе сформированную структуру отделяют от ПДМС формы (рис. 1, b).
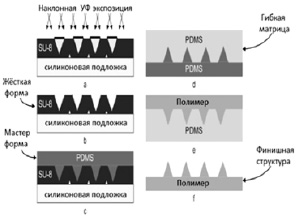
Рис. 1. Пошаговая схема изготовления пресс-форм ПДМС для создания 3-Д микроструктур: а – экспозиция УФ-светом экранированных (белый цвет) и неэкранированных (черный цвет) участков фоторесистентного эпоксиполимера SU-8; b – образование жёсткой матрицы SU-8; c – шатмповка жёсткой мастер-формы на основе (жесткость матрицы достигается после её извлечения и напыления металлами); d – штамповка гибкой мастер-формы на основе ПДМС е ‒ литьё полимерного компонента МИА в гибкую мастер-форму; f – извлечение финишной структуры МИА из гибкой формы . Гибкость формы обеспечивает сохранность финишной структуры в процессе их отделения
Альтернативный способ получения матричной формы: SU-8 форму покрывали титаном в качестве адгезирующего слоя и медью в качестве затравочного материала [2, 6]. Гальванизацией наносили никель, который образовывал выпуклую мастер-форму. Разделение никелевой выпуклой мастер-формы и SU-8 формы осуществляли путем выборочного травления слоя меди. Использование металла обеспечивает длительный срок эксплуатации мастер-формы благодаря его механической прочности и высокой термостойкости. Металлические формы впоследствии использовали для создания гибких форм ПДМС или для формирования полых металлических МИ.

Рис. 2. МИА, полученные методом микрошамповки: а – полые металлические МИА (снимок воспроизводится из статьи [2]); b – твёрдые растворимые МИА на основе КМЦ (снимок воспроизводится из статьи [7])
Выбор ПДМС в качестве основы штамповочных форм определяется не только его механическими свойствами и точностью копирования микроформ, но и способностью пропускать газ. Поэтому любые случайные нежелательные вкрапления воздуха, возникающие на границе вносимых гидрофильных полимеров и гидрофобной матрицы, могут быть легко удалены посредством воздействия вакуума или центрифугированием.
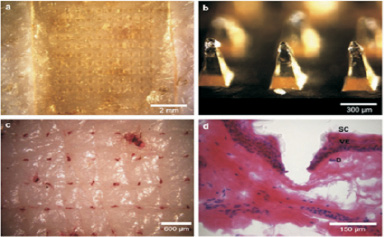
Рис. 3. МИА на основе КМЦ: а – МИА введен в кожу (вид сверху); b – МИА извлечён из кожи через 3 секунды после введения. На верхушках МИ отчетливо видно растворение полимерного матрикса; с – снимок кожи после извлечения МИА. Видны следы перфорирования кожи микроиглами; d – гистологический срез кожи через участок перфорирования. Видно,что микроигла пробила кератиновый слой кожи (SC), вошла в слой живых клеток эпидермиса (VE) и достигла верхней границы дермиса (D). Снимки воспроизведены из ранней публикации [7]
Проанализирована динамика насыщения подкожной жидкостью МИА на основе КМЦ (рис. 4). Установлена линейная зависимость объемов насыщаемой жидкости от времени наложения аппликатора. Учитывая низкую скорость насыщения жидкостью КМЦ МИА, проводилась разработка МИА на основе нерастворимого гидрогеля.
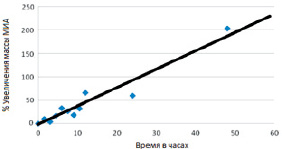
Рис. 4. Динамика изменения веса МИА на основе КМЦ после наложения на кожу in vitro (показана линейная зависимость насыщения жидкости из кожи от времени наложения)
В качестве полимерной основы гидрогеля выбран ПЭГДА, во-первых, из-за его биосовместимости, а во-вторых, из-за высокой гидроскопичности. Высокомолекулярный полимер ПЭГДА вместе с фотоактивируемым катализатором реакции ковалентной межмолекулярной сшивки вносили в гибкую форму и воздействовали вакуумом для обеспечения полного заполнения формы и удаления пузырьков воздуха. Затем форму экспонировали в длинноволновой УФ-области [1]. После высыхания кроссполимеризованного полимера его отделяли от формы.
Полученные МИ были правильной пирамидальной формы, но недостаточной жесткости для проникновения через кератиновый слой кожи. Для увеличения жесткости, к ПЭГ был добавлен сополимер – ПМВЭ/МА. Кроссшивки между полимерами возникали в результате термоинициации при температуре более 80 °С.
Для проведения катализа использованы два подхода. В первом случае внесенные в форму сополимеры помещались на 24 часа в термостат при 80 °С (рис. 4, а), а во втором случае полимерной смеси, находящейся в форме, давали возможность высохнуть 24 часа, а затем уже помещали в термостат на 24 часа для прохождения этапа межполимерной кроссшивки (рис. 5, a). МИА, подвергшиеся кроссшивке без предварительного высушивания, в отличие от высушенных и кроссшитых аппликаторов содержали большие вкрапления газов. Поэтому в дальнейшем после заливки смеси сополимеров в микроформу им давали возможность высохнуть и подвергали этапу термоинициациируемой межполимерной сшивки.
Образующиеся МИ были правильной пирамидальной формы (рис. 5, b, c), обладали достаточной жёсткостью для проникновения в эпидермис с эффективностью, аналогичной иглам на основе КМЦ (рис. 3, c). При попадании в водную среду они стремительно адсорбировали жидкость (рис. 5, d, e, f). За 20 минут масса аппликатора увеличилась на 167 %, а за 1 ч ‒ на 450 %. После набухания и высыхания МИ теряли свою заостренную форму и деформировались (рис. 5, g).

Рис. 5. Нерастворимые твердые МИА на основе кроссполимеризованного гидрогеля ПЭГ/ПМВЭ/МА: а – внесенные в форму со-полимеры либо сразу помещались на 24 часа в термостат при 80 °С (1) либо полимерной смеси, находящейся в форме, давали возможность высохнуть 24 часа, а затем уже помещали в термостат на дополнительные 24 часа для прохождения этапа межполимерной кроссшивки (2). В первом варианте видны вкрапления пузьков воздуха в структуру аппликатора; b, c – МИ имели строгую пиромидальную форму и были полностью идентичны между собой; d–f – МИА набухали в растворе разное время, после чего определялся их вес. (d) Первоначальный вес МИА был равен 132 мг; e – через 20 минут он составил 352 мг; f – а через один час ‒ 712 мг; g – после высыхания МИ теряли свою форму и деформировались
На протяжении миллионов лет кожа представляла собой защитный барьер от внешних факторов и агентов. Одна из ее основных функций – сохранение гомеостаза организма и предотвращение чрезмерной потери жидкости. Вопреки эволюционному процессу, мы хотим создать эффективную систему забора МТЖ. Созданные ранее металлические полые МИА были использованы для введения инсулина в эпидермис [2]. Также методом контролируемого вытяжения были получены стеклянные микрокапилляры заострённой формы [6, 15]. При воздействии избыточного давления на металлические и стеклянные микроиглы происходило введение инсулина в эпидермис. Однако для отбора образцов МТЖ данные МИА не подходили. Это объясняется тем, что полая структура МИ на этапе вхождения в кожу отчасти забивается как элементами кератинового слоя, так и эпидермиса. Избыточное давление способствует прохождению лекарственных препаратов через микроиголы и блокирующие элементы, использование вакуума хоть и ускоряет процесс отсасывания МТЖ, но и увеличивает загрязнение, делая всю систему громоздкой и малопроизводительной. Очевидно, что «агрессивные» методы отбора МТЖ не являются оптимальным решением проблемы.
Твердые растворимые МИА на основе КМЦ сорбировали МКЖ на поверхность аппликатора [7]. Механизм такой сорбции состоит в том, что, растворяясь, КМЦ создает локальную высокую концентрацию полимера и соответствующую ей осмотическую силу, которая перемещает МТЖ между структурами полимера в направлении увеличивающейся концентрации. Скорость процесса зависит от темпов растворения полимера (рис. 4). На начальных этапах отбора жидкости установлено быстрое ее поступление в наконечник иглы, после чего происходило растворение полимеров микроигл, что замедляло процесс отбора МТЖ (рис. 3, b).
Уменьшение времени отбора МТЖ возможно, если использовать для диагностики объем, поступивший только в сами МИ, без транспортировки на поверхность аппликатора, но в этом случае МИ должны быть пористыми, гидрофильными и нерастворимыми. Данным условиям отвечает полимерный кроссшитый гидрогель.
Наилучшую динамику сорбции жидкости показали структуры кроссшитого гидрогеля полимеров ПЭГ/ (ПМВЕ/МА) в соотношении один к двум. Впервые подобную комбинацию полимеров применил Донелли [4] для создания аппликатора доставки лекарств через кожу. В наших экспериментах масса гидрогеля увеличивалась в два с половиной раза за 20 минут иммерсии в жидкости. Стоит отметить, что непосредственно МИ имеют микронный размер и соотношение поверхность/объем у них на порядок выше, чем у всего МИА, поэтому и скорость сорбции жидкости в МИ должна быть значительно выше. Не исключено, что насыщение подкожной жидкостью только микроигольной части МИА потребует лишь нескольких минут нахождения её в коже. Для уточнения этих данных необходимо провести детальное исследование.
Важно отметить, что после набухания и высыхания, МИА на основе гидрогеля нельзя использовать повторно, т.к. из-за неравномерного высыхания, МИ деформируются (рис. 5, g), в результате чего они теряют способность проникать в эпидермис и не могут использоваться повторно или стать источником производственных травм, как при использовании металлических игл.
Заключение
Несмотря на то, что растворимые полимерные МИА на основе КМЦ медленно насыщают МТЖ, возможно их усовершенствование при наполнении дополнительных компонентов и структур.
Сконструированные на основе кроссшитого гидрогеля МИА проникают через кератиновый слой кожи, активно адсорбируют жидкость, после высыхания не дают возможности использовать их повторно, безболезненны в применении и состоят из биосовместимых полимеров. Необходимо оценить скорость поступления высокомолекулярных веществ в структуру кроссшитого гидрогеля и возможные стерические ограничения такой диффузии.
Метод термокатализируемой сшивки полимеров без дополнительных химических компонентов совместно с методом микроштамповки создают основу для промышленного копирования созданных МИА. Таким образом, МИА на основе кроссшитого гидрогеля могут быть использованы в биомедицинской диагностике как способ забора МТЖ.
Работа выполнена при финансовой поддержке министерства образования Пермского края проекта международной исследовательской группы «Микроигольные технологии – будущее диагностики».
Рецензенты:
Алексеев В.Б., д.м.н., врач высшей категории, заместитель директора по организационно-методической работе, ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», г. Пермь;
Уланова Т.С., д.б.н., профессор кафедры охраны окружающей среды, ГБОУ ВПО «Пермский национальный исследовательский политехнический университет», заведующий отделом химико-аналитических методов диагностики, ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», г. Пермь.
Работа поступила в редакцию 16.12.2013.
Библиографическая ссылка
Романюк А.В., Звездин В.Н., Самант П., Землянова М.А., Праузнитц М.Р., Устинова О.Ю. РАЗРАБОТКА МИКРОИГОЛЬНЫХ АППЛИКАТОРОВ ДЛЯ БИОМЕДИЦИНСКОЙ ДИАГНОСТИКИ // Фундаментальные исследования. 2013. № 12-2. С. 319-326;URL: https://fundamental-research.ru/ru/article/view?id=33328 (дата обращения: 22.01.2026).



