Глутамат является основным возбуждающим нейромедиатором в нервной системе млекопитающих [5, 7]. Гиперактивация NMDA-рецепторов вносит определенный вклад в судорожную активность и связанную с ней гибель нейронов, что также подтверждается большим количеством экспериментальных данных о выраженном противосудорожном эффекте антагонистов NMDA-рецепторов, проявляющемся на различных моделях судорог. Так, существуют указания на усиление антагонистами NMDA-рецепторов лечебного эффекта бензодиазепинов и барбитуратов при данных состояниях [2, 4].
NMDA-рецепторы присутствуют в большинстве нейронов ЦНС, таким образом, активация этих рецепторов лежит в основе большинства быстрых процессов передачи сигнала в ЦНС. В связи с этим активация NMDA-рецепторов приводит к двум событиям: во-первых, деполяризации постсинаптической мембраны (обусловливается входом ионов Na+ в клетку), и, во-вторых, активации Ca-зависимых белков, включая кальмодулин-зависимые протеинкиназы, протеинкиназу С, фосфолипазу А2, NO-синтазу и т.д. Таким образом, активация NMDA-рецепторов приводит к запуску как межклеточной сигнализации (деполяризация мембраны, долговременная потенциация), так и запуску внутриклеточных каскадов передачи сигнала. Реполяризация клеточной мембраны после активации NMDA-рецепторов происходит в основном за счет активности Na/K-АТФазы, которая восстанавливает градиенты ионов Na+ и К+. Между NMDA-рецепторами и Na/K-АТФазы существует прямая функциональная связь [4].
L-глутамат является основным медиатором проведения возбуждения в синапсах нервной системы позвоночных. Идентифицированы множественные глутамат-рецепторы, которые, кроме участия в быстром проведении возбуждения, являются также критическим фактором в пластичности синапсов. Нарушения Са2+-проницаемости данных каналов приводят к ряду нейродегенеративных заболеваний, среди которых болезнь Паркинсона, паралич, эпилепсия.
Основными ингибиторными нейротрансмиттерами в ЦНС являются ГАМК и глицин. Они содержатся во вставочных нейронах, и благодаря им осуществляется пресинаптическая ингибиция в спинном мозге. ГАМК (гамма-аминомасляная кислота) синтезируется при декарбоксилировании глутамата. Активируемая через импульсы от подкорковых образований и коры мозжечка посредством ретикуло-, рубро- и вестибулоспинального трактов, ГАМК связывается с рецепторами постсинаптической мембраны. Различают 3 основных рецепторных сайта: ГАМК, бензодиазепиновый и барбитуратовый сайт. Особое значение имеют рецепторные области для связывания с бензодиазепинами и барбитуратами, причем бензодиазепины усиливают ГАМК-эргическую ингибицию на пресинаптические терминали. Все основные эффекты бензодиазепинов – седативный, противотревожный, противосудорожный, мышечной релаксации и другие – осуществляются через ГАМК-А-рецепторы [2, 7]. Блокада NMDA-рецепторов приводит к снижению обмена веществ и наркозу. Стимуляция тормозных ГАМК-рецепторов успокаивает организм, снижает обмен веществ, но не вызывает наркоза. Применение препаратов, действующих на NMDA и ГАМК-рецепторы, осложняется тем, что к ним развивается быстро привыкание и зависимость, эти препараты очень долго выводятся из организма. Поэтому мы в наших исследованиях изучили свойство нейтральных газов снижать потребление кислорода организмом и доказали, что механизмом этого действия является блокада NMDA-рецепторов и возбуждение ГАМК-тормозных рецепторов.
Цели и задачи исследования ‒ изучить рецепторные механизмы действия нейтральных газов (аргон, криптон, ксенон) на основе антагониста NMDA-рецептора нембутала и агониста бензодиазепинового рецептора медазепама [7].
Материалы и методы исследования
В опытах использовались лабораторные животные ‒ крысы. Крыса помещалась в изолированную газонепроницаемую камеру, которая имела штуцеры входа газа и выхода [1]. Камера заполнялась воздухом, воздух прокачивался воздушным насосом через датчики кислорода и опять возвращался в камеру. Таким образом, концентрация кислорода постепенно уменьшалась. С датчиков газа напряжение преобразования подавалось на аналого-цифровой преобразователь (АЦП) и вводилось и регистрировалось на компьютере. Частота записи измерения показаний была равна одной минуте. Для исследования брали газовые смеси – воздух (азота 80 %, кислорода 20 %), кислородно-ксеноновую (кислорода 20 %, ксенона 80 %), кислородно-аргоновую смесь (кислорода 20 %, аргона 80 %), кислородно-криптоновую смесь (кислорода 20 %, криптона 80 %). Выдыхаемый углекислый газ поглощался. Газовые смеси готовили по показаниям соответствующих датчиков газа. Изучалось влияние на потребление кислорода транквилизатора медазепама, механизм действия которого состоит в усилении ГАМК-эргического торможения [7]. Проводились опыты, когда на фоне медазепама давалось дыхание с аргоном, криптоном, ксеноном, что позволило выявить механизмы действия нейтральных газов.
Изучалось влияние на потребление кислорода барбитурата нембутала, механизм действия которого состоит в уменьшении тонуса возбуждающих NMDA рецепторов и в усилении ГАМК-эргического торможения [7]. Проводились опыты, когда на фоне нембутала давалось дыхание с аргоном, криптоном, ксеноном, что позволило выявить механизмы действия нейтральных газов.
Результаты исследования и их обсуждение
В опытах использовались крысы весом 400 ± 50 г. В контрольной группе и на фоне аргона проведено по 25 опытов.
Камера была изготовлена из стекла и имела объем 1850 мл. Поглощение кислорода в контроле (рис. 1) за 30 мин было 18,85 ± 0,5 мл/кг/мин. Поглощение кислорода в аргоне за 40 мин было 14,95 ± 0,7 мл/кг/мин. В аргоне уменьшилось потребление кислорода (рис. 1) на 26,7 % (при P < 0,05). Время максимального выживания в аргоне увеличилось на 33,3 % (при P < 0,05).
Для анализа действия криптона в опытах использовались крысы весом 400 ± 50 г. В контрольной группе (n = 25) на фоне криптона проведено 22 опыта. Камера 1850 мл. Поглощение кислорода в контроле за 30 мин было 18,85 ± 0,5 мл/кг/мин. Поглощение кислорода в криптоне за 55 мин было 10.87 ± 1,3 мл/кг/мин. В криптоне (рис. 2) уменьшилось потребление кислорода на 42,3 %, или в 1,73 раза (при P < 0,05) по сравнению с контролем.
Время максимального выживания в криптоне увеличилось на 83,3 %, или в 1,83 раза по сравнению с контролем (при P < 0,05).
Для анализа действия ксенона в опытах были задействованы крысы массой 400 ± 50 г. В контрольной группе (n = 25) на фоне ксенона проведено 15 опытов. Камера 1850 мл. Поглощение кислорода в контроле за 30 мин было 18,85 ± 0,5 мл/кг/мин. Поглощение кислорода в ксеноне за 105 мин было 5,875 ± 1,1 мл/кг/мин. В ксеноне (рис. 3) потребление кислорода составило 31 % от контроля, это в 3,2 раза (при P < 0,05) меньше контроля. Время максимального выживания в ксеноне составило 350 % от контроля, что в 3,5 раза больше по сравнению с контролем (при P < 0,05).
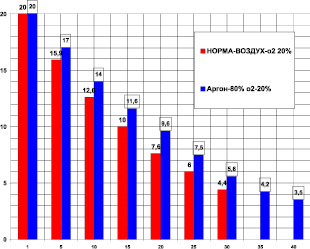
Рис. 1. Поглощение кислорода крысой в замкнутой камере в воздухе – первые столбики (азот 80 %, кислород 20 % – контроль) и в среде аргона – вторые столбики (аргон ‒ 80 %, кислород ‒ 20 %). По оси абсцисс: – время опыта в минутах. По оси ординат: – концентрация кислорода в процентах ( %) в камере с крысой
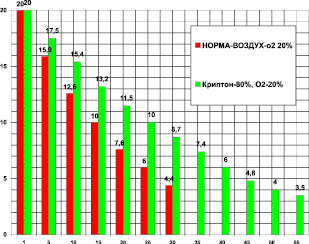
Рис. 2. Поглощение кислорода крысой в замкнутой камере в воздухе – первые столбики (азот 80 %, кислород 20 % – контроль) и в среде криптона (криптон ‒ 80 %, кислород – 20 %). По оси абсцисс: – время опыта в минутах. По оси ординат: – концентрация кислорода в процентах ( %) в камере с крысой
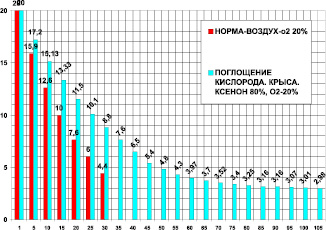
Рис. 3. Поглощение кислорода крысой в замкнутой камере в воздухе ‒ первые столбики (азот 80 %, кислород 20 % – контроль) и в среде ксенона (ксенон ‒ 80 %, кислород – 20 %). По оси абсцисс: – время опыта в минутах. По оси ординат: – концентрация кислорода в процентах ( %) в камере с крысой
Для анализа действия медазепама проведены опыты на крысах массой 400 ± 50 г. В контрольной группе (n = 25) и на фоне медазепама проведено 14 опытов. Камера 1850 мл.
Поглощение кислорода в контроле за 30 минут было 18,85 ± 0,5 мл/кг/мин. Поглощение кислорода после медазепама (рис. 4) за 135 минут было 4,57 ± 0,8 мл/кг/мин. После медазепама потребление кислорода составило 24 % от контроля, это в 4,12 раза (при P < 0,05) меньше контроля. Время максимального выживания после медазепама составило 450 % от контроля, что в 4,5 раза больше по сравнению с контролем (при P < 0,05).
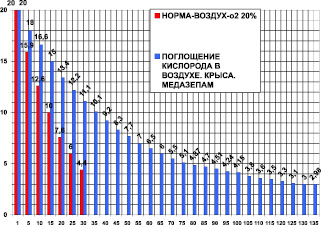
Рис. 4. Поглощение кислорода крысой в замкнутой камере в воздухе – первые столбики (азот 80 %, кислород 20 % – контроль) и после медазепама 2 мг/кг внутрибрюшинно. По оси абсцисс: – время опыта в минутах. По оси ординат: – концентрация кислорода в процентах ( %) в камере с крысой
Действие нембутала (рис. 5) изучалось на крысах массой 400 ± 50 г. В контрольной группе (n = 25) и на фоне нембутала проведено 16 опытов. Камера 1850 мл. Поглощение кислорода в контроле за 30 мин было 18.85 ± 0,5 мл/кг/мин. Поглощение кислорода после нембутала за 60 минут было 10,2 ± 1,2 мл/кг/мин. После нембутала потребление кислорода составило 54 % от контроля, это в 1,84 раза (при P < 0,05) меньше контроля. Время максимального выживания после нембутала составило 200 % от контроля, что в 2 раза больше по сравнению с контролем (при P < 0,05).
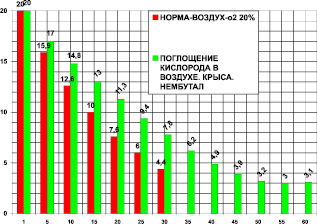
Рис. 5. Поглощение кислорода крысой в замкнутой камере в воздухе (азот 80 %, кислород 20 % – контроль) и после нембутала (пентобарбитал, этаминал натрия) 30 мг/кг внутрибрюшинно. По оси абсцисс: – время опыта в минутах. По оси ординат: – концентрация кислорода в процентах ( %) в камере с крысой
Изменение величин потребления кислорода в нейтральных газах и при введении транквилизатора и барбитурата
|
Газовые смеси |
Кислород, мл/кг/мин, поглощение организмом в замкнутой камере |
Уменьшение потребления кислорода по сравнению с контролем |
Максимальное время выживания в камере, мин |
|
Контроль – О2 – 20 %, Азот – 80 % |
18,85 ± 0,5 мл/кг/мин |
30 |
|
|
Аргон – 80 %, О2 – 20 % |
14,95 ± 0,7 мл/кг/мин |
< 1,26 раз |
40 |
|
Криптон – 80 %, О2 – 20 % |
10,87 ± 1,3 мл/кг/мин |
< 1,75 раз |
55 |
|
Ксенон – 80 % О2 – 20 % |
5,87 ± 1,1 мл/кг/мин |
< 3,2 раз |
105 |
|
Медазепам |
4,57 ± 0,8 мл/кг/мин |
< 4,15 раз |
135 |
|
Нембутал |
10,2 ± 1,2 мл/кг/мин |
< 1,84 раз |
60 |
Заключение
Анализ результатов действия ксенона и медазепама на потребление кислорода крысами показал, что транквилизатор медазепам в большей степени, чем ксенон, уменьшает потребление кислорода организмом. Это говорит о том, что ксенон слабее действует на возбуждение тормозных ГАМК-эргических рецепторов, чем специфический ГАМК-миметик медазепем. Но так как на фоне медазепама аргон, криптон, ксенон не усиливали своего действия, можно говорить о стимулирующем ГАМК-эргическом действии этих нейтральных газов, но по силе которое меньше, чем у медазепама.
Анализ действия аргона, криптона, ксенона на фоне нембутала показал, что эти нейтральные газы не усиливали эффект уменьшения потребления кислорода, как обычно без нембутала. В данных опытах ксенон в большей степени уменьшал потребление кислорода, чем нембутал.
Ксенон действует на потребление кислорода как нембутал, поэтому можно предположить, что ксенон ‒ это газообразный транквилизатор. Криптон и аргон действуют слабее, но механизм действия, наверное, у них такой же как у ксенона. Поэтому можно предположить, что аргон и криптон более слабые и легкие транквилизаторы, чем ксенон.
Поэтому газы аргон, криптон, ксенон могут использоваться в практической медицине по тем же показаниям, что и транквилизаторы, но действие их слабее, но зато они выводятся из организма за несколько минут, а транквилизаторы могут выводиться из организма неделями.
Из данных литературы известно, что ксенон частично блокирует NMDA-глутаматные рецепторы [9, 10], которых в мозге в несколько раз больше, чем всех остальных рецепторов. Эти рецепторы возбуждаются при стрессе и обеспечивают выживаемость в экстремальных ситуациях. Подобным действием обладают барбитураты. Ксенон значительно увеличивает выживаемость при низкой концентрации кислорода, что теоретически подводит базу для его применения при лечении инфарктов, инсультов, травм и других нарушений кровообращения, когда создается гипоксия и нужно уменьшить потребление кислорода [7].
Аргон же, возможно, эффективней применять при незначительных нарушениях кровотока и небольшой гипоксии, например, у спортсменов после и во время кратковременных стрессов. Но для применения нужно разработать количественные характеристики метода применения аргона.
Выводы
Наши исследования показали, что аргон, криптон, ксенон уменьшают потребление кислорода организмом животного, и этот эффект усиливается при снижении концентрации кислорода. Анализ результатов действия блокатора NMDA-рецептора и миметика ГАМК-рецептора доказали, что физиологическим механизмом этого действия нейтральных газов является то, что нейтральные газы блокируют NMDA-рецепторы и усиливают ГАМК-эргическое торможение. Поэтому областью применения нейтральных газов могут быть те же показания, что и для транквилизаторов, но действие нейтральных газов намного слабее. Тормозные эффекты нейтральных газов выражены наиболее сильно у ксенона, намного слабее у криптона, а аргон [3, 6, 8] обладает наиболее слабым тормозным действием на организм из всех изученных нами газов в этой работе.
Работа выполнена при базовом бюджетном финансирование РАН, госрегистрация N01201052605.
Рецензенты:
Торшин В.И., д.б.н., профессор, зав. кафедрой нормальной физиологии, ГОУ ВПО «Российский университет дружбы народов», г. Москва;
Северин А.Е., д.м.н., профессор кафедрой нормальной физиологии, ГОУ ВПО «Российский университет дружбы народов», г. Москва.
Работа поступила в редакцию 27.11.2013.
Библиографическая ссылка
Ананьев В.Н. РЕЦЕПТОРНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ НЕЙТРАЛЬНЫХ ГАЗОВ НА ПОГЛОЩЕНИЕ КИСЛОРОДА ОРГАНИЗМОМ // Фундаментальные исследования. 2013. № 11-1. С. 11-16;URL: https://fundamental-research.ru/ru/article/view?id=33001 (дата обращения: 30.01.2026).



