Наночастицы TiO2 повсеместно используются благодаря высокой светоотражающей способности. TiO2 в виде пищевой добавки E 171 разрешен к применению в дозе до 1 % от общей массы продукта. Поэтому пероральное поступление TiO2 в организм с различными пищевыми и лекарственными продуктами, где он используется в качестве вспомогательного вещества для улучшения потребительских свойств, может быть не контролируемый. На сегодняшний день полученные данные о токсичности наноразмерных материалов не позволяют определить нормативы их использования, а накопленный опыт показывает, что каждый наноматериал должен изучаться индивидуально с учетом его размера, формы, структуры поверхности, агрегатного состояния, химического состава, растворимости и целого ряда других факторов. Поэтому в настоящее время данные по воздействию наночастиц на здоровье человека и экосистемы ограничены [2, 3].
Целью нашего исследования явилось изучение редокс-соотношения в тканевых гомогенатах отделов мозга и плазме крови крыс после перорального поступления наночастиц TiO2. Редокс-соотношение определяется как интегральный показатель окислительно-восстановительных процессов в ткани, характеризующий функциональную активность и уровень окислительного стресса.
Материалы и методы исследования
Хронические опыты были поставлены на 40 крысах-самцах Вистар. Животные содержались на стандартном рационе, в изолированном вентилируемом помещении, в котором поддерживалась температура 20 ± 2,0 °C, влажность воздуха 60 % и световой режим 12/12.
После карантинной выдержки крысы в течение 7 дней перорально получали частицы диоксида титана специально разработанным физиологичным способом – ежедневно в 10 часов утра каждую крысу пересаживали из общей клетки в индивидуальный домик, нано- или микрочастицы TiO2 заворачивали в привлекательный корм, крыса оставалась в индивидуальном домике до полного поедания корма (обычно – до 30 минут), затем животных пересаживали обратно в общую клетку. Таким образом обеспечивалось физиологичное и контролированное пероральное поступление нано- или микрочастиц TiO2. Были использованы наночастицы TiO2, полученные плазмахимическим методом (производство MACH I, USA). Перед началом хронического эксперимента был выполнен контроль удельной поверхности материалов с помощью автоматического газо-адсорбционного анализатора TriStar II, а также фазового состава и структурных параметров порошков TiO2 на дифрактометре XRD-6000 на CuKα-излучении. Были использованы две дозы наночастиц TiO2 (по 50 и 100 мг/крысу, что соответствует дозам 200 и 400 мг/кг) и микрочастицы TiO2 в качестве химического контроля. Животные были разделены на 4 группы, в каждой группе по 10 крыс: 1 группа «контроль» – биологический контроль; 2 группа «50 мг нано» получала наночастицы TiO2 20 нм, Sуд 77 м2/г в дозе 200 мг/кг; 3 группа «100 мг нано» получала наночастицы TiO2 20 нм, Sуд 77 м2/г в дозе 400 мг/кг; 4 группа «микро» получала микрочастицы TiO2 175 нм, Sуд 4,5 м2/г в дозе 200 мг/кг.
После завершения хронического эксперимента крыс взвешивали, измеряли температуру ядра тела и проверяли физическую выносливость (время повисания на металлической сетке с размером ячейки 1,5×1,5 мм, среднее значение из трех попыток). Перед умерщвлением крыс подвергали легкому эфирному ингаляционному наркозу. Из бедренной вены собирали кровь, готовили плазму крови. Декапитация проводилась мгновенно с помощью гильотины. Сразу после декапитации выделяли головной мозг, из которого выделяли следующие отделы: обонятельная луковица, мозжечок, задний мозг, кора лобной доли, средний мозг и таламический мозг. Из выделенных отделов мозга брали образцы массой до 150 мг, взвешивали, помещали в 1 мл охлажденного физиологического раствора и хранили до дня анализа при температуре –20 °С. Образцы плазмы крови также хранили при t –20 °С. В день анализа образцы тканей размораживали, доводили физиологическим раствором до концентрации 50 мг ткани/мл, гомогенизировали. Гомогенаты центрифугировали, полученные супернатанты использовали для определения антиоксидантов и оксидантов в каждой исследованной ткани.
Для проведения хемилюминесцентного анализа антиоксидантов и оксидантов использовался двухкюветный хемилюминометр высокой разрешающей способности Lumat LB9507 (Berthold Technologies) с диапазоном спектральной чувствительности в интервале длин волн между 390 и 620 нм. Интенсивность хемилюминесценции (CL) регистрируют в единицах RLU (relative light units). Время измерения интенсивности люминолзависимой CL составляет 5 минут. Антиоксидантную активность измеряли по принципу гашения интенсивности люминолзависимой хемилюминесценции (CL) в радикалопродуцирующей системе после добавления биологической пробы [6]. Радикалопродуцирующая система содержит в 1 мл H2O: 30 мкл 0,01 М раствора люминола в фосфатном буфере, 20 мкл 0,05 М раствора FeSO4 и 10 мкл 0,1 М H2O2. По 1 мл радикалопродуцирующей системы добавляли в две кюветы Lumat LB9507, затем в первую кювету добавляли 10 мкл H2O, во вторую кювету добавляли 10 мкл супернатанта исследуемой пробы. Проводили измерение интенсивности CL в 1-й и 2-й кювете в течение 5 минут. По разнице интенсивности CL радикалопродуцирующей системы (1-я кювета) и интенсивности CL радикалопродуцирующей системы с добавлением супернатанта исследуемой пробы (2-я кювета), строили кривую интенсивности CL, характеризующей общую антиоксидантную активность (TAR). Светосумму (Sm) CL TAR определяли как площадь под кривой с помощью Microsoft Excel. Оксиданты (общий пул активных радикалов) (ROS) определяли по принципу активированной люминолом хемилюминесценции [3] в тех же условиях CL. Система для измерения ROS содержит в 1 мл: 30 мкл 0,01 М раствора люминола в фосфатном буфере. 1 мл системы помещали в кювету Lumat LB9507 и добавляли 10 мкл супернатанта исследуемой пробы, измерение интенсивности CL проводили в течение 5 минут. После построения кривой интенсивности CL, характеризующей ROS, определяли Sm CL ROS как площадь под кривой с помощью Microsoft Excel. Редокс соотношение определяли как частное от деления Sm CL TAR на Sm CL ROS в одноименной пробе.
Статистический анализ проводился с использованием пакета программ Statistica 6.0 для непараметрических выборок. Значения p < 0,05 считались значимыми.
Результаты исследования и их обсуждение
Масса тела и температура ядра тела после завершения эксперимента не имела различий у контрольных и опытных животных. Физическая выносливость у крыс серии «50 мг нано» была снижена в 2 раза по сравнению с животными групп сравнения.
Редокс-соотношение во всех отделах мозга контрольных животных составляло от 1,5 в обонятельной луковице до 5,3 в мозжечке (рис. 1). Следовательно, у контрольных животных в отделах мозга уровень антиоксидантной активности превышал уровень активных форм кислорода. После введения наночастиц TiO2 в дозе 50 мг/крысу наблюдается увеличение редокс соотношения во всех отделах, кроме среднего и заднего мозга. Максимальное увеличение редокс соотношения отмечено в коре лобной доли. После введения наночастиц TiO2 в дозе 400 мг/кг редокс-соотношение увеличивается как по сравнению с контролем (во всех отделах мозга), так и по сравнению с группой, получавшей 200 мг/кг (во всех отделах, кроме обонятельной луковицы и заднего мозга). В мозжечке, коре лобной доли и таламическом мозге этот показатель после введения наночастиц TiO2 в дозе 400 мг/кг составляет от 50 до 76 единиц, что значительно выше, чем в других отделах, и свидетельствует о разной степени реакции отделов мозга. После введения микрочастиц TiO2 редокс-соотношение также увеличивается по сравнению с контролем, наибольшее увеличение отмечено в таламическом мозге (рис. 1). Установленное дозозависимое увеличение редокс-соотношения в отделах мозга свидетельствует о том, что наночастицы TiO2 проникают через гематоэнцефалический барьер и вызывают повреждения на субклеточном, клеточном и тканевом уровнях.
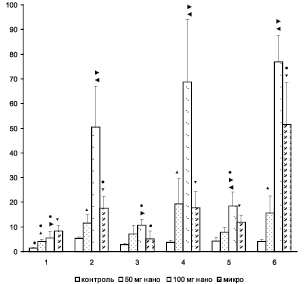
Рис. 1. Редокс-соотношение в отделах мозга крыс: 1 – обонятельная луковица, 2 – мозжечок, 3 – задний мозг, 4 – коры лобной доли, 5 – средний мозг, 6 – таламический мозг) в контроле, при введении наночастиц TiO2 в дозе 200 мг/кг (50 мг нано), при введении наночастиц TiO2 в дозе 400 мг/кг (100 мг нано), при введении микрочастиц TiO2 (микро). ● – (р < 0,05) по отделам мозга внутри группы по отношению к коре лобной доли; ▲ – (р < 0,05) контроль и 50 мг нано; ► – (р < 0,05) контроль и 100 мг нано; ▼ – (р < 0,05) контроль и микро; ◄ – (р < 0,05) 50 мг нано и 100 мг нано
Разрушение гематоэнцефалического барьера у крыс было показано при воздействии наночастиц TiO2 диаметром 10 и 20 нм [5], что соответствует диаметру наночастиц, использованных в данном исследовании. Одним из элементов гематоэнцефалического барьера является внеклеточный матрикс [9]. Компоненты внеклеточного матрикса тканеспецифичны, в мозге установлены различные формы специфичных протеогликанов (агреган, агрин, нейрокан, бигликан, декорин и другие), гликопротеинов (рилин, тенасцин), различные формы коллагенов, фибронектинов и ламининов, экспрессирующиеся только в головном мозге. Структуры внеклеточного матрикса мозга постоянно обновляются, установлены ферменты нейронов, контролирующие эти процессы [8]. Предполагается, что высокий уровень редокс соотношения в отделах мозга после введения наночастиц TiO2 свидетельствует об усилении деградации структур внеклеточного матрикса и вызванного этим механизмом разрушении гематоэнцефалического барьера. Поскольку введение микрочастиц TiO2 также вызывает повышение редокс соотношения в отделах мозга, то можно сделать вывод о том, что TiO2 при исследованных структурных параметрах может обладать признаками нейротоксичности.
В плазме крови также было показано дозозависимое увеличение редокс-соотношения после введения наночастиц TiO2 в дозе 200 и 400 мг/кг и увеличение данного показателя после введения микрочастиц TiO2 (рис. 2).
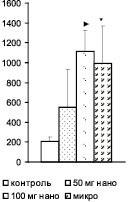
Рис. 2. Редокс-соотношение в плазме крови крыс в контроле, при введении наночастиц TiO2 в дозе 200мг/кг (50 мг нано), при введении наночастиц TiO2 в дозе 400 мг/кг (100 мг нано), при введении микрочастиц TiO2 (микро), ► – (р < 0,05) контроль и 100 мг нано; ▼ – (р < 0,05) контроль и микро
Высокие показатели редокс-соотношения в плазме крови могут определяться тем, что уровень свободных радикалов в плазме очень низкий, возможно, в связи с присутствием низкомолекулярных антиоксидантов в плазме. Одним из механизмов повышения антиоксидантной активности является деградация макромолекул. W. Dröge [4] описывает механизм высокой антиоксидантной активности, который обеспечивается продуктами деградации протеинов. Аминокислоты являются слабыми поглотителями свободных радикалов, но за счет высокой внутриклеточной концентрации вносят большой вклад в общую антиоксидантную активность. В поглощении радикалов участвуют также реакционноспособные продукты перекисного окисления липидов, которые определяются как продукты, реагирующие с тиобарбитуровой кислотой [7]. Предполагается еще один тип поглотителей радикалов – продукты деградации гликопротеинов и протеогликанов. Структура гликопротеинов и протеогликанов и их высокая адгезивная способность обеспечивается межмолекулярными взаимодействиями между олиго- или полисахаридными цепочками моносахаров. Даже их частичная деградация освобождает огромное число радикалов на терминальных участках полисахаридных цепочек и обеспечивает их высокую способность улавливать радикалы. Следовательно, усиление деградации макромолекул проявляется как усиление антиоксидантной активности системы и приводит к повышению редокс-соотношения.
Таким образом, пероральное введение наночастиц TiO2 вызывает дозозависимое увеличение редокс-соотношения как в отделах мозга, так и в плазме крови крыс. Введение микрочастиц TiO2 также увеличивает редокс-соотношение в исследованных отделах мозга и плазме. Предполагается, что увеличение редокс-соотношения в отделах мозга связано с нарушением проницаемости гематоэнцефалического барьера и деградацией полисахаридных элементов внеклеточного матрикса.
Исследование было выполнено в рамках реализации Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы Минобрнауки России и поддержано грантом в форме субсидии по соглашению № 14.B37.21.0123 от 27 июля 2012 г.
Рецензенты:
Суходоло И.В., д.м.н., профессор, зав. кафедрой морфологии и общей патологии Сибирского государственного медицинского университета, г. Томск;
Плотников М.Б., д.б.н., профессор, зав. лабораторией фармакологии кровообращения НИИ фармакологии СО РАМН, г. Томск.
Работа поступила в редакцию 01.08.2013.
Библиографическая ссылка
Кривова Н.А., Заева О.Б., Григорьева В.А., Ходанович М.Ю. ВЛИЯНИЕ НАНОЧАСТИЦ ДИОКСИДА ТИТАНА НА РЕДОКС-СООТНОШЕНИЕ В ОТДЕЛАХ МОЗГА И ПЛАЗМЕ КРОВИ КРЫС // Фундаментальные исследования. 2013. № 10-1. С. 110-113;URL: https://fundamental-research.ru/ru/article/view?id=32226 (дата обращения: 10.07.2025).



