Согласно литературным данным [7], при электроконцентрировании микроколичеств As(V) и As(III) на углеродсодержащих электродах в рабочей области потенциалов этих электродов анодный пик мышьяка не обнаружен. Причина этого явления до сих пор не выяснена. Известно, что введение ионов посторонних металлов при электролизе часто приводит к изменению поляризационных характеристик электроокисления осадков этих металлов [1]. В работе [7] показано, что при электроконцентрировании мышьяка из растворов, содержащих As(V) и As(III), в присутствии ионов Fe(III) и Fe(II) при pH < 3 на твердый композитный углеродсодержащий электрод при потенциалах предельного тока отрицательнее – 2,1 и –1,8 В происходит электровыделение железа и мышьяка. На анодных вольтамперных кривых наблюдаются пики, зависящие как от концентрации As(V) и As(III), так и от концентрации ионов железа (II) или железа (III) в растворе.
Целью данной работы было исследовать процессы электроокисления электролитических осадков мышьяк–железо методом инверсионной вольтамперометрии и объяснить природу наблюдаемых анодных пиков.
Материал и методы исследования
Электрохимические исследования проводили с помощью вольтамперометрического анализатора ТА-Lab производства ООО НПП «Томьаналит» (г. Томск), позволяющего реализовать различные режимы изменения потенциала со скоростью от 2 до 300 мВ/с, проводить измерения одновременно в трех закрытых кварцевых ячейках и барботировать анализируемые растворы азотом. Рабочий диапазон измеряемых токов от 0,0005 до 500 мкА. В качестве рабочего электрода использовали твердый углеродсодержащий композитный электрод (УКЭ), содержащий 30 % технического углерода. Способ изготовления УКЭ подробно описан в [3].
Электроды сравнения и вспомогательный – хлоридсеребряные в 1 М КCl. При регистрации вольтамперограмм использовали постояннотоковую форму развертки потенциала.
Процедура ИВ-определения мышьяка была типичной. Измерения проводили в трехэлектродной ячейке. Удаление кислорода из раствора проводили путем барботирования азотом. Перемешивание раствора осуществляли вибрацией рабочего электрода. Вольамперограммы регистрировали в диапазоне от –0,6 до +0,25 В при следующих параметрах: очистка от всех осажденных электролизом веществ – кондиционирование электрода при 0,3 В (10 с); электронакопление мышьяка и железа при –2,2 В (50 с) при вибрации УКЭ; успокоение раствора при потенциале –0,6 В; скорость развертки 60 мВ/с.
Применяемые реактивы были марки «ос.ч.» или «х.ч.», для приготовления растворов использовали бидистиллированную воду. Рабочие растворы элементов готовили разбавлением аттестованных смесей с содержанием элементов от 100 до 1000 мг/дм3. Аттестованные смеси элементов готовили путем последовательного разбавления государственных стандартных образцов с аттестованным значением концентрации 100,0 г/дм3 и относительной погрешностью аттестованного значения не более 1 %. В качестве фонового электролита использовали раствор НCl.
Результаты исследования и их обсуждение
Ионы Fe(III) вводили в раствор вместе с As(III). Раствор подвергался электролизу при высоких отрицательных потенциалах (–2,2 В). На электроде выделялось Fe(0) одновременно с выделением As(0).
На рис. 1 приведены анодные вольтамперные кривые электроокисления осадка Fe-As с поверхности УКЭ.
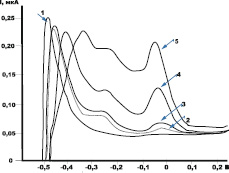
Рис. 1. Анодные вольтамперные кривые электроокисления осадка Fe-As с поверхности УКЭ. Условия опытов: фон 0,005 М HCl; Еэ = –2,2 В; τэ = 50 с, СFe(III) = 1,0 мг/дм3; СAs(III) = 0; 2,0; 4,0; 25; 75 мкг/дм3
Как видно из рис. 1, анодный пик электроокисления железа с поверхности УКЭ наблюдается при потенциале –0,48 В. При введении в анализируемый раствор ионов мышьяка (III), кроме потенциала ионизации чистого железа, на вольтамперных кривых наблюдаются дополнительные анодные пики при других потенциалах: (–0,42; –0,38; –0,35; –0,25 В). Сам факт появления дополнительных анодных пиков и причина их появления в литературе не обсуждается.
Экспериментальные исследования, проведенные нами, позволили установить, что в условиях постоянства количества железа и переменного количества мышьяка в электролитическом осадке суммарное количество электричества, расходуемое на окисление железа из сплава с мышьяком, остается постоянным. Изменяется лишь соотношение величин парциальных вкладов пиков в общее количество электричества, затрачиваемое на электроокисление железа. Это возможно, если дополнительные анодные пики на вольтамперной кривой обусловлены селективным электроокислением железа из бинарного сплава с мышьяком. Потенциалы дополнительных анодных пиков, наблюдаемых при потенциалах –0,25 и –0,045 В, не изменяются при изменении содержания металлов в электролитическом осадке, что указывает на постоянство фазовой структуры, из которой происходит селективное электроокисление железа из сплава с мышьяком.
Потенциал анодного пика железа, наблюдаемого при потенциале –0,48 В, смещается в анодную область при увеличении содержания мышьяка в электролитическом осадке (рис. 1), что может быть связано с электроокислением железа из твердого раствора с мышьяком.
Селективное электроокисление железа из твердого раствора и разных по составу ИМС должно формировать анодные пики при разных потенциалах.
Из литературных данных известно [2], что мышьяк и железо могут образовывать между собой как твердые растворы, так и интерметаллические соединения составов: AsFe2, As2Fe3, AsFe и As2Fe, что соответствует мольным долям железа 0,67; 0,6; 0,5 и 0,33.
В работе [3] показано, что смещение потенциала анодного пика при селективном электроокислении электроотрицательного компонента из твердого раствора или ИМС может быть описано соотношением:
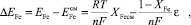 (1)
(1)
где EFe – потенциал анодного пика железа; 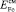 – потенциал анодного пика железа при его селективном электроокислении из сплава с мышьяком; εсмсм – интегральная теплота смешения компонентов при образовании твердого раствора или ИМС; ХFe – мольная доля железа в ИМС или твердом растворе.
– потенциал анодного пика железа при его селективном электроокислении из сплава с мышьяком; εсмсм – интегральная теплота смешения компонентов при образовании твердого раствора или ИМС; ХFe – мольная доля железа в ИМС или твердом растворе.
Как известно, теплоты смешения при сплавообразовании равносильны образованию ковалентной связи между металлами. Рассчитать энергию связи двух металлов в кристаллической решетке можно с помощью корреляционного уравнения Полинга [5]:
 (2)
(2)
где εA–A, εB–B – энергия разрыва связи металл–металл; χA, χB – электроотрицательности компонентов сплава.
Энергии разрыва химических связей, величины электроотрицательностей элементов взяты нами из литературных данных [6].
Рассчитанная по этим данным теплота смешения компонентов железа и мышьяка равна 256,6 кДж/моль. Потенциал анодного пика железа с поверхности УКЭ, покрытого железом, определен нами экспериментально и равен –0,48 В. Зная теплоту смешения компонентов, можно рассчитать величину смещения потенциалов пиков селективного электроокисления железа из твердых растворов и ИМС с мышьяком относительно потенциала пика электроокисления чистого железа для всех дополнительных анодных пиков, наблюдаемых на вольтамперной кривой, а затем и потенциалы анодных пиков селективного электроокисления железа из этих соединений по формуле:
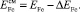 (3)
(3)
Пик селективного электроокисления железа из твердого раствора может изменяться с изменением мольной доли компонента в электролитическом осадке. Для того чтобы оценить мольную долю железа в твердом растворе с мышьяком, нами использован метод прогонки: задавалась мольная доля железа, по формуле (1) рассчитывалось смещение пика, а по формуле (2) потенциал пика селективного электроокисления железа из твердого раствора с заданной мольной долей. Данные расчетов приведены на зависимости потенциала пика электроокисления железа из твердого раствора с мышьяком (рис. 2). Из этого графика можно оценить мольную долю железа в твердом растворе по опытной величине потенциала анодного пика селективного электроокисления железа из твердого раствора.
Результаты расчета потенциалов анодных пиков селективного электроокисления железа из твердых растворов и ИМС с мышьяком приведены в таблице.
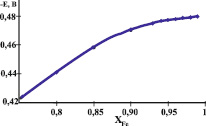
Рис. 2. Зависимость потенциалов анодных пиков селективного электроокисления железа из твердого раствора с мышьяком от мольной доли железа в бинарном электролитическом осадке с мышьяком
Сравнивая полученные экспериментальные данные с расчетом, видим, что железо из твердых растворов и различных ИМС с мышьяком может окисляться при разных потенциалах. Так, потенциал –0,42 В отражает процесс селективного электроокисления железа из твердого раствора с мышьяком при мольной доле железа в твердом растворе 0,75. Пик селективного электроокисления железа из ИМС AsFe2 наблюдается при потенциале –0,38 В. Потенциал этого пика не изменяется при изменении содержания мышьяка в электролитическом осадке, что говорит о постоянстве состава фазовой структуры, из которой происходит селективное электроокисление железа. Селективное электроокисление железа из ИМС As2Fe3 происходит при потенциале –0,33 В, из ИМС AsFe– при потенциале –0,25 В, из ИМС As2Fe – при потенциале –0,07 В.
Таким образом, по рассчитанным потенциалам смещения процесса электроокисления железа из различных фазовых структур можно сделать выводы о том, при каком потенциале селективно окисляется железо из твердого раствора или каждого ИМС с мышьяком. Рассчитанные значения потенциалов пиков селективного окисления железа из ИМС с мышьяком могут быть доказательством очередности их расположения на вольтамперной кривой (рис. 1). Наблюдаемые вольтамперные кривые обусловлены селективным электроокислением железа из этих фазовых структур и отвечают потенциалам пиков: –0,42; –0,38; –0,35 и –0,25 В.
Рассчитанные и экспериментально определенные значения потенциалов анодных пиков селективного электроокисления железа из ИМС с мышьяком
|
Потенциал анодного пика железа |
Твердый раствор |
Состав ИМС |
|||
|
Fe–As XFe = 0,75 |
AsFe2 XFe = 0,67 |
As2Fe3 XFe = 0,6 |
AsFe XFe = 0,5 |
As2Fe XFe = 0,33 |
|
|
∆ЕFe |
–0,058 |
–0,10 |
–0,146 |
–0,228 |
–0,407 |
|
|
–0,422 |
–0,378 |
–0,334 |
–0,253 |
–0,073 |
|
Eэксп, B |
–0,424 ± 0,005 |
–0,381 ± 0,005 |
–0,35 ± 0,01 |
–0,25 ± 0,01 |
– |
Потенциал электроокисления мышьяка (электроположительный элемент) не изменяется при изменении содержания железа в сплаве и равен 0 В (рис. 1).
Таким образом, железо способствует электроконцентрированию мышьяка на поверхность графитового электрода, что позволяет использовать его для модификации графитового электрода с целью определения микроколичеств мышьяка методом инверсионной вольтамперометрии.
Выводы
Рассмотрен процесс электроокисления осадков мышьяк‒железо с поверхности графитового электрода. При анодном растворении осадка на вольтамперной кривой наблюдаются несколько анодных пиков, зависящих как от концентрации мышьяка (III), так и от концентрации железа (III). Проведенные исследования позволили установить, что на стадии предварительного электролиза бинарный осадок железо‒мышьяк на поверхности электрода состоит как из твердого раствора, так и из нескольких ИМС. Наблюдаемые вольтамперные кривые обусловлены селективным электроокислением железа из этих фазовых структур и отвечают потенциалам пиков: –0,48; –0,42; –0,38; –0,35 и –0,25 В. Потенциал электроокисления мышьяка (электроположительный элемент) не изменяется при изменении содержания железа в сплаве и происходит при потенциале 0 В.
Таким образом, железо способствует электроконцентрированию мышьяка на поверхность графитового электрода, что позволяет использовать его для модификации графитового электрода с целью определения микроколичеств мышьяка методом инверсионной вольтамперометрии.
Рецензенты:
Отмахов В.И., д.т.н., профессор кафедры аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский государственный университет», г. Томск;
Мокроусов Г.М., д.х.н., заведующий кафедрой аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский государственный университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Колпакова Н.А., Носкова Г.Н., Данилова Т.B. ЗАКОНОМЕРНОСТИ ЭЛЕКТРООКИСЛЕНИЯ БИНАРНЫХ ЭЛЕКТРОЛИТИЧЕСКИХ ОСАДКОВ ЖЕЛЕЗО‒МЫШЬЯК // Фундаментальные исследования. 2013. № 8-3. С. 630-633;URL: https://fundamental-research.ru/ru/article/view?id=31971 (дата обращения: 01.07.2025).




 , B
, B