За последнее время проявляется повышенный интерес к изучению комплексообразования между ионами тяжелых металлов и биологически-активными лигандамитиоловых соединений [7, 10]. Токсичность ртути проявляется главным образом за счет взаимодействия с тиоловыми группами белковых молекул, образующих устойчивые комплексы, опасные для здоровья человека [11]. К тому же, высокое сродство SH-групп тиоловых соединений относительно катионов ртути Hg2+ и Hg22+ может использоваться в аналитических и диагностических целях [11]. Кроме того, исследования комплексообразования тиоловых соединений с ионами ртути представляют интерес в клинической биохимии, фармакологии, химии координационных соединений и в области защиты окружающей среды [5, 12].
В настоящее время известно немного научных работ по исследованию комплексообразования тиоловых соединений с ионами ртути разными методами [6, 9, 14]. В работах представлены данные по физико-химическим характеристикам комплексов тиоловых соединений с ртутью, не согласующиеся между собой. Вероятно, это связанно с тем, что при исследовании комплексообразования используются разные реакционные среды, отличающиеся значением рН, концентрациями исходных веществ, ионной силой раствора и другими параметрами [13].
В работе для исследования комплексообразующих свойств тиоловых соединений был выбран глутатион как стандартное вещество. В работе проведено детальное исследование состава вероятных комплексов системы глутатион-ртуть, преобладающих в растворе, определены их константы устойчивости методом потенциометрии. В качестве метода сравнения для определения состава комплекса Hg[GS]2 был выбран метод спектрофотометрии. Выбор данных методов для исследования явления комплексообразования не случаен, т.к. из большинства методов потенциометрия и спектрофотометрия являются простыми в аппаратурном применении и не требуют дорогостоящих реактивов.
Материалы и методы исследования
Для определения состава комплекса Hg(GS)2 и его константы устойчивости (lgβ2) в работе использовалась установка для измерения ЭДС системы, платиновый и хлорид-серебрянные электроды, растворы солей Hg(NO3)2 (1·10–6 моль/л). Постоянство ионной силы поддерживалось раствором KNO3 (1 моль/л). Использовался свежеприготовленный раствор GSH (5 моль/л), из которого методом последовательного разбавления готовили другие растворы GSH. Определение потенциала системы проводили в боратном буферном растворе (рН 9,18). Исследуемый раствор продували инертным газом азотом для удаления следов кислорода.
Спектрофотометрические исследования комплексообразования системы Hg(II)-GSH проводились на спектрофотометре СФ-46, с помощью кюветы с толщиной поглощающего слоя 1 см. Диапазон длины волн для поиска максимума спектра комплекса устанавливался в области 180–250 нм с погрешностью ±0,1 нм. В качестве раствора сравнения использовали бидистиллированную воду.
Методика потенциометрического титрования
В тщательно промытую ячейку вводили 25 мл боратного буферного раствора, 0,1 мл раствора KNO3 (1 моль/л) и точно измеренные объемы по 0,1 мл раствора Hg(NO3)2 (3·10–6 моль/л). При непрерывном пропускании через раствор азота замеряли через каждые 5 мин. ЭДС до установления постоянного значения. Из градуировочной бюретки последовательно вводили по 0,1 мл растворов GSH разных порядков. После введения новой порции раствора GSH и перемешивания с помощью инертного газа определяли значение ЭДС. Рассчитывали концентрацию GSH в ячейке после введения каждой порции.
Результаты исследования и их обсуждения
Исследование комплексообразования системы ртуть-глутатион методом потенциометрии
Из литературных данных известно, что потенциометрические методы широко используются для исследования комплексообразования [2–3].
Если ион ртути Hg2+ c частицами лиганда GS– образуют последовательный ряд комплексов: Hg2+[GS–]i (i = 0, 1, n), то в условиях равновесия общая концентрация ионов металла-комплексообразователя будет связана с концентрациями ступенчатообразующихся отдельных комплексов [Hg2+GS–I], концентрацией не связных в комплекс ионов металла [Hg2+] и лиганда [GS–] соотношениями:
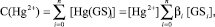 (1)
(1)
где
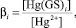 (2)
(2)
где βi – общая концентрационная константа восстановления комплекса.
Когда на электроде протекает реакция  устанавливается потенциал, равный
устанавливается потенциал, равный
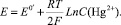 (3)
(3)
Подставляя уравнение (1) в (3) получаем:
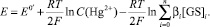 (4)
(4)
Следует отметить, что значение формального электродного потенциала в данных формулах 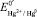 отличается от стандартного потенциала
отличается от стандартного потенциала 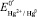 включением значений коэффициента активности и диффузионного потенциала. Использование индифферентного электролита позволяет практически элиминировать диффузионный потенциал.
включением значений коэффициента активности и диффузионного потенциала. Использование индифферентного электролита позволяет практически элиминировать диффузионный потенциал.
Анализ экспериментальных зависимостей Е от концентраций ионов Hg2+ и лиганда GS– при различных их соотношениях на основе уравнения (4) позволяет определить параметры процесса комплексообразования – число лигандов (n) и константу устойчивости комплекса GSH-Hg(II) (lgβ2).
При постоянстве [GS–], когда СGS >> CHg2+ и [GS–] ≈ СGS– ≈ const, должна наблюдаться линейная зависимость Е от LnCHg2+ с коэффициентом наклона RT/zF. С другой стороны, при СGS >> CHg2+, как правило, начиная с определенных, достаточно высоких СGS, в растворе присутствует практически один комплекс Hg2+GS–n. В этом случае
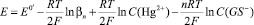 (5)
(5)
и при СHg2+ = const должна иметь место линейная зависимость Е от ln CGS–, из коэффициента наклона которой можно определить n:
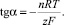 (6)
(6)
Значение Е0/Hg2 + /Hg0 определяют в системе, не содержащей комплексообразующих частиц, а только ионы ртути Hg2 + по уравнению:
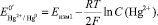 (7)
(7)
Экстраполируя прямую Е – ln CGS к значению ln СGS = 0, можно найти Еизм2 и согласно уравнению (8) определить ln βn:
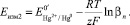 (8)
(8)
Результаты потенциометрического титрования для участка прямолинейной зависимости потенциала системы от логарифма концентраций GSH представлены на рис. 1.
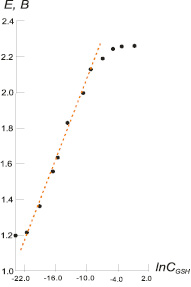
Рис. 1. Зависимость потенциала системы ртуть (II) – глутатион (Е, В) от ln СGSH. Концентрация ионов Hg2+ 3·10–6 моль/л
На основании экспериментальных данных угол наклона прямолинейной части составил: tgα = –0,073. Подставляя данное значение в уравнение (6), было определено количество лигандовn = 2,48 ≈ 2. Согласно рис. 1 величина потенциала системы не содержащей лиганды GS–, а только ионы Hg2+, составила Еизм1 = + 1,20 В. При подстановке данного значения в уравнение (7) было определено 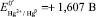 . Экстраполируя прямую Е – lnCGS к значению ln СGS = 0 и используя уравнение (8), была определена константа устойчивости комплекса Hg[GS]2 lnβ2 = 88,39 или logβ2 = 38,38.
. Экстраполируя прямую Е – lnCGS к значению ln СGS = 0 и используя уравнение (8), была определена константа устойчивости комплекса Hg[GS]2 lnβ2 = 88,39 или logβ2 = 38,38.
Анализ экспериментальных зависимостей Е от концентраций ионов одновалентной ртути Hg22+ и лигандов GS– при различных их соотношениях, используя аналогичный алгоритм исследования по формулам (1)–(8), позволил определить параметры процесса комплексообразования для комплекса одновалентной ртути Hg2[GS]2.
Была определена константа устойчивости комплекса Hg2[GS]2 lnβ2 = 36,03 или logβ2 = 15,64.
Таким образом, на основании значений констант устойчивости комплексов ионов ртути (I) и (II) с глутатионом можно сделать вывод, что наиболее стабильным является комплекс ионов двухвалентной ртути состава Hg[GS]2. Это позволяет предположить, что он формируется быстрее, чем комплекс Hg2[GS]2 в случае совместного присутствия ионов ртути (I) и (II) в системе, что согласуется с литературными данными [11].
Исследование комплексообразования системы ртуть-глутатион методом спектрофотометрии
Метод спектрофотометрии был выбран для сравнения полученных результатов по составу комплекса Hg[GS]2 c методом потенциометрии.
Максимум спектров поглощения Hg(II) (CHg(NO3)2 = 1,5·10–5 моль/л) и GSH (CGSH = 1,5·10–5 моль/л) соответствуют значениям lHg(II) = 200 нм и lGSH = 195 нм (рис. 2). При совместном присутствии Hg(II) и GSH появляется новый спектр поглощения при 220 нм, соответствуя спектру поглощения комплексного соединения системы Hg(II) – GSH. В дальнейшем оптическую плотность измеряли при l = 220 нм.
По кривой насыщения (рис. 3) методом молярных соотношений [15] найдены оптимальные мольные соотношения компонентов комплексного соединения Hg(II) – GSH при l = 220 нм, которые равны 1:2.
Таким образом, в данных условиях эксперимента был обнаружен спектр поглощения комплексного соединения Hg[GS]2 при l = 220 нм. Количество лигандов GS–, входящих в состав комплекса, равно 2, что подтверждает полученные данные по составу комплекса Hg[GS]2 методом потенци0ометрии.
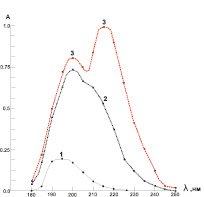
Рис. 2. Спектры поглощения систем ртуть – глутатион в водных средах: 1 – GSH (CGSH = 1,5·10–5 моль/л); 2 – Hg(NO3)2 (CHg(NO3)2 = 1,5·10–5 моль/л); 3 – комплекса Hg(II)-GSH (CGSH = 1,5·10–5 моль/л и CHg(NO3)2 = 1,5·10–5 моль/л)
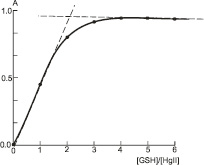
Рис. 3. Зависимость оптической плотности раствора А от мольного соотношения [GSH]/[HgII]
В результате исследований методом потенциометрии определены составы комплексов Hg2[GS]2 и Hg[GS]2. Количество лигандов в обоих случаях равно 2. Методом потенциометрии определены константы устойчивости комплексов: logβ2 = 38,38 для комплекса Hg[GS]2 и logβ2 = 15,64 для комплекса Hg2[GS]2. Выявлено, что комплекс состава Hg[GS]2 (1:2) обладает большей устойчивостью, чем комплекс состава Hg2(GS)2 (1:1). Методом спектрофотометрии получены результаты по составу комплекса Hg[GS]2 (1:2), которые согласуются с данными потенциометрического метода.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации 14.124.13.7366-МК.
Рецензенты:
Слепченко Г.Б., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Колпакова Н.А., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Дорожко Е.В., Короткова Е.И., Воронова О.А., Плотников Е.В., Вишенкова Д.А., Дерина К.В. ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩИХ СВОЙСТВ ГЛУТАТИОНА С ИОНАМИ РТУТИ ПОТЕНЦИОМЕТРИЧЕСКИМ И СПЕКТРОФОТОМЕТРИЧЕСКИМ МЕТОДАМИ // Фундаментальные исследования. 2013. № 8-3. С. 601-604;URL: https://fundamental-research.ru/ru/article/view?id=31965 (дата обращения: 15.11.2025).



