Липофильность – физико-химический параметр, вызывающий большой интерес в QSAR исследованиях благодаря значительной роли в описании динамических и фармакокинетических аспектов действия биологически активных соединений [5]. Многие из процессов распределения веществ зависят от способности их пересечь мембраны, которая измеряется количественно константой распределения в системе 1 – октанол-вода (logP) [7]. Вещества с большим значением logP высоколипофильны и легко проникают через клеточную мембрану, а с низкой – не способны к проникновению в клетку [2, 3].
Цель данной работы заключается в установлении количественной зависимости между экспериментально определенными значениями коэффициента распределения октанол – вода (logPэксп) и величиной противовоспалительной активности (ПВА). Объектом исследования являются производные антраниловой кислоты, при атоме азота которых содержатся ацильные, аллильный или 3-хлорбутен-2-ильный заместители, под общим названием N–алкилзамещенные производные антраниловой кислоты (17 соединений).
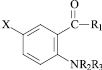
X = H, R1 = NHCH2CH = CH2, R2 = H, R3 = COCH2Cl (I); X = H,R1 = NHCH2CH = CH2, R2 = H, R3 = COCH2CH2CH3 (II); X = H, R1 = OH, R2 = H,R3 = COCH2Cl (III); X = Br, R1 = NH2, R2 = H, R3 = COCH2Cl (IV); X = Br, R1 = NH2,R2 = H, R3 = COCH2CH2CH2Cl (V); X = Br, R1 = NHCH2CH = CH2, R2 = H, R3 = COCH2CH2Cl (VI); X = H, R1 = OH, R2 = H, R3 = COCONHCH2CH = CH2 (VII); X = H, R1 = OH, R2 = H, R3 = COCH3 (VIII); X = H, R1 = OH, R2 = H, R3 = CH2CH = CH2 (IX); X = H, R1 = OH, R2 = H, R3 = CH2CH = C(Cl)CH3 (X); X = H, R1 = NHC6H4(4-Br), R2 = H, R3 = CH2CH = C(Cl)CH3 (XI); X = H, R1 = NHC6H4(2-CH3), R2 = H, R3 = CH2CH = C(Cl)CH3 (XII); X = H, R1 = NHC6H4(4-Br), R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XIII); X = H, R1 = NHC6H5, R2 = H, R3 = CH2CH = C(Cl)CH3 (XIV); X = H, R1 = NHC6H4(2-CH3), R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XV); X = H, R1 = NHC6H4(4-ОCH3), R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XVI); X = H, R1 = NHCH2CH2OH, R2 = H, R3 = COCONHCH2CH = CH2 (XVII).
Для изучения количественной зависимости фармакологического действия от физико-химических свойств соединений экспериментально определены величины коэффициента распределения октанол–вода (log Pэксп) спектрофотометрическим методом [6, 8]. Полученные результаты и их метрологические характеристики (S – стандартное отклонение среднего результата, ±∆log P средний и – значение относительной погрешности среднего результата при уровне значимости (α = 0,05)) для 17 соединений этого ряда (I–XVII), приведены в табл. 1. Значения log Pэксп лежат в интервале от 0,56 до 3,20.
Для исследования связи структура – противовоспалительная активность использовали значения ПВАэксп ( %), определенные через 4 часа, а для соединений ПВАэксп, которых определено через 3 и 5 часов, среднее значение (табл. 1).
С целью установления корреляционной зависимости между константой липофильности и ПВАэксп был проведен регрессионный анализ с использованием программы Statistica 6. В результате составлены три однопараметровых уравнения линейной, логарифмической и квадратичной регрессии (табл. 2), значимость которых была доказана с помощью вычисленного значения р, при α = 0,05, критериев Фишера и Стьюдента.
Для того чтобы проверить прогнозирующую способность составленных регрессионных уравнений, определены значения log Pэксп семи новых соединений из ряда N-алкилзамещенных производных антраниловой кислоты (XVIII–XXIV) (табл. 3).
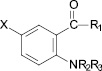
X = H, R1 = NH2, R2 = H, R3 = CH2CH = CH2 (XVIII); X = H, R1 = NHC6H4(3-CH3), R2 = H, R3 = CH2CH = C(Cl)CH3 (XIX); X = H, R1 = NHC6H4(4-CH3), R2 = H, R3 = CH2CH = C(Cl)CH3 (XX); X = H, R1 = NHC6H5, R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XXI); X = H, R1 = NHC6H4(3-CH3), R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XXII); X = H, R1 = NHC6H4(4-CH3), R2 = COCH3, R3 = CH2CH = C(Cl)CH3 (XXIII); X = H, R1 = NHC6H4(4-Cl), R2 = COCH3, R3 = CH2CH = CH2 (XXIV).
Таблица 1
Противовоспалительная активность и константы липофильности N–алкилзамещенных производных антраниловой кислоты (I–XVII)
|
Соединение |
Метрологические характеристики log Pэксп |
ПВАэксп, % |
|||
|
log Pэксп средний |
S |
±∆log Pэксп средний |
|
||
|
I |
1,48 |
0,0176 |
0,08 |
2,97 |
39,85 |
|
II |
1,82 |
0,0167 |
0,07 |
2,27 |
25,00 |
|
III |
0,78 |
0,0120 |
0,05 |
3,84 |
33,50 |
|
IV |
2,05 |
0,0120 |
0,05 |
1,45 |
44,95 |
|
V |
2,08 |
0,0176 |
0,08 |
2,11 |
38,75 |
|
VI |
2,73 |
0,0153 |
0,07 |
1,39 |
47,50 |
|
VII |
0,99 |
0,0120 |
0,05 |
3,03 |
14,50 |
|
VIII |
0,56 |
0,0100 |
0,04 |
4,44 |
24,90 |
|
IX |
1,87 |
0,0176 |
0,08 |
2,35 |
37,00 |
|
X |
1,47 |
0,0153 |
0,07 |
2,58 |
48,50 |
|
XI |
1,47 |
0,0219 |
0,09 |
3,70 |
18,90 |
|
XII |
3,20 |
0,0120 |
0,05 |
0,93 |
59,00 |
|
XIII |
2,35 |
0,0153 |
0,07 |
1,61 |
40,40 |
|
XIV |
2,70 |
0,0186 |
0,08 |
1,71 |
62,00 |
|
XV |
2,70 |
0,0318 |
0,14 |
2,92 |
50,10 |
|
XVI |
2,27 |
0,0233 |
0,10 |
2,56 |
42,40 |
|
XVII |
1,14 |
0,0176 |
0,08 |
3,85 |
39,00 |
Таблица 2
Корреляционные уравнения взаимосвязи значений констант липофильности с ПВАэксп
|
№ п/п |
Корреляционное уравнение |
N |
R |
F |
t |
p |
|
1 |
ПВАэксп = 15,305 + 12,825∙log P |
17 |
0,742 |
18,42 |
2,56 |
0,00064 |
|
2 |
ПВАэксп = 29,402 + 42,773∙log (log P) |
17 |
0,686 |
13,37 |
8,23 |
0,00234 |
|
3 |
ПВАэксп = 25,293 + 3,474∙log P2 |
17 |
0,758 |
20,33 |
6,76 |
0,00042 |
Таблица 3
Константы липофильности N–алкилзамещенных производных антраниловой кислоты (XVIII–XXIV)
|
Соединение |
Метрологические характеристики log Pэксп |
|||
|
log Pэксп средний |
S |
±∆log Pэксп средний |
|
|
|
XVIII |
1,73 |
0,0186 |
0,08 |
2,66 |
|
XIX |
2,82 |
0,0203 |
0,09 |
1,79 |
|
XX |
2,71 |
0,0203 |
0,09 |
1,85 |
|
XXI |
2,30 |
0,0219 |
0,09 |
2,36 |
|
XXII |
2,80 |
0,0208 |
0,09 |
1,85 |
|
XXIII |
2,62 |
0,0120 |
0,05 |
1,14 |
|
XXIV |
2,84 |
0,0145 |
0,06 |
1,27 |
Полученные результаты ПВАрассч и доверительные интервалы индивидуального предсказанного значения (ΔПВАрассч) приведены в табл. 4. Доверительный интервал индивидуального предсказанного значения рассчитывали по формуле (1) [1]:
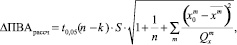 (1)
(1)
где t0,05 – коэффициент Стьюдента при уровне значимости (α = 0,05); n – число наблюдений в уравнении (n = 17); k – число оцениваемых параметров регрессионной модели (k = 2); m – независимая переменная, используемая в уравнении регрессии (log P); S – среднее квадратичное отклонение ошибок наблюдений; 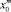 – значение независимой переменной (log P), используемой в расчётах;
– значение независимой переменной (log P), используемой в расчётах; 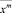 – среднее значение независимой переменной (log P), входящей в расчётную модель;
– среднее значение независимой переменной (log P), входящей в расчётную модель; 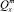 – сумма квадратов отклонений независимой переменной (log P), используемой в расчётной модели.
– сумма квадратов отклонений независимой переменной (log P), используемой в расчётной модели.
Теоретически рассчитанные величины ПВА соединений (XVIII–XXIV) подтверждены экспериментальными данными, которые представлены в табл. 4.
Таблица 4
Теоретически рассчитанные и экспериментальные значения ПВА N-алкилзамещенных производных антраниловой кислоты (XVIII–XXIV)
|
Соединение |
ПВАрассч, % |
ПВАэксп, % |
|||||
|
уравнение (1) |
уравнение (2) |
уравнение (3) |
|||||
|
ПВАрассч |
ΔПВАрассч |
ПВАрассч |
ΔПВАрассч |
ПВАрассч |
ΔПВАрассч |
||
|
XVIII |
37,49 |
17,01–57,98 |
39,58 |
17,35–61,82 |
35,69 |
15,77–55,62 |
51,6 |
|
XIX |
51,47 |
30,11–72,83 |
48,66 |
25,48–71,84 |
52,92 |
32,15–73,69 |
53,6 |
|
XX |
50,06 |
28,89–71,23 |
47,92 |
24,95–70,90 |
50,81 |
30,22–71,40 |
40,6 |
|
XXI |
44,80 |
24,15–65,46 |
44,87 |
22,45–67,30 |
43,67 |
23,58–63,76 |
57,3 |
|
XXII |
51,22 |
29,89–72,54 |
48,53 |
25,39–71,67 |
52,53 |
31,79–73,27 |
49,7 |
|
XXIII |
48,91 |
27,88–69,94 |
47,29 |
24,47–70,12 |
49,14 |
28,69–69,59 |
45,4 |
|
XXIV |
51,73 |
30,33–73,12 |
48,79 |
25,57–72,01 |
53,31 |
32,50–74,12 |
56,8 |
При сопоставлении значений противовоспалительной активности ПВАрассч с ПВАэксп, выявлено, что все значения ПВАэксп входят в доверительный интервал индивидуального предсказанного значения.
Для проведения сравнительной оценки качества прогнозирования ПВАрассч, с помощью полученных уравнений (1)–(3) (табл. 2) вычислены значения средней квадратичной ошибки прогноза: S1 = 9,90, S2 = 9,44 и S3 = 10,75. Величина средней квадратичной ошибки свидетельствует о том, что использование уравнений (1) и (2) (S1 = 9,90 и S2 = 9,44) приводит к более точным результатам прогнозирования ПВАэксп в сравнении с уравнением (3).
По расчётам процент торможения каррегинового отёка составил свыше 30 %. Экспериментально определенные значения ПВА для соединений XVIII–XXIV находятся в интервале 40,60–57,30 %.
Таким образом, можно сделать вывод, что составленные уравнения (1) и (2) могут быть использованы в дальнейших исследованиях для целенаправленного синтеза новых активных соединений с противовоспалительным действием в ряду N-алкилзамещенных производных антраниловой кислоты.
Экспериментальная часть
Экспериментальное определение величин коэффициента распределения октанол – вода N-алкилзамещенных производных антраниловой кислоты проводилось спектрофотометрическим методом в системе «октанол – вода» [6, 8]. Полученные результаты и их метрологические характеристики (S – стандартное отклонение среднего результата, ±∆log P средний и – значение относительной погрешности среднего результата при уровне значимости (α = 0,05)) для 24 соединений этого ряда (I–XXIV), приведены в табл. 1 и 3.
Противовоспалительное действие соединений (I–XXIV) (табл. 1 и 4) исследовали на белых нелинейных крысах массой 200–220 г на модели каррагенинового отёка. Изучаемые вещества вводили внутрибрюшинно в дозе 50 мг/кг в виде водной суспензии, стабилизированной твином–80, за 1 ч до инъекции флогогена. Крысам контрольной серии вводили эквивалентное количество раствора твина. В качестве препарата сравнения использовали ортофен, который вводили из расчёта 10 мг/кг в условиях, аналогичных описанным для тестируемых соединений. Объем лап животных измеряли онкометрически до и через 3, 4 и 5 ч после инициации воспаления [4]. Эффект оценивали по уменьшению прироста отека лап в сравнении с контрольной группой крыс.
Рецензенты:
Игидов Н.М., д.фарм.н., профессор кафедры органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Российской Федерации, г. Пермь;
Вихарева Е.В., д.фарм.н., профессор, зав. кафедрой аналитической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Российской Федерации, г. Пермь.
Работа поступила в редакцию 03.06.2013.
Библиографическая ссылка
Коркодинова Л.М., Андрюков К.В., Вейхман Г.А., Ендальцева О.С., Визгунова О.Л. ИССЛЕДОВАНИЯ ВЗАИМОСВЯЗИ СТРУКТУРЫ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ N– АЛКИЛЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ АНТРАНИЛОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ КОЭФФИЦИЕНТА РАСПРЕДЕЛЕНИЯ ОКТАНОЛ-ВОДА // Фундаментальные исследования. 2013. № 6-6. С. 1468-1472;URL: https://fundamental-research.ru/ru/article/view?id=31761 (дата обращения: 17.12.2025).





