Цель исследования: изучить патогенетические особенности фиброгенеза миокарда при эксприментальном моделировании различных вариантов острого стресса.
Материал и методы исследования
Эксперимент проводился на крысах-самцах линии Вистар, сопоставимых по возрасту и массе, в соответствии с Европейской конвенцией о защите животных, используемых в эксперименте (Директива 86/609/ЕЕС). Протокол эксперимента, содержание животных и выведение их из опыта были составлены в соответствии с принципами биоэтики, изложенными в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985) и приказе МЗ РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики».
Острый эксперимент проводился на 2 сериях крыс (по 20 крыс в каждой серии). Моделирование острого адренергического стресса (АС): крысам I серии однократно интраперитонеально вводился адреналин из расчета 50 мкг/кг (доза адреналина подбиралась эмпирически, и главным условием было отсутствие при данной дозе некроза кардиомиоцитов). Моделирование острого холинергического стресса (ХС): крысам II серии однократно интраперитонеально вводился антихолинэстеразный препарат «Прозерин» из расчета 20 мкг/кг. Через 2 часа, 6 часов, 24 часа и через один месяц после однократного введения адреналина и прозерина под эфирным наркозом проводилась декапитация животных и забор материала на исследование. В качестве контроля исследованы 10 крыс соответствующего возраста и массы, не повергавшиеся медикаментозным и стрессовым воздействиям.
Образцы миокарда левого и правого желудочка сердца фиксировали в 10 % растворе нейтрального формалина, дегидратировали в спиртах возрастающей концентрации и заливали в парафин по общепринятой методике с последующим изготовлением срезов ткани толщиной 4 мкм. Иммуногистохимические исследования проводились с использованием автоматической установки для иммуногистохимического и иммуноцитохимического окрашивания препаратов Autostainer 360 (Thermo Shandon, Великобритания). Использовались мышиные моноклональные антитела к TGF β1 (TB21) в разведении 1/100, кроличьи поликлональные антитела к FGF-2(147) в разведении 1/400 производства Santa Cruz Biotechnology, Inc., США, антитела к коллагену I типа, а также полимерная иммуногистохимическая система визуализации EnVision (DAKO, США) в соответствии с рекомендациями производителей реагентов. В качестве оптически плотной метки, визуализирующей продукт иммуногистохимической реакции, использовался диаминобензидин. После проведения иммуногистохимической реакции гистологические препараты докрашивались гематоксилином. Учет результатов иммуногистохимической реакции проводился с использованием светооптического бинокулярного микроскопа AxioscopeA1 (Carl Zeiss, Германия), TGF β1, FGF-2 и коллаген I – позитивные клетки имели отчетливое коричневое окрашивание. По степени окрашивания выделяли клетки с сильной, средней и слабой экспрессией. В 9 полях зрения миокарда левого желудочка (ЛЖ) и правого желудочка (ПЖ) каждой крысы в проводимом эксперименте рассчитывался индекс экспрессии (ИЭ) – количество позитивных клеток в 1 мм2 миокарда. Площадь 1 поля зрения с учетом увеличения микроскопа составляла 0,088 мм2 (из расчета длина изображения 0,355 мм, умноженная на ширину изображения 0,248 мм). Так же определялся индекс активности (ИА) эндотелиоцитов, который рассчитывался как % эндотелиоцитов, экспрессирующих факторы роста фибробластов от общего количества клеток, экспрессирующих фактор роста фибробластов ( %).
Результаты исследования и их обсуждение
Анализ результатов исследования показал, что при адренергическом стрессе в ЛЖ в контрольных точках 2–6 часов клеток, экспрессирующих коллаген I типа (коллаген I), не выявлено и только в контрольной точке 24 часа было обнаружено небольшое количество фибробластов, синтезирующих коллаген I – ИЭ был равен 0,32 кл./мм2 (рис. 1).
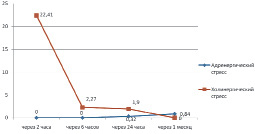
Рис. 1. Динамика показателя «Индекс экспрессии клеток» с сильной и средней экспрессией коллагена I типа в миокарде левого желудочка при адренергическом и холинергическом вариантах острого стресса
В ПЖ при АС было выявлено небольшое количество фибробластов со средней степенью экспрессии коллагена I: ИЭ = 1,58 кл./мм2 в контрольной точке 2 часа, ИЭ = 1,59 кл./мм2 в 6 часов и ИЭ = 0,32 кл./мм2 в 24 часа (рис 2). Клеток с сильной экспрессией коллагена I обнаружено не было.
В ПЖ только в контрольной точке 6 часов в небольшом количестве (ИЭ = 0,32 кл./мм2) были выявлены эндотелиоциты–«фибробласты», синтезирующие коллаген I типа (рис. 4). Во всех других контрольных точках как в ЛЖ, так и в ПЖ эндотелиоцитов, подвергшихся эндотелиально-мезенхимальной трансформации (ЭндМТ) [4, 5, 6, 7] и синтезирующих коллаген I типа, при АС не было выявлено.
При холинергическом стрессе содержание стромальных клеток миокарда, экспрессирующих коллаген I, было значительно больше во всех контрольных точках исследования как в правом, так и в левом желудочках сердца. Максимальная экспрессия клетками коллагена I отмечена через 2 часа после введения прозерина в миокарде обоих желудочков. Так, ИЭ с сильной и средней экспрессией в ЛЖ был равен 22,41 кл./мм2 (рис. 1), а в ПЖ ИЭ = 26,05 кл./мм2 (рис. 2). Причем в ЛЖ 26,8 % экспрессирующих коллаген I клеток были представлены эндотелиоцитами, подвергшимися ЭндМТ и синтезирующими коллаген I со средней степенью экспрессии. В ПЖ число эндотелиоцитов-«фибробластов» составляло 2,9 % от общего числа клеток с сильной и средней экспрессией коллагена I.
Кроме того, практически во всех контрольных точках как в ЛЖ, так и в ПЖ отмечалось небольшое количество эндотелиоцитов-«фибробластов» со слабой экспрессией коллагена I.
Интересно заметить, что в контрольной точке 6 часов при ХС значительно уменьшилось число клеток, экспрессирующих коллаген I: в ЛЖ – в 9,7 раза, в ПЖ – в 6,5 раза.
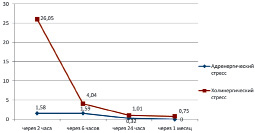
Рис. 2. Динамика показателя «Индекс экспрессии клеток» с сильной и средней экспрессией коллагена I типа в миокарде правого желудочка при адренергическом и холинергическом вариантах острого стресса
То есть уже через 6 часов после введения прозерина при ХС после значительного возрастания резко уменьшилось число экспрессирующих коллаген I клеток, остающееся примерно на том же уровне и в контрольной точке 24 часа.
Обращает на себя внимание значительное преобладание числа эндотелиоцитов, вырабатывающих коллаген I типа при ХС, в отличие от АС (рис. 3,4). Так, из 54 наблюдений при АС только в одном (1,9 %) наблюдалась экспрессия эндотелиоцитами коллагена I типа, а при ХС из 54 наблюдений в 45 случаях (83,3 %), χ2 = 50,140, р = 0,0001. То есть при ХС содержание эндотелиоцитов-«фибробластов» в миокарде значительно выше, а, следовательно, можно предпологать, что и ремоделирование сосудов при этом стрессе выражено сильнее. Первичность поражения сосудов или миокарда при таком стрессобусловленном заболевании, как АГ, являющаяся предметом продолжающейся дискуссии, возможно, зависит от того, какое вегетативное сопровождение переживаемого стресса имеется у больных АГ – с преобладанием адренергических или холинергических влияний.
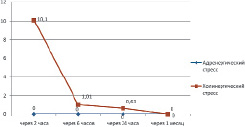
Рис. 3. Динамика показателя «Индекс экспрессии эндотелиоцитов-«фибробластов» со средней и слабой экспрессией коллагена I типа в миокарде левого желудочка при адренергическом и холинергическом вариантах острого стресса
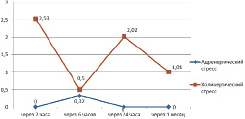
Рис. 4. Динамика показателя «Индекс экспрессии эндотелиоцитов-«фибробластов» со средней и слабой экспрессией коллагена I типа в миокарде правого желудочка при адренергическом и холинергическом вариантах острого стресса
Участие эндотелиоцитов в выработке коллагена I типа при остром холинергическом стрессе представляет несомненный интерес, поскольку трансформация эндотелиоцитов в фибробласты вызывает такие изменения в сосудистой стенке, которые могут запускать внутрисосудистый путь свертывания крови коллагеном, который в норме не экспонирован на внутренней поверхности сосудов и появляется лишь при трансформации эндотелиоцитов. Запуск внутрисосудистого свертывания происходит при контакте крови с коллагеном базальной мембраны эндотелиоцитов, когда последние трансформируются в «фибробласты» и продвигаются вглубь миокарда, обнажая базальную мембрану, соприкасающуюся с кровью до момента развития регенераторной пролиферации эндотелия и восстановления целостности эндотелиальной выстилки (рис. 5). Кроме того, в сосудах с подвергшимися ЭндМТ эндотелиоцитами, еще составляющими часть эндотелиальной выстилки и вырабатывающими мономеры коллагена в просвет сосуда можно визуализировать синтезируемый продукт в виде сильно окрашенного «позитивного вещества» в просвете сосуда в непосредственной близости от коллаген I – позитивных эндотелиоцитов (рис. 6).
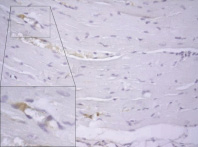
Рис. 5. Миокард правого желудочка через 6 часов после однократного введения прозерина. ИГХ реакция, ув. х400, коллаген I типа (мономеры) окрашен маркером (DAB) в коричневый цвет. Выделенный комплекс клеток – сосуд капиллярного типа, одна из эндотелиальных клеток экспрессирует коллаген
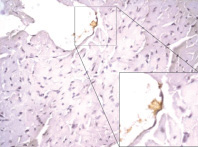
Рис. 6. Миокард правого желудочка через 2 часа после однократного введения прозерина. ИГХ реакция, ув. х400, коллаген I типа (мономеры) окрашен маркером (DAB) в коричневый цвет. Эндотелиоцит с экспрессией коллагена I типа в цитоплазме и выделяющий его в просвет сосуда
Объяснить только неспецифической иммуногистохимической реакцией такое интенсивное окрашивание в просвете сосуда в непосредственной близости от эндотелиоцита-«фибробласта» с сильной экспрессией вряд ли возможно. Интересно отметить, что при ХС уже через 2 часа визуализировались клетки, интенсивно синтезирующие металлопротеиназы-1, тогда как при АС через 2 часа от начала острого стресса клетки, синтезирующие металлопротеиназы-1, не были найдены. Продукты деградации коллагена, образующиеся при ХС в первые часы острого стресса, также могут способствовать запуску внутрисосудистого свертывания крови.
При моделировании как АС, так и ХС можно наблюдать сосуды миокарда, где эндотелий десквамирован и базальная мембрана эндотелиоцитов на большом протяжении сосуда может контактировать с кровью (рис. 7). Спазм сосудов документировался изменением ориентации клеток эндотелиальной выстилки при снижении периметра сосуда, располагающихся перпендикулярно по отношению к внутренней мембране принимающей вид частокола – «вздыбленные» эндотелиоциты по образному выражению Савчук А.Н. [3]. Вследствие нарушения межклеточных связей и связей с базальной мембраной обнаруживается полная или частичная десквамация эндотелия с обнажением субэндотелиального слоя (рис. 8), контактирующего с кровью.
Все перечисленные изменения в сосудах миокарда способствуют запуску внутрисосудистого свертывания крови, пусковым фактором которого является XII (фактор Хагемана), активация которого происходит при контакте крови с субэндотелиальной мембраной (коллагеном) и с мономерами коллагена, экспрессируемыми эндотелиоцитами – «фибробластами» в просвет сосуда. В целом фактор Хагемана является универсальным активатором всех плазменных протеолитических систем: свертывающей, фибринолитической и системы комплимента [1]. В описываемой модели острого стресса реализуется контактная активация фактора XII с образованием активного фрагмента фактора XIIа. Фактор XIIа в большей степени влияет на свертываемость крови.
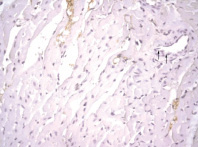
Рис. 7. Миокард правого желудочка через 2 часа после однократного введения прозерина. ИГХ реакция, ув. х400, коллаген I типа (мономеры) окрашен маркером (DAB) в коричневый цвет. Спазм микрососудов с нарушением ориентации эндотелиоцитов («вздыбленные» эндотелиоциты) и появлением просветов между ними
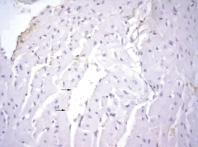
Рис. 8. Миокард правого желудочка через 24 часа после однократного введения прозерина. ИГХ реакция, ув. х400, коллаген I типа (мономеры) окрашен маркером (DAB) в коричневый цвет. Десквамация эндотелиоцитов сосуда с нарушением целостности эндотелиальной выстилки (возможные зоны контакта коллагена базальной мембраны с кровью)
С учетом изложенного можно полагать, что при ХС в большей степени, чем при АС в первые часы эксперимента происходит нарушение реологических свойств крови. Не исключено, что описанные изменения структуры эндотелия и последующий контакт коллагена с кровью является предтечей развития хронического ДВС-синдрома, который нередко наблюдается у больных с такими стрессобусловленными заболеваниями, как АГ и ИБС.
Рецензенты:
Насыров Р.А., д.м.н., профессор, заведующий кафедрой патологической анатомии с курсом судебной медицины Санкт-Петербургского государственного педиатрического медицинского университета, г. Санкт-Петербург;
Цинзерлинг В.А., д.м.н., профессор, заведующий лабораторией патоморфологии Санкт-Петербургского научно-исследовательского института фтизиопульмонологии, г. Санкт-Петербург.
Работа поступила в редакцию 04.04.2013.
Библиографическая ссылка
Вебер В.Р., Рубанова М.П., Лобзин Ю.В., Жмайлова С.В., Карев В.Е., Румянцев Е.Е. ОСОБЕННОСТИ ФИБРОГЕНЕЗА МИОКАРДА ПРИ АДРЕНЕРГИЧЕСКОМ И ХОЛИНЕРГИЧЕСКОМ СТРЕССЕ В ЭКСПЕРИМЕНТЕ // Фундаментальные исследования. 2013. № 5-1. С. 50-54;URL: https://fundamental-research.ru/ru/article/view?id=31456 (дата обращения: 01.07.2025).



