По данным Всемирной организации здравоохранения возрастная макулярная дегенерация (ВМД) является одной из ведущих причин необратимого снижения зрения населения пожилой и старческой возрастных групп во всех развитых странах мира [5]. В Испании распространённость ВМД увеличилась с 1,3 % у лиц в возрасте 65–74 лет до 8,5 % у лиц в возрасте старше 80 лет, что коррелирует с результатами других крупномасштабных исследований распространённости патологии среди населения Европы, США и Азии [4]. В России заболеваемость ВМД составляет 15 случаев на 1000 населения [2, 3]. При прогнозировании распространённости различных форм ВМД среди населения США установлено существенное увеличение заболевания до 17,8 млн человек к 2050 г. по сравнению с 9,1 млн в 2010 г. [5]. Однако при обследовании пациентов с данной патологией редко применяются современные объективные методы – конфокальная микроскопия и оптическая когерентная томография, что затрудняет диагностику ВМД. Практически не изученным является состояние антиоксидантной системы, а при её оценке не применялись математические методы, обеспечивающие объективизацию полученных результатов и выделение диагностически значимых показателей.
Цель настоящей работы: совершенствование диагностики ВМД у больных офтальмологического профиля на основе алгоритмизации и информативных методов обследования.
В условиях офтальмологического стационара у 115 больных с ВМД, составивших основную группу, изучены острота и поля зрения, состояние роговицы, антиоксидантной системы. Аналогичными методами проведено обследование 108 здоровых лиц одинакового возраста, включённых в контрольную группу. Состояние роговицы исследовали методом конфокальной микроскопии и оптической когерентной томографии. Содержание показателей антиоксидантной системы определяли по методике, изложенной в работе [1]. При статистическом анализе данных применялись адекватные математические методы в соответствии с разработанным нами алгоритмом (рис. 1). Алгоритм позволяет комплексно оценить произошедшие патологические изменения и выделить наиболее важные в диагностическом отношении показатели.
Определение остроты зрения у больных обследуемой группы выявило её снижение до 0,82 ± 0,11 диоптрий. Поля зрения также достоверно снижены. Особенно это характерно для верхней и носовой границ поля зрения. Так, носовая граница поля зрения для красного тест-объекта составила 25º, а для зелёного тест-объекта – 20 °. Снижение верхней границы поля зрения для данных тест-объектов соответственно равно 28 и 25 °.
Проведение конфокальной микроскопии у пациентов с ВМД позволило установить и визуализировать патологические изменения роговицы. Изменения эпителия роговицы проявлялись в виде слущивания поверхностных эпителиоцитов, нарушения контакта эпителия с боуменовой мембраной, буллёзных изменений, сглаженности контура клеток. В стромальном слое определялись отек, складчатость, гиперрефлексирующие включения (активированные кератоциты); гиперрефлексирование и утолщение нервных элементов (как результат их активации). Определялась складчатость десцеметовой мембраны. Визуализировались изменения эндотелия роговицы в виде нарушения непрерывности цитоплазмы клеток, отмечался полиморфизм клеток; потеря клеток заднего эпителия роговицы составила в среднем 6,4 %.
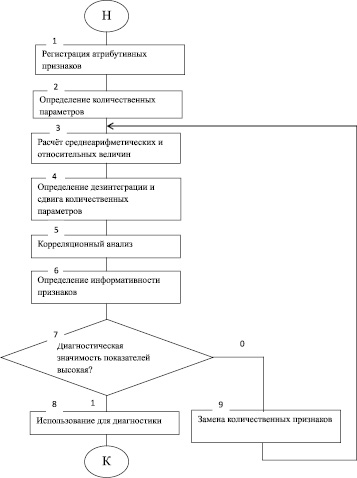
Рис. 1. Алгоритм математической обработки атрибутивных и количественных параметров у больных с ВМД
При выполнении оптической когерентной томографии получены следующие результаты (табл. 1). Среднеарифметическая толщина роговицы у пациентов основной группы достоверно выше, чем в контроле. Данный количественный признак свидетельствует о выраженности патологических изменений и является важным диагностическим критерием. Одновременно установлены изменения в слоях роговицы у больных основной группы: неоднородность слоёв, неравномерность толщины стромального слоя. Эндотелий у пациентов с исследуемой патологией изменён, имеет очаговые поражения. В стромальном слое определены гипоинтенсивные включения двух видов: первый вид – это линейные, неравномерные с размытыми границами включения, находящиеся в центральных отделах стромального слоя, занимающие около 1/3–1/4 его ширины. Второй вид включений – образования полукруглой формы, находящиеся на внутренней поверхности роговицы, отделенные от передней камеры глаза границей более высокой интенсивности, которая в некоторых случаях была прерывистой. Наличие включений первого типа свидетельствует о повреждении ткани, приводящем к сморщиванию коллагеновых волокон, которое визуально может принимать форму «акульего плавника». Включения второго типа можно интерпретировать как локальные участки отслойки десцеметовой мембраны, а участки прерывистой границы как дефекты десцеметовой оболочки и находящегося на ней эндотелия.
Таблица 1
Состояние роговицы по данным оптической когерентной томографии у пациентов с ВМД
|
Показатели |
Основная группа |
Контрольная группа |
|
Толщина роговицы, мкм |
1389,2 ± 11,7 |
1210,5 ± 14,6 |
|
Эпителиальный слой |
Неоднородный |
Однородный |
|
Строма |
Неравномерность толщины, наличие включений |
Без включений |
|
Десцеметова мембрана |
Утолщена, неоднородная |
Однородная с ровными границами |
|
Эндотелий |
Изменён |
Без изменений |
|
Частота патологических изменений, % |
57,2 ± 4,6 |
4,8 ± 2,1 |
Содержание показателей антиоксидантной системы при диагностическом исследовании периферической крови у пациентов с ВМД существенно отличается от значений здоровых лиц (табл. 2). Так, суммарная антиокислительная активность крови достоверно снижена (P < 0,001). На системном уровне существенно снижается концентрация глутатионредуктазы и глутатион-S-трансферазы. Содержание одного из ключевых параметров антиоксидантной системы – каталазы – при ВМД также, как и вышеуказанных показателей, существенно уменьшается. Напротив, уровень глутатионпероксидазы и супероксиддисмутазы в периферической крови репрезентативно возрастает в сравнении с контролем. Не имел достоверных различий среди изученных параметров антиоксидантной системы только восстановленный глутатион.
Таблица 2
Антиоксидантные нарушения среди пациентов с ВМД в периферической крови (M ± m)
|
Параметры антиоксидантной системы |
Основная группа |
Контрольная группа |
Достоверность различий |
|
Антиокислительная активность, отн.ед. |
23,8 ± 1,3 |
34,5 ± 1,1 |
P < 0,001 |
|
Глутатионредуктаза, мкмоль/л |
23,2 ± 0,9 |
27,9 ± 0,9 |
P < 0,001 |
|
Глутатион-S-трансфераза, ммоль/л |
24,8 ± 0,3 |
32,8 ± 0,4 |
P < 0,001 |
|
Восстановленный глутатион, ммоль/л |
1,9 ± 0,2 |
2,2 ± 0,3 |
P > 0,05 |
|
Глутатионпероксидаза, мкмоль/л |
56,5 ± 0,7 |
39,2 ± 0,6 |
P < 0,001 |
|
Каталаза, кат/л |
78,2 ± 0,9 |
89,3 ± 1,1 |
P < 0,001 |
|
Супероксиддесмутаза, усл.ед. |
53,7 ± 1,3 |
13,2 ± 0,9 |
P < 0,001 |
Примечание. P рассчитано в сравнении с контролем.
Математический анализ изменений в состоянии параметров оксидантной системы в группе больных с ВМД свидетельствует о незначительных сдвигах большинства показателей (табл. 3). При этом наиболее низкий и отрицательный сдвиг выявлен для каталазы. Одинаковой величины по модулю сдвиг отмечен для глутатионредуктазы, глутатион-S-трансферазы и восстановленного глутатиона. Значительно выше величина сдвига наблюдалась у глутатионпероксидазы. Однако выраженный показатель сдвига среди параметров антиоксидантной системы при ВМД характерен для супероксиддисмутазы, обусловивший в конечном итоге высокое значение данного параметра для группы в целом. Показатель дезинтеграции имел максимальное значение для супероксиддисмутазы. Значительный уровень дезинтеграции в основной группе характерен и для антиокислительной активности крови, и для глутатионпероксидазы. Крайне низкая дезинтеграция присуща глутатионредуктазе.
Таблица 3
Количественные значения сдвига и дезинтеграции параметров антиоксидантной системы на системном уровне при ВМД
|
Показатели антиоксидантной системы, единица измерения |
Процент сдвига, % |
Уровень дезинтеграции |
|
Антиокислительная активность, отн.ед. |
-25,3 |
7,2 |
|
Глутатионредуктаза, мкмоль/л |
-14,2 |
1,5 |
|
Глутатион-S-трансфераза, ммоль/л |
-17,4 |
2,7 |
|
Восстановленный глутатион, ммоль/л |
+13,8 |
5,7 |
|
Глутатионпероксидаза, мкмоль/л |
+42,8 |
6,0 |
|
Каталаза, кат/л |
-8,6 |
4,2 |
|
Супероксиддисмутаза, усл.ед. |
+335,3 |
12,1 |
|
Сумма |
457,4 |
39,4 |
Моделирование клинической ситуации по изменению параметров антиоксидантной системы вследствие развития ВМД выявило неравномерность сдвигов по отношению к значениям здоровых лиц (рис. 2). Наиболее устойчивым показателем антиоксидантной системы периферической крови оказалась каталаза. Незначительные отклонения с отрицательной направленностью свойственны для глутатионредуктазы и глутатион-S-трансферазы, а незначительное превышение – для восстановленного глутатиона. Более существенное превышение величин контроля имеет глутатионпероксидаза. Вместе с тем, экстремум сдвига среди изученных параметров антиоксидантного статуса установлен для супероксиддесмутазы.
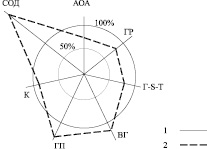
Рис. 2. Модель сдвигов показателей антиоксидантного статуса крови у больных ВМД (в %):АОА – антиокислительная активность, ГР – глутатионредуктаза, Г-S-Т – глутатион-S-трансфераза, ВГ – восстановленный глутатион, ГП – глутатионпероксидаза, К – каталаза, СОД – супероксиддисмутаза;1 – здоровые женщины, 2 – основная группа
Изучение диагностической значимости активности ферментов антиоксидантной системы посредством корреляционного анализа указывает на повышение сопряженности ее составляющих при развитии ВМД (рис. 3). Это подтверждается увеличением числа репрезентативных корреляционных связей в основной группе в сравнении с контролем. Прямые достоверные связи у больных ВМД установлены между глутатионпероксидазой и супероксиддисмутазой, восстановленным глутатионом и глутатионредуктазой, глутатионредуктазой и глутатион-S-трансферазой. Обратная зависимость обнаружена между антиокислительной активностью и супероксиддисмутазой, глутатионпероксидазой и глутатионредуктазой. Выявлены также три криволинейные связи: супероксиддисмутазы с глутатион-S-трансферазой, глутатионредуктазой; каталазы с глутатионпероксидазой. Среди здоровых лиц количество достоверных корреляций существенно ниже. Они представлены взаимосвязью глутатионпероксидазы и глутатионредуктазы, каталазы и супероксиддисмутазы, антиокислительной активности и глутатион-S-трансферазы.
Распространенность отклонений анализируемых показателей антиоксидантной системы у больных ВМД в основном невелика (табл. 4). Изменение содержания глутатион-S-трансферазы менее 28,0 ммоль/л, восстановленного глутатиона выше 2,2 ммоль/л и каталазы ниже 82,0 кат/л в периферической крови встречается в 7–8 % случаев. Значительно чаще распространены снижение антиокислительной активности крови ниже 28,0 отн.ед. и повышение содержания глутатионпероксидазы более 45,0 мкмоль/л. Наиболее часто в основной группе встречается увеличение супероксиддисмутазы свыше 40,0 усл. ед. Данному ферменту антиоксидантной системы принадлежит высокая информативность. Значимой информативностью обладают глутатионпероксидаза и антиокислительная активность крови. Низкоинформативными параметрами антиоксидантной системы на системном уровне служат глутатион-S-трансфераза и восстановленный глутатион.
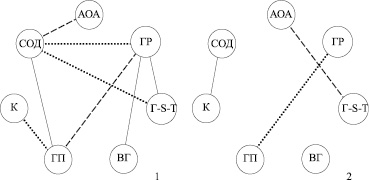
Рис. 3. Сопряженность ферментов антиоксидантной системы при ВМД (1) и у здоровых лиц (2) в периферической крови:приняты обозначения что и на рис. 2; – прямая достоверная связь; – обратная значимая корреляция, – криволинейная зависимость
Таблица 4
Информативность и частота встречаемости изменений ферментов антиоксидантной системы в основной и контрольной группах в периферической крови
|
Показатели антиоксидантной системы |
Частота встречаемости |
Инфомативность |
|
|
ВМД |
здоровые |
||
|
Антиокислительная активность ниже 28,0 отн. ед. |
13,5 |
0,3 |
144,8 |
|
Глутатионредуктаза менее 26,0 мкмоль/л |
8,7 |
0,2 |
91,7 |
|
Глутатион-S-трансфераза менее 28,0 млмоль/л |
7,3 |
0,1 |
56,7 |
|
Восстановленный глутатион выше 2,2 млмоль/л |
6,4 |
0,1 |
59,2 |
|
Глутатионпероксидаза свыше 45,0 мкмоль/л |
17,5 |
0,3 |
172,3 |
|
Каталаза ниже 82,0 кат/л |
6,9 |
0,2 |
62,4 |
|
Супероксиддисмутаза свыше 40,0 усл. ед. |
41,3 |
0,4 |
458,7 |
На основании полученных результатов диагностический процесс при ВМД можно представить в виде следующего алгоритма (рис. 4). Созданный алгоритм моделирует логику врача-офтальмолога при проведении диагностики названной патологии. Следовательно, алгоритмизация диагностики ВМД обеспечивает последовательное применение диагностических методов. Кроме того, при использовании алгоритмов качество диагностики улучшилось на 10,3 %,что позволяет рекомендовать их для более широкого клинического применения.
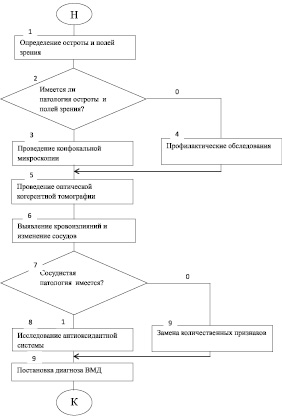
Рис. 4. Алгоритм диагностики ВМД
Рецензенты:
Зарубина Т.В., д.м.н., профессор, заведующая кафедрой медицинской кибернетики и информатики Российского национального исследовательского медицинского университета им. Н.И. Пирогова Минздравсоцразвития, г. Москва;
Красненков В.Л., д.м.н., профессор, заведующий кафедрой общественного здоровья и здравоохранения с курсами истории медицины и медицинской информатики Тверской государственной медицинской академии Минздравсоцразвития, г. Тверь.
Работа поступила в редакцию 13.03.2013.
Библиографическая ссылка
Агаркова Д.И. МАТЕМАТИЧЕСКАЯ АЛГОРИТМИЗАЦИЯ ДИАГНОСТИКИ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ // Фундаментальные исследования. 2013. № 5-1. С. 17-22;URL: https://fundamental-research.ru/ru/article/view?id=31449 (дата обращения: 12.01.2026).



