Гипертензивный криз (ГК) является независимым фактором риска развития различных сердечно-сосудистых заболеваний и их осложнений значительно чаще, чем постоянно высокое артериальное давление, и служит одной из причин инвалидизации и смерти больных [11].
Одним из звеньев патогенеза развития ГК является внезапное повышение периферического сопротивления сосудов, приводящее к нарушению микроциркуляции, развитию гипоксии тканей и изменению процессов перекисного окисления липидов (ПОЛ) [3]. Процессы ПОЛ являются важными для нормального функционирования биологических мембран и организма в целом и выступают как ранние ключевые звенья ответной реакции организма на стрессорные состояния. При нормальном течении метаболизма образующиеся в плазме и эритроцитах крови кислородные радикалы инактивируются сложной системой антирадикальной защиты. Если содержание свободных радикалов увеличивается при повышении скорости их образования или снижении способности организма к их нейтрализации, то запускаются процессы перекисного окисления липидов, нарушается баланс системы «прооксиданты-антиоксиданты», т.е. развивается оксидативный стресс [1].
Оксидативный стресс приводит к окислению мембранных белков, инактивации ферментов, снижению электрической стабильности, повышению проницаемости мембран, вплоть до полной потери мембраной ее барьерных функций и т.д. [2]. В свою очередь, повреждение мембран ведет к развитию дисфункции эндотелия и снижению выработки оксида азота [7], радикалы которого выполняют, в том числе, роль активного вазодилататора, участвующего в регуляции тонуса сосудов.
Целью данного исследования явилось изучение особенностей течения оксидативного стресса у больных с неосложненными гипертензивными кризами.
Материалы и методы исследования
В настоящем исследовании приняли участие 119 человек. Первую группу составили практически здоровые добровольцы: 54 человека, из них 23 мужчины и 31 женщина, средний возраст 57,6 ± 1,5 лет. Вторая группа - 52 человека, страдающих артериальной гипертензией, с отсутствием признаков гипертензивного криза, из них 30 мужчин и 22 женщины, средний возраст 55,9 ± 1,2 лет. В третью группу вошли пациенты с неосложненными ГК - 13 человек, из них 4 мужчины и 9 женщин, средний возраст 56,9 ± 2,5 лет. Диагноз гипертензивного криза ставился в случаях внезапного повышения АД, сопровождающегося появлением или усугублением клинических симптомов и требующего быстрого контролируемого снижения АД для предупреждения повреждения органов-мишеней [4]. Учитывались типичные жалобы и индивидуально высокое повышение цифр АД.
У всех обследуемых осуществлялся забор венозной крови для изучения процессов свободнорадикального окисления и антиоксидантной защиты организма в плазме крови и эритроцитах. Определяли: интенсивность быстрой вспышки (Н) и светосумму хемилюминесценции (Sm) [12]; содержание нитрозилгемоглобина (NOHb 418 нм) [10]; уровни продуктов ПОЛ - диеновых конъюгатов (ДК) [9], малонового диальдегида (МДА) [8] и шиффовых оснований (ШО) [13]; активность супероксиддисмутазы (СОД) [14], каталазы (КАТ) [6] и церулоплазмина (ЦП) [5].
Исследование проводилось на базе приемного и 3-го кардиологического отделений МЛПУ ГБСМП № 2 г. Ростова-на-Дону. Биохимические исследования проводились в НИИ Биологии при Южном федеральном университете.
Статистическая обработка результатов проводилась методом вариационного анализа с использованием t-критерия Стъюдента.
Результаты исследования и их обсуждение
В процессе анализа полученных результатов было установлено, что если при АГ наблюдалась тенденция к снижению, как интенсивности быстрой вспышки ХЛ (Н), так и светосуммы хемилюминисценции (Sm), что могло свидетельствовать о снижении уровня генерации свободных радикалов, в частности, супероксидного радикала кислорода (О2‒), гидроксильного радикала (ОН‒), которые обладают цитотоксическим действием и способны инициировать ПОЛ, то при ГК наблюдалось уже достоверное снижение интенсивности этих процессов в сравнении с показателями здоровых добровольцев. Так, у пациентов с ГК интенсивность Н была на 61,5 % ниже, чем у здоровых лиц (p < 0,001), а Sm, отражающая скорость расходования липидных радикалов в результате их взаимодействия друг с другом или с эндогенными антиоксидантами, была ниже на 54,9 % (p < 0,001) (табл. 1, рис. 1).
Таблица 1
Показатели свободнорадикального окисления и антиоксидантной системы плазмы крови у пациентов исследуемых групп (M ± m)
|
Показатель |
Группы |
||
|
1 |
2 |
3 |
|
|
Н, мм |
53,04 ± 2,84 |
46,80 ± 3,00 |
20,45 ± 3,65 p2 < 0,001; p3 < 0,001 |
|
Sm, отн. ед. |
91,75 ± 6,27 |
77,65 ± 5,00 |
41,36 ± 7,55 p2 < 0,001; p3 < 0,001 |
|
NOHb 418, ед.опт.плотн./мг. Hb |
6,11 ± 0,21 |
4,81 ± 0,27 p1 < 0,001 |
7,75 ± 0,96 p3 < 0,01 |
|
ДК, нмоль/мл |
15,34 ± 0,69 |
13,97 ± 0,30 |
25,35 ± 2,43 p2 < 0,001; p3 < 0,001 |
|
МДА, нмоль/мл |
30,21 ± 1,03 |
31,35 ± 0,97 |
38,28 ± 2,67 p2 < 0,01 |
|
ШО, отн. ед./мл |
1,41 ± 0,07 |
1,12 ± 0,02 p1 < 0,001 |
2,28 ± 0,18 p2 < 0,001; p3 < 0,001 |
|
КАТ, нмоль Н2О2/ мл |
13,21 ± 0,56 |
11,06 ± 0,73 |
7,29 ± 1,93 p2 < 0,01 |
|
ЦП, мкмоль/л |
1,05 ± 0,05 |
1,27 ± 0,08 |
1,29 ± 0,06 p2 < 0,01 |
Примечания:
р1 - достоверность различий между группами 1 и 2;
р2 - достоверность различий между группами 1 и 3;
р3 - достоверность различий между группами 2 и 3.
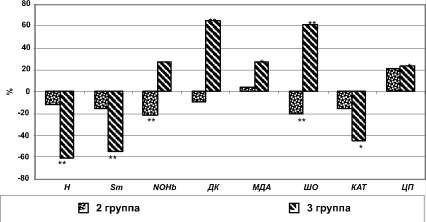
Рис. 1. Различия показателей свободнорадикального окисления и антиоксидантной системы плазмы крови пациентов 2-й и 3-й групп в сравнении с показателями здоровых лиц, %. Примечание: * - p < 0,01, ** - p < 0,001
Известно, что в регуляции артериального давления, за счет своих вазодилятационных свойств, большое значение играет монооксид азота (NO), который образуется клетками стенок кровеносных сосудов, фагоцитами, нервными клетками и др. Но в присутствии соединений, содержащих SH-группы, из NO образуется радикал NO - NO• [2]. Супероксид-анион способен связывать NO• с образованием пероксинитрита. При связывании NO• артериальное давление повышается. Следовательно, «соотношение концентраций этих двух радикальных соединений управляет тонусом сосудов» [1]. Следует отметить, что NO• может также участвовать в нефентоновском механизме образования гидроксильного радикала (ОН•), который обладает наиболее мощным цитотоксическим и деструктивным потенциалом. Один из путей естественного удаления избытка NO• - его связывание гемоглобином, когда образуется нитрозилгемоглобин с последующим окислением [2]. Согласно полученным в ходе настоящего исследования результатам у пациентов с АГ отмечалось уменьшение количества нитрозилгемоглобина в сравнении с данным показателем здоровых добровольцев на 21,1 % (p < 0,001). При ГК, наоборот, имелась тенденция к увеличению этого показателя (см. табл. 1, рис. 1).
Несмотря на снижение генерации активных форм кислорода, было выявлено, что у пациентов с ГК существенно повышался уровень накопления продуктов ПОЛ. Так, у данной категории пациентов уровни ДК, МДА и ШО в плазме крови были значительно выше (на 65,3; 26,7 и 61,7 % соответственно; p < 0,001, p < 0,01 и p < 0,001соответственно), чем у здоровых лиц. У пациентов 2-й группы, напротив, уровень конечных продуктов ПОЛ - шиффовых оснований, был ниже показателей пациентов 1-й группы на 20,6 % (p < 0,001), отклонения уровней ДК и МДА были недостоверны (см. табл. 1, рис. 1).
Исследование уровней содержания молекулярных продуктов ПОЛ в эритроцитах выявило, что у пациентов с ГК содержание ДК было ниже на 43,3 % (p < 0,001), а ШО - выше на 84,6 % (p < 0,001) уровней данных показателей здоровых добровольцев. Сравнение аналогичных показателей между данными пациентов 1 и 2 групп также выявило достоверность различий, хотя разница была не столь выражена. Уровень ДК был выше условной нормы на 32,9 % (p < 0,001), ШО - на 19,2 % (p < 0,01) (табл. 2, рис. 2).
Интенсивность свободнорадикального окисления липидов в организме регулируется сложной системой антиоксидантов, в том числе, ферментативной природы. На фоне повышенной активности ПОЛ плазмы
крови у пациентов 2-й и 3-й групп отмечалась активация церулоплазмина, который, выступая в качестве перехватчика супероксидного анион-радикала и гипохлорита, является одним из регуляторов процессов
ПОЛ. При это, у пациентов 3-й группы на фоне гипертензивного криза активность ЦП была повышена на 22,9 % (p < 0,01) по отношению к данным здоровых добровольцев, а во 2-й группе имелась лишь тенденция к повышению его активности. Обращает на себя внимание, что у пациентов с ГК уровень каталазы плазмы крови - главного утилизатора перекиси водорода [1] - был на 44,8 % (p < 0,01) ниже показателя здоровых
добровольцев, тогда как у пациентов с АГ отмечена лишь тенденция к его снижению (см. табл. 1, рис. 1).
Таблица 2
Показатели свободнорадикального окисления и антиоксидантной системы эритроцитов у пациентов исследуемых групп (M ± m)
|
Показатель |
Группы |
||
|
1 |
2 |
3 |
|
|
ДК, нмоль/мг Hb |
7,05 ± 0,37 |
9,37 ± 0,23 p1 < 0,001 |
4,00 ± 0,37 p2 < 0,001; p3 < 0,001 |
|
МДА, нмоль/мг Hb |
3,82 ± 0,09 |
3,37 ± 0,08 p1 < 0,001 |
4,02 ± 0,37 |
|
ШО, отн. ед. фл./мг Hb |
0,52 ± 0,01 |
0,62 ± 0,01 p1 < 0,001 |
0,96 ± 0,13 p2 < 0,001; p3 < 0,01 |
|
СОД, ед./мг Hb |
3,52 ± 0,09 |
3,18 ± 0,06 p1 < 0,01 |
2,11 ± 0,15 p2 < 0,001; p3 < 0,001 |
|
КАТ, нмоль Н2О2/мг Hb |
29,35 ± 0,94 |
33,11 ± 1,12 p1 < 0,01 |
20,77 ± 2,26 p2 < 0,001; p3 < 0,001 |
Примечания:
р1 - достоверность различий между группами 1 и 2;
р2 - достоверность различий между группами 1 и 3;
р3 - достоверность различий между группами 2 и 3.
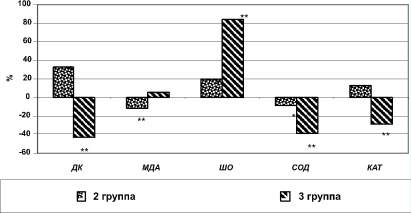
Рис. 2. Различия показателей свободнорадикального окисления и антиоксидантной системы эритроцитов пациентов 2-й и 3-й групп в сравнении с показателями здоровых лиц, %. Примечание: * - p < 0,01, ** - p < 0,001
Если некоторые звенья антиоксидантной защиты плазмы крови сохранили свое активное состояние, то в эритроцитах при гипертензивном кризе картина иная. Отмечается достоверное снижение активности и каталазы, и супероксиддисмутазы, которая превращает супероксид-анион в молекулу перекиси водорода. В эритроцитах пациентов 3-й группы содержание СОД и КАТ было снижено, по сравнению с показателями здоровых добровольцев на 40,1 и 29,2 % соответственно (p < 0,001 и p < 0,001 соответственно). У пациентов 2-й группы изменения активности антиоксидантных ферментов были не столь выражены и носили разнонаправленный характер: содержание СОД было снижено на 9,7 % (p < 0,01), а КАТ - повышено на 12,8 % (p < 0,01) (см. табл. 2, рис. 2).
Выводы
1. У пациентов с гипертензивными кризами наблюдаются более значимые нарушения в процессах свободнорадикального окисления и антиоксидантной защиты организма, чем у пациентов с гипертонической болезнью при отсутствии признаков криза.
2. Особенностью оксидативного стресса при гипертензивных кризах является высокое накопление продуктов ПОЛ на фоне снижения интенсивности генерации свободных радикалов кислорода.
3. При гипертензивных кризах имеется тенденция к повышению уровня нитрозилгемоглобина, тогда как при артериальной гипертензии вне криза этот показатель достоверно снижен.
4. В плазме крови пациентов с гипертензивными кризами выявлены разнонаправленные изменения активности антиоксидантных ферментов. На фоне достоверно сниженной активности каталазы у церулоплазмина наблюдается ее повышение.
5. В эритроцитах пациентов с гипертензивными кризами выявлено достоверное угнетение активности, как каталазы, так и супероксиддисмутазы.Рецензенты:
Чистяков В.А., д.б.н., старший научный сотрудник, заведующий лабораторией экспериментального мутагенеза НИИ биологии ЮФУ, г. Ростов-на-Дону;
Краюшкин С.И., д.м.н., профессор, заведующий кафедрой амбулаторной и скорой медицинской помощи Волгоградского государственного медицинского университета, г. Волгоград.
Работа поступила в редакцию 26.11.2012.
Библиографическая ссылка
Лось Е.Г., Тараканов А.В., Климова Л.В. ОСОБЕННОСТИ ОКСИДАТИВНОГО СТРЕССА ПРИ НЕОСЛОЖНЕННЫХ ГИПЕРТЕНЗИВНЫХ КРИЗАХ // Фундаментальные исследования. 2012. № 12-1. С. 91-95;URL: https://fundamental-research.ru/ru/article/view?id=30769 (дата обращения: 04.07.2025).



