Введение. Лейомиосаркома (ЛМС) тела матки является относительно редкой злокачественной опухолью тела матки, заболеваемость которой в США составляет 0,64 на 100000 населения [1]. По данным отечественных исследователей в РОНЦ им. Н.Н. Блохина, ежегодно регистрируется до 16 впервые выявленных больных злокачественной неоплазией данной локализации [2]. В Алтайском крае за период с 1996 по 2009 г. было выявлено 165 первичных больных ЛМС тела матки. До настоящего времени остается дискутабельным вопрос о критериях выживаемости больных ЛМС тела матки, а по данным различных авторов, 5-летняя выживаемость колеблется от 18,8 до 65 % [3, 4]. Достаточно известным фактом является влияние на выживаемость больных злокачественными опухолями многих (если не всех) локализаций пролиферативной активности опухолевых клеток, которую возможно определять целым рядом методик: подсчетом митотической активности, проточной плоидометрией и иммуногистохимическим определением уровня экспрессии белка Ki-67 [5, 6]. Однако золотым стандартом исследования пролиферативной активности опухоли считается количественный подсчет фракции клеток, синтезирующих ДНК (S-фракция) при помощи витальной инкорпорации опухоли радиоактивными изотопами (например ³Н-тимидин). Стоит сказать, что данный метод трудно воспроизводим в клинике из-за технических сложностей и радиоактивной опасности [7, 8]. Иммуногистохимический способ выявления клеток, синтезирующих ДНК при помощи бромдезоксиуридиновой (BrdU) метки, был введен относительно недавно. Harms G. и соавт., в 1986 г., а ранее Gratzner H.G. опубликовали данные о том, что методика относительно инкорпорации радиоактивными изотопами проста и надежна и абсолютно сопоставима с радиоактивным методом. Вместе с тем данных об иммуногистохимическом определении S-фракции опухолевых клеток по данным иммуногистохимического определения BrdU в ЛМС тела матки нет.
Общеизвестным фактом является то, что ЛМС тела матки практически нечувствительна ко многим известным химиотерапевтическим средствам [9, 10]. Вместе с тем достаточно известным фактом, влияющим на чувствительность опухолевых клеток к терапии, является экспрессия фермента - гиразы топоизомеразы IIα (TOPOIIα). Обобщая фундаментальные литературные данные, можно говорить, что функция ДНК topoisomerase II ‒ одна из ключевых в предупреждении спутывания двунитчатой ДНК во время таких процессов, как репликация, рекомбинация и транскрипция [11, 12]. Исследование активности белка с успехом применяется в практической онкологии для определения химиорезистентности опухоли, при определении риска развития метастазов, прогноза при колоректальном раке, раке молочной железы [13, 14]. Однако данных по определению активности фермента в гладкомышечных опухолях тела матки в литературе нет.
Исходя из вышеизложенного, целью данного исследования стало иммуногистохимическое определение уровня экспрессии фермента - гиразы Topoisomerase IIα и пролиферативной активности по данным активности бромдезоксиуридина при лейомиосаркоме в сопоставлении с неизмененным миометрием и доброкачественными гладкомышечными опухолями тела матки.
Материалы и методы
Материалом для работы служили удаленные матки от пациенток с клиникой быстрорастущей опухоли тела матки (боли, кровотечения, двукратное и более увеличение по данным УЗИ в течение года) за период 1996-2009 гг. в Алтайском крае. В случае ЛМС наиболее часто использовали экстирпацию матки с шейкой и придатками (86,4 %). В исследование вошли 66 случаев ЛМС тела матки у прооперированных больных с известным прогнозом. Средний возраст пациенток ЛМС составил 52,1 ± 1,3 (min. 23; max. 77; moda 50). Практически 80 % больных ЛМС были пре- и менопаузального возраста. Оставшаяся часть больных были репродуктивного возраста, прооперированы во вторую половину менструального цикла. Единичный опухолевый узел обнаруживали в 89,4 % случаев, более 1-го - в 10,6 %. Во всех случаях исследовали прилежащий неизмененный миометрий (НМ; не менее 1 см от опухоли). Степень злокачественности определяли по 3-степенной (G1-3) системе, предложенной французским противораковым центром (FNCLCC), коррелирующей с выживаемостью больных саркомами различных локализаций, включающих в себя дифференцировку, митотическую активность и массивность некрозов и имеющей выражение в балльной оценке совокупности этих критериев [15]. Стадия заболевания по классификации FIGO распределилась следующим образом: I - 65,2 % (43 случая), II - 34,8 % (23 случая). Случаев с III и IV стадией процесса в исследование не включили. Кроме того, для сопоставления в анализ включили 46 узлов лейомиом (ЛМ) от 18 больных (22 лейомиом простых, 24 лейомиомы клеточных с митотической активностью). Единичный опухолевый узел встречали всего в 29,5 % случаях ЛМ. Средний возраст больных ЛМ составил 47,5 ± 1,2 (min. 27; max. 61; moda 46). Кроме того, в исследование вошли 12 опухолей с неясным злокачественным потенциалом (STUMP). Единичный опухолевый узел был выявлен в половине случаев. Средний возраст больных STUMP составил 46,6 ± 2,1 (min. 34; max. 59; moda 43). Для патогистологического исследования использовали рутинные методики: гематоксилин и эозин, Ван-Гизон, железный гематоксилин по Гейнденгайну. Для иммуногистохимического анализа использовали антитела к BrdU, клон Bu20a «DAKO» в разведении не более 1:50, Для предобработки использовали раствор BrdU (Sigma B 5002,7 mglml saline; Sigma), который вводили в маточную артерию и инкубировали при температуре 37 °С 24 часа. Далее, вместо предобработки 2М HCL и последующим применением протеазы по Harms G. et al., 1986, мы использовали обработку в цитратном буфере с рН 6,0 в модификации Tang X. et al., 2007 [16] и Muskhelishvili L. et al., 2003 [17]. Для выявления экспрессии TOPOIIα использовали антитела клона Ki-S1 («DAKO») в разведении 1:150. Полученный результат для обоих маркеров оценивали полуколичественно в процентах. Использовалась система визуализации BioGenex Super Sensitive Polymer-HRP Detection System/DAB. Статистическую обработку проводили при помощи компьютерной программы STATISTICA 6.0.
Полученные результаты
Полученные данные показали, что окрашивание клеток BrdU имело свои особенности выпадения хромогена в кариоплазме в виде мелкогранулярных структур и таких же гранул в нуклеоле ядра, напоминающих ³Н-тимидиновую радиоизотопную метку. В НМ мы не находили клеток с положительной BrdU-меткой. Следует отметить, что в ряде работ по исследованию неизмененной ткани почки, щитовидной железы и печени уровень BrdU-метки не превысил 0,5 % в гепатоцитах и фолликулах [18, 19]. Уровень активности TOPOIIα был низок и не превысил 0,2 % ± 0,03 (таблица).
Активность TOPOIIα и степень BrdU-метки в гладкомышечных клетках НМ,
различных типов ЛМ, STUMP и ЛМС различной степени злокачественности
|
Объект исследования |
TOPOIIα |
BrdU |
|
|
НМ (n = 94) |
0,2 % ± 0,03 (min - 0,01: max - 0,4) |
- |
|
|
ЛМ простая (n = 22) |
0,3 % ± 0,1 (min - 0,1: max - 1,1) |
- |
|
|
ЛМ клеточная (n = 24) |
2,2 % ± 0,9* (min - 0,9: max - 4,4) |
0,3 % ± 0,08* (min - 0,1: max - 0,5) |
|
|
STUMP (n = 12) |
4,1 % ± 1,3 (min - 0,5: max - 16,5) |
0,5 % ± 0,1 (min - 0,3: max - 1,4) |
|
|
ЛМС |
G1 n = 30 |
11,6 % ± 4,1* (min - 0,5: max - 18) |
1,4 % ± 0,2 (min - 1: max - 2,5) |
|
G2 n = 17 |
16,5 % ± 3,3* (min - 9,4: max - 38,9) |
4,5 % ± 1,3* (min - 1,4: max - 12) |
|
|
G3 n = 19 |
42,4 % ± 8,7* (min - 8,7: max - 78) |
8,3 % ± 1,9* (min - 0,9: max - 28) |
|
Примечание: знаком * отмечены достоверные различия в данных при р < 0,05.
В простой ЛМ BrdU-метка отсутствовала, вероятно из-за отсутствия и/или крайне низкого числа клеток в S-фазе цикла, что соответственно говорит о низкой пролиферативной активности ЛМ. Уровень экспрессии TOPOIIα возрастал относительно НМ до 0,3 % ± 0,1, хотя отличия по отношению к НМ статистически недостоверны (р = 0,2; см. таблицу). Невысокий уровень активности белка логично отражает и низкую потребность в ферменте - гиразе, необходимом в процессах клеточного
деления.
В ЛМ клеточной количество клеток в S-фазе митотического цикла возрастало и составило 0,3 % ± 0,08 (см. таблицу). Активность TOPOIIα также значимо возрастало уже до 2,2 % ± 0,9 (см. таблицу). Увеличение активности белков, вероятно, соответствовала росту пролиферативной активности клеток ЛМ клеточной относительно простой ЛМ с более высокой потребностью в TOPOIIα для распутывания двунитчатой ДНК в процессе рекомбинации, репликации и транскрипции.
В STUMP уровень BrdU-метки возрастал до 0,5 % ± 0,1 (р = 0,002). Гранулы хромогена становились крупнее относительно ЛМ клеточной, около половины случаев были со смешанным нуклеолярно-кариоплазматическим характером распределения хромогена (см. таблицу; рис. 1). Уровень экспрессии белка TOPOIIα сопряженно возрастал до 4,1 % ± 1,3 (р = 0,01; рис. 4). Увеличение активности фермента, с одной стороны, отражает увеличение количества пулов клеток с делением ДНК, а с другой, косвенно может отражать нарастающие критические изменения генома, требующие все большей экспрессии для распутывания нити ДНК, в том числе и репликации ДНК в клетках с уже критическим накоплением мутаций.
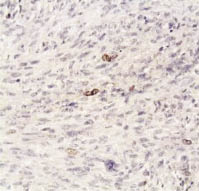
Рис. 1. Бромдезоксиуридиновая метка в клетках гладкомышечной опухоли
с неясным злокачественным потенциалом, не превышающая 1,9 %.
Иммуногистохимический метод, хромоген DAB; х400
В ЛМС без учета степени злокачественности уровень экспрессии BrdU экспоненциально возрастал и составил 4,4 % ± 0,06, статистический эксцесс 0,9 (min 0,1 %; max 28 %). При низкой степени злокачественности саркомы степень экспрессии BrdU была 1,4 % ± 0,2, при G2 - 4,5 % ± 1,3, а при G3 мы находили наибольшую степень экспрессии, составляющую 8,3 % ± 1,9 (см. таблицу; рис. 2, 3).
Специфика окраски DAB-хромогеном приобретала глыбчатый, в подавляющем большинстве, нуклеолярно-кариоплазматический характер распределения с невыраженным фоном. Увеличение числа клеток, находящихся в S-фазе митотического цикла, отражает рост пролиферативной активности по мере увеличения степени злокачественности ЛМС.
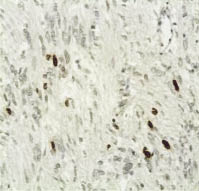
Рис. 2. Бромдезоксиуридиновая метка
в клетках лейомиосаркомы низкой
степени злокачественности (G1),
составляющая 6,1 %.
Иммуногистохимический метод,
хромоген DAB; х400
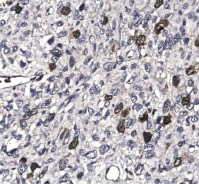
Рис. 3. Интенсивная
бромдезоксиуридиновая метка в клетках лейомиосаркомы высокой степени
злокачественности (G3), составляющая 17,4 %. Иммуногистохимический
метод, хромоген DAB; х400
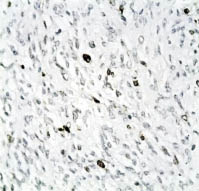
Рис. 4. Активность TOPOIIα в клетках гладкомышечной опухоли
с неясным злокачественным потенциалом ‒ не превышает 5 %.
Иммуногистохимический метод, хромоген DAB; х400
Характерно, что уровень экспрессии TOPOIIα клеток ЛМС также экспоненциально возрастал по мере увеличения степени злокачественности опухоли. Так, в случае G1 уровень экспрессии белка был 11,6 % ± 4,3, а при ЛМС G3 уровень экспрессии возрастал до 42,4 % ± 8,7 (p = 0,0003; см. таблицу; рис. 5, 6).
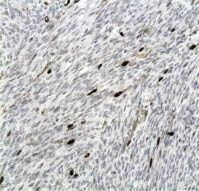
Рис. 5. Увеличение активности TOPOIIα
в клетках лейомиосаркомы низкой степени злокачественности (G1) до 10,7 %.
Иммуногистохимический метод,
хромоген DAB; х200
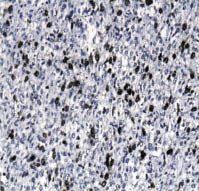
Рис. 6. Гиперэкспрессия TOPOIIα в клетках лейомиосаркомы высокой степени
злокачественности (G3) до 42,4 %.
Иммуногистохимический метод,
хромоген DAB; х200
Возможно, что при увеличении опухолевой анаплазии (и соответственно злокачественности) возникает множество топологических затруднений при репликации и транскрипции ДНК (возможно мутированной), требующих все большей активности фермента для продолжения процессов клеточного деления.
Выводы
Таким образом, полученные данные позволяют говорить, что в гладких мышцах НМ и простых ЛМ клетки, находящиеся в S-фазе либо отсутствуют совсем, либо их количество крайне низко и не обнаруживается при помощи иммуногистохимического метода. Вместе с тем активность фермента - гиразы TOPOIIα ‒ обнаруживалась на относительно низком уровне, что вероятно обусловлено практически полным отсутствием процессов репликации, рекомбинации, где активность белка наиболее выражена. В ЛМ клеточной и STUMP мы находили экспоненциальный рост количества клеток в S-фазе цикла с увеличением активности TOPOIIα. Наибольшее количество синтезирующих ДНК клеток с гиперактивностью фермента TOPOIIα мы находили в ЛМС, причем по мере увеличения степени злокачественности отмечали и рост метки изучаемых маркеров. Таким образом, мы отмечали практически экспоненциальный рост экспрессии BrdU и TOPOIIα в цепочке от НМ, ЛМ простой и клеточной до ЛМС различной степени злокачественности, и соответственно, увеличения клеток в S-фазе цикла, пролиферативной активности с нарастанием спутываний нити ДНК, требующих большей активности фермента TOPOIIα. Обобщая полученные данные, можно говорить, что использование иммуногистохимического способа оценки числа S-фракции клеток в гладких мышцах НМ, простой ЛМ, STUMP и ЛМС тела матки при помощи анти-бромдезоксиуридиновых антител может служить относительно простым и надежным способом для дифференциальной диагностики доброкачественных и злокачественных гладкомышечных опухолей тела матки и войти в «золотой стандарт» определения пролиферативной активности в качестве альтернативы радиоизотопному методу ³Н-тимидиновой метки. Определение активности фермента TOPOIIα может быть использовано для определения степени химиорезистентности опухоли в комплексном лечении больных ЛМС тела матки.
Список литературы
- Harlow B.L., Weiss N.S., Lofton S. The epidemiology of sarcomas of the uterus // J. nat. Canc. Inst. - 1986. - Vol. 76, №3. - P. 399-402.
- Лазарева Н.И., Кузнецов В.В., Захарова Т.И. Клиническая онкогинекология // Руководство для врачей // под ред. В.П. Козаченко. - М.: Медицина, 2005. - С. 178-220.
- Predictive value of grade for metastasis development in the main histologic types of adult soft tissue sarcomas / J. Coindre, P. Terrier, L. Guillou, V. Doussal, F. Collin, D. Ranchere, X. Sastre, M. Vilain, F. Bonichon, B. Bui // Cancer. - 2001. - Vol. 19, № 10. - P. 1914-1926.
- Uterine sarcoma: twenty-seven years of experience / L. Livi, F. Paiar, N. Shah, P. Blake, A. Villanucci, G. Amunni, R. Barca, I. Judson, N. Lodge, E. Meldolesi, G. Simontacchi, G. Piperno, A. Galardi, S. Scoccianti, G.P. Biti, C. Harmer // Int. J. Radiat. Oncol. Biol. Phys. - 2003. - Vol. 57, №5. - P. 1366-1373.
- Факторы прогноза и тактика лечения больных лейомиосаркомой матки / И.Р. Гагуа, В.В. Кузнецов, Н.И. Лазарева, В.М. Нечушкина, Т.И. Захарова, Ж.А. Завольская // Вестник РОНЦ им. Н.Н. Блохина РАМН. - 2007. - Т. 18, № 3. - С. 23-31.
- The prognostic significance of stage, tumor size, cellular atypia and DNA ploidy in uterine leiomyosarcoma / R.R. Nordal, G.B. Kristinsen, J. Kaern, A.E. Stenwig, E.O. Pettersen, C.G. Trope // Acta oncol. - 1995. - Vol. 34. - P. 797-802.
- Gratzner H.G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication // Science. - 1982. - Vol. 218. - Issue 4571. - P. 474-475.
- Harms G., van Goor H., Koudstaal J., de Ley L., Hardonk M.J. / Immunohistochemical demonstration of DNA-incorporated 5-bromodeoxyuridine in frozen and plastic embedded sections // Histochemistry. - 1986. - Vol.85, №2 - Р. 139-143.
- Harry V.N., Narayansingh G.V., Parkin D.E. Uterine leiomyosarcomas: a review of the diagnostic and therapeutic pitfalls // Obstet. and. Gynecol. - 2007. - №9. - Р.88-94.
- Phase II study of mitomycin, doxorubicin, and cisplatin in the treatment of advanced uterine leiomyosarcoma: a Gynecologic Oncology Group study / J.H. Edmonson, J.A. Blessing, J.A. Cosin, D.S. Miller, D.E. Cohn, J. Rotmensch // Gynecol. Oncolog. - 2002. - Vol.85. - P. 507-510.
- Osheroff N., Bjornsti M. DNA Topoisomerase Protocols. Volume II: Enzymology and Drugs. - Springer, 2001. - Р. 352.
- RNAi analysis reveals an unexpected role for topoisomerase II in chromosome arm congression to a metaphase plate / C. Chang, S. Goulding, W. Ernshawn, M. Carmena // J. Cell. Scien. - 2003. - Vol. 116 - P. 4715-4726.
- Jarvinen T.H., Tanner M., Rantanen V., Barlund M., Borg A. Amplification and deletion of topoisomerase IIa associate with ErfB-2 amplification and affect sensitivity to topoisomerase II inhibitor doxorubicin in breast cancer // Am. J. Pathol. - 2000. - Vol. 156. - P. 839-847.
- Murphy K.J., Nielson K.R., Albertine K.H. Defining a Molecularly Normal Colon // Histochem. Cytochem. - 2001. - Vol.49, №5. - P. 667-668.
- Fédération Nationale des Centres de Lutte contre le Cancer. Standards, Options, et Recommandations. Sarcomes des Tissus Mous et Ostéosarcomes, - Vol. 1, 1-st edition. Paris: Arnette Blackwell, 1995. - P. 6-113.
- Antigen-Retrieval Procedure for Bromodeoxyuridine Immunolabeling with Concurrent Labeling of Nuclear DNA and Antigens Damaged by HCl Pretreatment / X. Tang, L. Fal. Douglas,
X. Li, T. Lane, M.B. Luskin // J. of Neuroscience. - 2007. - Vol. 27, №22. - Р. 5837-5844. - Muskhelishvili L., Latendresse J.R., Kodell R.L., Henderson E.B. / Evaluation of Cell Proliferation in Rat Tissues with BrdU, PCNA, Ki-67(MIB-5) Immunohistochemistry and In Situ Hybridization for Histone mRNA // J. Histochem. Cytochem. - 2003. - Vol.51, №12. - Р. 1681-1688.
- Influence of hemithyroidectomy on bromodeoxyuridine incorporation into DNA of rat thyroid follicular cells / A. Gesing, M. Karbovnik, E. Sewerinek, J. Jagiela, A. Lewinski // Endocr. regul. - 2001. - Vol. 35. - P. 25-30.
- Quantitative fluorescence imaging approach for the study of polyploidization in hepatocytes / E. Lamas, D. Chassoux, J. Decaux, C. Brechot, P. Debey // J. histochem. and cytochem. - 2003. - Vol. 51, №3. - P. 319-330.
Рецензенты:
Талалаев Сергей Владимирович, д.м.н., профессор, зав. кафедрой гистологии ГОУ ВПО «Алтайский государственный медицинский университет», Барнаул;
Лепилов Александр Васильевич, д.м.н., профессор кафедры патологической анатомии с секционным курсом. ГОУ ВПО «Алтайский государственный медицинский университет», Барнаул.
Библиографическая ссылка
Авдалян А.М., Бобров И.П., Климачев В.В., Круглова Н.М., Лазарев А.Ф. ГИРАЗНАЯ АКТИВНОСТЬ (ПО УРОВНЮ TOPOISOMERASE IIΑ) И КОЛИЧЕСТВО КЛЕТОК В S-ФАЗЕ КЛЕТОЧНОГО ЦИКЛА (ПО ДАННЫМ БРОМДЕЗОКСИУРИДИНОВОЙ (BRDU) МЕТКИ) В ЛЕЙОМИОСАРКОМЕ ТЕЛА МАТКИ // Фундаментальные исследования. 2011. № 3. С. 28-35;URL: https://fundamental-research.ru/ru/article/view?id=21114 (дата обращения: 06.07.2025).



