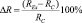Актуальность исследования механизмов действия слабых магнитных полей на живые организмы определяется ежегодным ростом количества публикаций, однако физическая природа этих механизмов до настоящего времени является причиной многочисленных дискуссий [35, 32, 34, 29]. Причиной дискуссий и основным недостатком большинства обзоров по влиянию слабых МП на живые системы является совмещение множества противоречивых фактов и малого числа успешных повторных независимых исследований. Причины этого явления могут крыться в отсутствии чёткого биофизического механизма взаимодействия электромагнитного поля с живым организмом [35, 32]. Действительно, для однозначного описания взаимодействия живого организма с электромагнитным полем необходимо использовать как физические, так и биологические параметры. Обычно физиологические параметры живой системы меняются за время эксперимента даже в отсутствии какого-либо воздействия. На молекулярном уровне изменение физиологического состояния живой системы связано с изменением ферментативной активности. Это означает, что в каждый момент времени электромагнитное поле взаимодействует с разными ферментами. Этот, казалось бы, очевидный факт не учитывается, в частности, в популярных моделях циклотронного или параметрического резонанса [42, 31], в которых предполагалось, что слабые КМП действуют на ионы Ca2+, K+, Na+, Mg2+, находящиеся в центрах связывания некоторых управляющих белков, таких как протеинкиназа С, кальмодулин и других. Квантовомеханический подход предполагает нелинейную зависимость вероятности конформационного отклика фермента, т.е. изменение скорости ферментативной реакции, от плотности вероятности волновой функции иона. Привлечение теории интерференции угловых ионно-молекулярных состояний [26, 13, 8] только придало некоторую физическую строгость уже полученным экспериментальным результатам, однако не решило проблему плохой воспроизводимости экспериментальных результатов. Для создания биофизической модели необходимо учитывать и роль геомагнитного поля, т.к. в моделях циклотронного – параметрического резонанса [33, 42, 31] частота электромагнитного поля пропорциональна его амплитуде, а в сверхслабом магнитном поле зависимость частоты от амплитуды становится неопределённой.
Целью работы было сравнение влияния слабого комбинированного магнитного поля КМП, настроенного на циклотронную частоту иона Са2+ (Са-КМП), и минимально возможных статических магнитных полей («магнитного вакуума») на процесс регенерации планарий. В качестве эндогенного фактора в нашей работе рассматривалось физиологическое состояние, пожалуй, самого популярного в магнитобиологии объекта – регенерирующей планарии Girardia tigrina. Ниже будет показано, что чувствительность планарии существенно менялась в процессе регенерации как к действию слабого Са-КМП, так и к действию «магнитного вакуума». Более того, эффекты Са-КМП и «магнитного вакуума» имели много общего. Одним из объяснений полученных экспериментальных зависимостей может быть значительное изменение физиологического состояния планарии в процессе регенерации. Эндогенным фактором, оказывающим существенное влияние на процессы влияния магнитного поля на живой объект, может быть множественность ферментативных мишеней для слабых магнитных полей, активирующихся и чередующихся в разные фазы процесса регенерации.
Материалы и методы исследования
В экспериментах применялась бесполая раса пресноводных червей – планарий Dugesia (Girardia) tigrina. Планарий кормили раз в неделю личинками двукрылых. Для экспериментов отбирали животных длиной около 10–11 мм после недельного голодания. Регенерация вызывалась ампутацией головной части тела планарий (декапитацией) и происходила в пластиковых чашках Петри d = 40 мм, содержащих 13 мл аквариумной воды при dH ≈ 10 градусов, рH ≈ 6,5. В каждой чашке находилось по 30 особей. Всего было использовано порядка 1800 планарий. В контроле, как до, так и после декапитации планарии содержались в термостатируемом помещении при температуре 26 ± 0,5 °С, в постоянном электромагнитном поле с напряжённостью BDC = 50∙10–6 Тл, моделирующем естественное геомагнитное поле. Для количественной оценки результата регенерации использовали метод прижизненной компьютерной морфометрии [19], который базируется на регистрации фотоконтраста между старыми и новыми частями тела регенерирующей планарии. Для получения изображений планарий применяли бинокулярный микроскоп Stemi 2000-C, оснащенный цифровой видеокамерой AxioCam MRc (фирма «Zeiss»). Площади проекции вновь образовавшейся бластемы s и регенерирующего фрагмента S определяли с помощью специального пакета программ Plana 5.0, анализирующего файлы с оцифрованными изображениями планарий. Коэффициент регенерации R = s/S определяли для каждой группы планарий через 72 часа после ампутации. Выбор времени регистрации определялся тем фактом, что при 26 °С в течение трёх суток в остаточных тканях планарии-регенеранта проходят две волны пролиферации необластов и заканчивается формирование основного клеточного пула бластемы [23]. В то же время бластема ещё не потеряла прозрачность, что позволяет надежно определить границу старых и новых частей тела планарии.
Биологический эффект слабых КМП мы рассчитывали как разность коэффициентов регенерации в опытных REx и контрольных RC группах через 72 часа после декапитации: 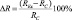 [19]. В каждой серии экспериментов использовали не менее 30 особей. В контроле, как до, так и после декапитации, планарии содержались в постоянном магнитном поле с напряжённостью BD = 50 мкТл. Слабые статические магнитные поля создавались внутри 3 различных пермалоидных камер. Ослабление геомагнитного поля в каждой камере оценивали по ослаблению электромагнитного поля на частоте f = 50 Гц. Напряжение на излучающем соленоиде устанавливалось от лабораторного автотрансформатора, а регистрирующая катушка подсоединялась ко входу осциллографа. Значения коэффициентов ослабления в каждой камере приведены в таблице. «Магнитный вакуум» создавался компенсацией естественного магнитного поля Земли внутри катушки Гельмгольца, с последующим ослаблением постоянной и переменной компонент посредством помещения сосуда с планариями в центр вкладывающихся друг в друга 3-х пермаллоевых камер. Напряжённость постоянной компоненты может быть оценена величиной BDC ≤ 10–11 Тл, амплитуда переменной составляющей – BAC ≤ 10–14 Тл. В работе использовалось слабое КМП, параметры которого рассчитывались на основе классической модели циклотронного резонанса Либова – Леднева [33]. Слабое Са-КМП создавалось внутри катушки Гельмгольца: частота 38 Гц, напряжённость постоянной компоненты BDC = 50 мкТл, напряжённость переменной составляющей BAC = 92 мкТл. Соотношение амплитуд BAC/BDC = 1,84.
[19]. В каждой серии экспериментов использовали не менее 30 особей. В контроле, как до, так и после декапитации, планарии содержались в постоянном магнитном поле с напряжённостью BD = 50 мкТл. Слабые статические магнитные поля создавались внутри 3 различных пермалоидных камер. Ослабление геомагнитного поля в каждой камере оценивали по ослаблению электромагнитного поля на частоте f = 50 Гц. Напряжение на излучающем соленоиде устанавливалось от лабораторного автотрансформатора, а регистрирующая катушка подсоединялась ко входу осциллографа. Значения коэффициентов ослабления в каждой камере приведены в таблице. «Магнитный вакуум» создавался компенсацией естественного магнитного поля Земли внутри катушки Гельмгольца, с последующим ослаблением постоянной и переменной компонент посредством помещения сосуда с планариями в центр вкладывающихся друг в друга 3-х пермаллоевых камер. Напряжённость постоянной компоненты может быть оценена величиной BDC ≤ 10–11 Тл, амплитуда переменной составляющей – BAC ≤ 10–14 Тл. В работе использовалось слабое КМП, параметры которого рассчитывались на основе классической модели циклотронного резонанса Либова – Леднева [33]. Слабое Са-КМП создавалось внутри катушки Гельмгольца: частота 38 Гц, напряжённость постоянной компоненты BDC = 50 мкТл, напряжённость переменной составляющей BAC = 92 мкТл. Соотношение амплитуд BAC/BDC = 1,84.
Результаты исследования и их обсуждение
В первой серии экспериментов, после отсечения у планарий головной части, животных помещали в 3 разные пермаллоевые камеры на 72 часа. Камеры в разной степени ослабляли геомагнитное поле. Коэффициенты ослабления камер и значения статического магнитного поля в каждой камере, а также значения биологического эффекта, регистрируемого через 72 часа после декапитации, указаны в таблице.
Варианты экранировки геомагнитного поля и значения биологического эффекта, регистрируемого через 72 часа после декапитации
|
Варианты экранировки геомагнитного поля |
Коэффициенты ослабления на частоте 50 Гц |
Значение магнитной индукции ВDC, мкТл |
Биологический эффект
|
|
Фон |
1 |
50 |
0 ± 2 |
|
Камера 1 |
136 |
0,37 |
–1 ± 5 |
|
Камера 2 |
13,3 |
3,8 |
–3 ± 5 |
|
Камера 3 |
5,5 |
9,1 |
3 ± 5 |
|
«Магнитный вакуум» |
136∙5,5∙13,3 = 9948,4 |
0,00005 |
13 ± 5 |
Из таблицы следует, что экранировка геомагнитного поля более чем в 100 раз (камеры 1–3) практически не влияла на регенерацию планарий. Однако ослабление геомагнитного поля почти в 10 000 раз («магнитный вакуум») вызывало достоверное увеличение биологического эффекта.
В дальнейших экспериментах, сразу после отсечения головной части, планарий помещали в условия «магнитного вакуума» или в слабое Са-КМП, на разное время от 0,5 до 72 часов. Площади проекции бластемы и всего регенерирующего фрагмента регистрировали через 72 часа после декапитации. Результаты экспериментов представлены на рис. 1.
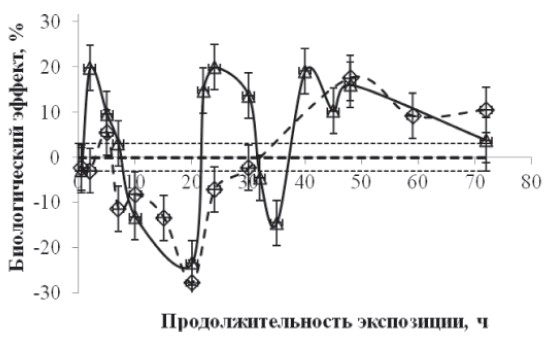
Рис. 1. Зависимость биологического эффекта от продолжительности непрерывной экспозиции в слабом Са-КМП (треугольники) и в условиях «магнитного вакуума» (ромбики). По горизонтали – продолжительность экспозиции, час, по вертикали – биологический эффект ΔR. Значению коэффициента регенерации RC при BDC = 50∙10–6 Тл соответствует нулевая линия, а величина стандартного отклонения обозначена пунктирными линиями
Результаты экспериментов свидетельствуют о том, что стимулирующие эффекты Са-КМП наблюдали при 2-часовой экспозиции (20 %), второй пик приходился на экспозицию длительностью 25 часов (20 %) и третий пик – при 40-часовой экспозиции (20 %). Тормозящий биологический эффект Са-КМП наблюдали при 20-часовой (–25 %) и 35-часовой (–18 %) экспозициях. Cтимулирующие эффекты «магнитного вакуума» наблюдали при 5-часовой экспозиции (7 %), второй пик приходился на экспозицию длительностью 50 часов (18 %), а тормозящий биологический эффект наблюдали при 20-часовой (–27 %) экспозиции. Отметим, что биологический эффект, регистрируемый через 72 часа после декапитации, как при экспозициях в условиях «магнитного вакуума», так и в Са-КМП, имел фазный характер, а при длительностях экспозиции 10–20 часов как Са-КМП, так и «магнитный вакуум» приводили к торможению процесса регенерации.
В очередной серии экспериментов исследовали зависимость биологического эффекта от времени между декапитацией и началом получасовой экспозиции в Са-КМП или в «магнитном вакууме». Планарий помещали через разные промежутки времени от 0 до 72 часов после отсечения головной части на 30 минут в «магнитный вакуум» или в слабое Са-КМП. Площади проекции бластемы и всего регенерирующего фрагмента регистрировали через 72 часа после декапитации. Результаты экспериментов представлены на рис. 2.
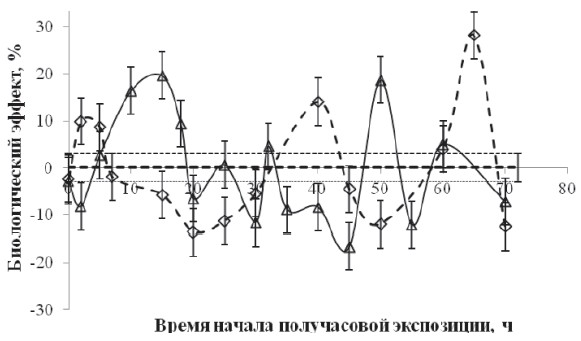
Рис. 2. Зависимость биологического эффекта от времени между декапитацией и началом получасовой экспозиции в слабом Са-КМП (треугольники) и в условиях «магнитного вакуума» (ромбики). По горизонтали – продолжительность экспозиции, час, по вертикали – биологический эффект ΔR.
Значению коэффициента регенерации RC при BDC = 50∙10–6 Тл соответствует нулевая линия, а величина стандартного отклонения обозначена пунктирными линиями
Стимулирующие эффекты Са-КМП наблюдали через 15 часов (20 %) и через 50 часов (20 %) после декапитации. Тормозящий биологический эффект Са-КМП наблюдался через 2 часа (–7 %) и через 45 часов (–18 %) после декапитации. Стимулирующие эффекты «магнитного вакуума» наблюдали через 3–5 часов (10 %), через 40 часов (15 %) и через 65 часов (25 %) после декапитации. Тормозящий биологический эффект наблюдали через 20 часов (–15 %) и через 50 часов (–10 %) после декапитации. Обращает на себя внимание тот факт, что зависимости биологического эффекта 30-минутной экспозиции, как в условиях «магнитного вакуума», так и в Са-КМП, от времени после декапитации имели фазный характер, причём в ряде случаев активации регенерации «магнитным вакуумом» соответствовало торможение регенерации слабым Са-КМП.
Наши эксперименты выявили высокую чувствительность процесса регенерации планарий к очень слабым статическим магнитным полям ВDC ≈ 0,05нТл, однако при 0,37 < ВDC < 9,1 мкТл достоверного отличия биологического эффекта от фона обнаружить не удалось (таблица). Ранее было показано увеличение митотического индекса при значениях ВDC ≤ 0,2 мкТл [12] а при ВDC ≈ 0,8 – 1,5 мкТл и при ВDC ≈ 0,005–0,3 мкТл на тех же планариях Girardia tigrina было зарегистрировано увеличение числа разделившихся особей [17]. Максимальный эффект стимуляции возникал при ВDC ≈ 0,1 мкТл [16.].
При значениях статического магнитного поля 0,1 < ВDC < 20 мкТл на различных культивируемых клетках регистрировался весь спектр ответов, включая как стимуляцию, так и торможение пролиферации, дифференцировки или апоптоза [31, 29, 24, 10, 42, 25]. Отметим, что только в одной работе [42] авторы обратили внимание на тот факт, что гипомагнитное поле (BDC < 0,2 мкTл) стимулировало пролиферацию клеток при экспозиции в G1-фазе клеточного цикла. В других фазах цикла клетки не проявили чувствительность к магнитному экранированию.
Результаты, представленные на рис. 1, свидетельствуют о том, что исследуемые слабые магнитные поля, как статические, так и Са-КМП, могли не только стимулировать, но и тормозить регенерацию, а при определённых временах экспозиции вообще не влиять на процесс регенерации. Аналогичную картину можно видеть на рис. 2. Это означает, что понятия «стимулирующее поле» или «тормозящее поле» не могут использоваться для характеристики слабого электромагнитного поля. Для объяснения изменения чувствительности регенерирующей планарии к слабым магнитным полям можно предположить, что в разных фазах регенерации мишенями для слабых статических магнитных полей (ВDC ≈ 0,05 нТл) или для слабых комбинированных полей (BDC ≈ 50 мкТл, BAC ≈ 92 мкТл, fn ≈ 38 Гц) могут быть разные ферменты. Действительно, фазный характер величины биологического эффекта при 30-минутной экспозиции от времени после декапитации (рис. 2), как для «магнитного вакуума», так и для слабых Са-КМП, связан, по-видимому, с клеточным циклом стволовых клеток. В пользу этого предположения свидетельствуют кривые количества стволовых клеток, находящихся в фазе митоза у планарий Schmidtea мediterranea после декапитации [38]. Пики митоза возникали через ≈ 6 часов и ≈ 40 часов после удаления головного конца, что хорошо соответствует нашим результатам (рис. 2): как через 6 часов, так и через 40 часов после операции «магнитный вакуум» стимулировал регенерацию, а Са-КМП – тормозило.
Ещё одним доказательством связи чувствительности к слабым магнитным полям с конкретными фазами процесса регенерации планарии является тот факт, что значение биологического эффекта Са-КМП (рис. 1) при непрерывной экспозиции в течение 72 часов практически не отличалось от контроля, а в ранних экспериментах величина эффекта достигала 30 % [19]. Это «противоречие» легко объясняется тем, что фаза регенерации, определяемая по величине площади проекции бластемы (или по величине коэффициента регенерации) через 72 часа при 21 °С, при температуре 26 °С достигалась уже через 48–50 часов. Этот результат свидетельствует о детерминированности процесса регенерации планарий и о связи чувствительности к слабым магнитным полям с конкретными фазами процесса регенерации.
Однако по представлениям большинства исследователей [8, 20, 30, 6, 18] слабые КМП делятся на активирующие и тормозящие для конкретного биологического процесса. При этом предполагается, что не только Са-КМП, но К-КМП, Mg-КМП, Na-КМП и Li-КМП влияют на конкретные ферменты: на протеинкиназу С у регенерирующих планарий [12], на Са2+ -кальмодулин-зависимую киназу в гравитропической реакции растений [7, 6], или на ферменты, обладающие «реакционным комплексом», осуществляющим «образование пероксирадикалов в биологических системах» [16].
Наличие множества ферментативных мишеней для слабых КМП и «магнитного вакуума» в условиях регуляции ферментативной активности неорганическими ионами позволило бы объяснить результаты многих экспериментов, поставленных в разных лабораториях и на разных объектах. Действительно, многими исследователями показана чувствительность биологических систем к КМП, настроенным на циклотронную частоту наиболее часто встречающихся в живых системах ионов Ca2+, К+, Na+, Mg2+ и Н+ [12, 41, 5], а также на ядерный спин некоторых элементов, в частности 1Н+, 39К, 23Na, 31P, 64Cu, 55Mn, 59Co, 35Cl, 7Li, 14N [5]. Если слабые КМП могут влиять на вероятности взаимодействия определённых ионов (Са2+, Mg2+, Cu2+, Mn2+, K+, Na+, H+, Li+) с соответствующими центрами связывания множества конкретных белков [12, 41, 5], то «магнитный вакуум» не может обладать селективностью влияния на ферменты. Мишенью для «магнитного вакуума», а также для слабых КМП, настроенных на ядерные спины элементов, составляющих каркас белка, таких как 31P, 14N [5], должны быть все белки, без исключения.
Активация ферментов катионами широко распространена в растительном и в животном мире. Комплексообразование с металлами является эффективным регулятором ферментативного катализа и стабильности структуры макромолекул. Регуляция функциональной активности через комплексообразование с ионами металлов играет ключевую роль во многих ферментативных реакциях. Более одной трети известных белков являются металлопротеинами [27, 28]. Большинство белков ассоциируется с двухвалентными металлами: Fe2+ участвует в окислительно-восстановительных циклах, Zn2+ – в каталитических реакциях, Ca2+ определяет стабильность структуры ферментов и играет ключевую роль в системе внутриклеточной сигнализации [21]. Для функционирования биологических макромолекул необходимы не только двухвалентные (Са2+, Mg2+, Zn2+) и поливалентные металлы типа железа (Fe), но и одновалентные ионы группы IА: Na+ и К+ [39]. Образование комплекса с ионом металла является ключевым процессом при формировании структуры белка и реализации ферментативной функции. Кроме двухвалентных (Са2+, Mg2+, Zn2+) и поливалентных ионов, таких как Fe, комплексы с ферментами образуют одновалентные катионы Na+ и К+. Эти ионы изменяют ферментативную активность в качестве кофактора или аллостерического эффектора. Получены выражения скорости ферментативных реакций, в том числе активности ионных переносчиков, от концентраций ионов Na+ и К+, [39]. Такие ферменты, как киназы и молекулярные шапероны, активируются ионами K+ , но не активируются вообще или активируются слабо катионами Cs+, Na+ или Li+. Ферменты, активируемые ионами Na+, такие как β-галактозидазы и протеазы свертывания крови, не активируются ионами Li+ или более крупными катионами K+, Rb+, и Cs+. Эффекты ионов Na+ или К+ для всех исследованных ферментов разнонаправлены [40]. Селективность ионных центров связывания ферментов удивительно напоминает селективность ионных каналов [39].
Моделирование связи ферментативной активности с ионно-осмотическим гомеостазом
Известно, что синтезы основных клеточных компонентов, таких как ДНК, РНК, липиды и белки, а также активация различных циклинов происходят в разные фазы клеточного цикла [9]. Ранее на простейшей модели ионно-осмотического гомеостаза, учитывающей потоки глюкозы и аминокислот через плазматическую мембрану животной клетки, была показана корреляция синтетических процессов в клетке и потоков неорганических ионов [2]. Это означает, что активация ферментов, ответственных за синтезы ДНК, РНК, липидов и белков, происходит при различных, но вполне определённых внутриклеточных концентрациях ионов Na+ и K+. Современные представления о ферментах, как о надмолекулярных структурах, имеющих центры связывания не только для субстратов, но и для различных неорганических ионов [39], не только не противоречат модели ионно-осмотического гомеостаза [2], но и открывают новые подходы к моделированию ферментативной активности.
Для большинства белков, структура и ферментативная активность которых, в той или иной степени, зависит от локальной концентрации неорганических ионов [39], можно по аналогии с мембранными транспортными белками написать в общем виде выражение для скорости любой ферментативной реакции. Действительно, ранее уже успешно применялась модель функционирования Na-K-АТФ-азы, предполагающая совершение конформационного преобразования, связанного с переносом 3 ионов Na+ наружу и 2 ионов K+ внутрь клетки при одновременном заполнении всех центров связывания ионов и центра связывания АТР [22].
Отметим, что вероятность «правильного» заполнения конкретного центра связывания иона зависит от внутриклеточных концентраций не только конкретного иона, но и иона, находящегося с ним в конкурентных отношениях. Для ряда ферментов достаточно хорошо изучены конкурентные отношения за центры связывания между ионами Na+ и K+, Са2+ и Mg2+ [39]. В общем случае скорость ферментативной реакции определяется произведением вероятностей заполнения всех n центров фермента для органического субстрата и неорганических ионов:
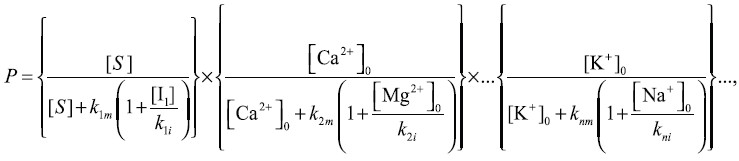
где [S] – концентрация органического субстрата; [Ca2+]0 и [K+]0 – внутриклеточные концентрации ионов, [I1], [Mg2+]0, [Na+]0 – внутриклеточные концентрации ингибиторов, kmi и kii – кажущиеся константы диссоциации активатора и ингибитора для конкретного центра связывания. В рамках предложенной модели активность фермента зависит не только от наличия субстрата, но и от внутриклеточных концентраций многих ионов. Роль ионно-осмотического гомеостаза заключается в поддержании внутриклеточных концентраций ионов на соответствующем уровне, что позволяет производить тонкую регуляцию переключения различных ферментативных систем, в частности в процессе клеточного цикла. Ранее было показано, что изменения ионного состава внеклеточной среды или концентрации субстратов влияли на дифференцировку и продолжительность жизни клеток нейробластомы мыши. Более того, были выявлены концентрации ионов Na+ и значения рН, при которых время дифференцировки клеток нейробластомы имело максимум [4]. Важность ионной регуляции пролиферации хорошо проявляется в экспериментах на монослойных колониях культивируемых клеток, связанных проницаемыми контактами. Отдельные пролиферирующие клетки, а также клетки на краях колонии обладают мембранным потенциалом около 40 мВ, а клетки в центре колонии деполяризованы до уровня 20 мВ по причине низкой активности ионного насоса [3]. Ионные насосы краевых клеток обеспечивают поддержание ионно-осмотического гомеостаза у всех клеток посредством ионных потоков через проницаемые контакты. По мере роста колонии количество деполяризованных клеток увеличивается как площадь круга, а количество гиперполяризованных клеток в краевой зоне увеличивается как длина окружности. Экспериментально и теоретически показано, что удельная скорость роста всех колоний электрически связанных клеток падает. Остановка пролиферации, регистрируемая по остановке роста колонии, происходит после деполяризации клеток краевой зоны до критического уровня, определяемого как потоками субстратов, так и внутриклеточными концентрациями неорганических ионов [1, 2].
В рамках этих представлений слабые КМП, настроенные на параметрический резонанс для различных ионов меняют константу связывания для конкретного иона с соответствующим центром. Каждый фермент обладает многими центрами связывания для различных субстратов и лигандов, включая ионы. Отметим, что центр связывания для конкретного иона, например Са2+ , может ингибироваться другими ионами, в частности К+, Na+ или Mg++ и H+, но акт возможен только в случае связи центра с ионом Са2+ . Органические субстраты и ионы при этом одинаково влияют на вероятность правильного заполнения всех связывающих центров фермента, вероятность, определяющую в итоге скорость ферментативной реакции. Очевидно, что слабые КМП, изменяющие константы связывания для неорганических ионов, будут влиять только на ферменты, насыщенные другими субстратами. Если скорость ферментативной реакции низка, то действие слабых КМП на этот конкретный фермент не может дать видимого эффекта. Влияние слабых КМП, настроенных на параметрический резонанс для конкретного иона, на фермент, обладающий высокой активностью, может провоцировать как стимуляцию, так и угнетение физиологического ответа на уровне клетки или организма.
Таким образом, избирательность воздействия слабых КМП, настроенных на циклотронную частоту неорганических ионов или их ядер (Na+, Н+, K+, Са2+, Mg2+ и т.д.), заключается в том, что поле влияет на все ферменты, а физиологический эффект на уровне отдельной клетки или целого организма возникает только от деятельности тех ферментов, активность которых во время экспозиции в поле была достаточно высокой. По-видимому, похожий механизм функционирует для синусоидальных переменных электромагнитных полей с частотой в диапазоне 10 < fn < 2000 Гц и амплитудой BAC ≈ 100 мкТл в геомагнитном поле 40 < BDC < 50 мкТл [12, 7, 6, 5], а также для крайне слабых переменных полей 0,1 < BAC < 500 нТл в геомагнитном поле в том же диапазоне частот при 10 < fn < 3000 Гц [16, 5, 14].
Заключение
Наши исследования показали, что результат воздействия слабыми магнитными полями на живой организм зависит не только от физических параметров поля, но и от патерна ферментативной активности живого организма во время экспозиции. Полученные результаты в целом согласуются с тем, что экзогенные электромагнитные поля взаимодействуют одновременно со многими эндогенными полями электронов, ионов, ядер и молекул, а биологический эффект, наблюдаемый на уровне клетки, ткани или организма, представляет суперпозицию всех перечисленных эффектов [11, 15]. Более того, наши результаты позволяют усилить это достаточно общее утверждение конкретными выводами:
1. Действие слабого КМП, настроенного на циклотронную частоту неорганического иона, или очень слабого статического поля могло как стимулировать, так и тормозить процесс регенерации планарии.
2. Величина и направленность действия поля сложным образом зависели от продолжительности экспозиции и времени между операцией и началом экспозиции.
Для объяснения полученных результатов высказано предположение, что эффективность действия слабого магнитного поля определяется текущим физиологическим состоянием организма во время экспозиции. На молекулярном уровне это физиологическое состояние обусловлено активностью вполне определённых ферментов, функционирующих в конкретных клетках организма. Предложена биофизическая модель, согласно которой:
1. В живом организме, в отличие от биохимической системы in vitro, последовательность и длительность активности всех ферментов определяется не только наличием субстрата, но и внутриклеточными концентрациями неорганических ионов и может быть описана простейшими моделями ионно-осмотического гомеостаза.
2. Слабые КМП, настроенные на циклотронную частоту неорганических ионов, могут воздействовать только на определённые клетки и менять активность только тех ферментов, для которых лимитирующим фактором является локальная внутриклеточная концентрация соответствующего иона.
3. «Магнитный вакуум», так же, как и слабые КМП, настроенные на ядерные спины элементов, составляющих каркас белка, таких как 31P, 14N, могут влиять на все клетки организма и менять активность всех белков без исключения.
Это означает, что для успешного воспроизведения эксперимента необходимо задавать не только напряжённость поля и его частоту, но и параметры, характеризующие физиологическое состояние живого объекта. Для разных организмов и в разных ситуациях физиологическое состояние может определяться фазой регенерации, временем от момента стресса до начала экспозиции в электромагнитном поле, продолжительностью экспозиции, температурой среды и т.д.
Отметим, что слабые электромагнитные поля могут явиться инструментом биохимии будущего, позволяющим идентифицировать последовательность ферментативных реакций, протекающих в определённых клетках живого организма. Практическое применение слабых электромагнитных полей видится в управлении выбранными ферментативными реакциями в конкретных клетках организма.
Рецензенты:Полозов Р.В., д.ф.-м.н., ведущий научный сотрудник, ФГБУН «Институт теоретической и экспериментальной биофизики» Российской академии наук, г. Пущино;
Новиков В.В., д.б.н., ведущий научный сотрудник, ФГБУН «Институт биофизики клетки Российской академии наук», г. Пущино.
Работа поступила в редакцию 26.12.2014.